扎来普隆双释放胶囊的制备
金跃,吕贝贝,王永禄,王栋,韩杰,李学明Δ
(1.武警江苏总队南京医院 药剂科,江苏 南京 210028;2.南京工业大学 药学院,南京 211816)
扎来普隆双释放胶囊的制备
金跃1,吕贝贝2,王永禄2,王栋2,韩杰2,李学明2Δ
(1.武警江苏总队南京医院 药剂科,江苏 南京 210028;2.南京工业大学 药学院,南京 211816)
目的 制备扎来普隆双释放胶囊。方法 将扎来普隆速释片与扎来普隆控释片按照1∶1比例灌装成扎来普隆双释放胶囊。采用单因素考察法筛选优化扎来普隆双释放胶囊的处方设计和制备工艺。结果 所制得扎来普隆双释放胶囊可立即释药,产生药效,2 h后再次释放药物。结论 制备的扎来普隆双释放胶囊物作用时间延长,药效增强。
扎来普隆;双释放胶囊;控释
扎来普隆是一种新型的非苯二氮类催眠药[1],主要用于成年人失眠的短期治疗[2]。扎来普隆能选择性地结合1型苯二氮类受体亚族[3],具有镇静催眠、加快入睡、抗惊厥、抗焦虑、增加睡眠时间等优点[4-5],可广泛用于治疗与失眠症状相似的各种缺眠症状[6]。然而扎来普隆是短效治失眠药[7],有效治疗时间为3 ~4 h[8],患者服用后在夜晚或凌晨易失眠或惊醒[9],不利于保证睡眠质量[10],所以需要开发出一种长效稳定的剂型以弥补普通剂型的缺陷[11]。本文制备的扎来普隆双释放胶囊,是由扎来普隆速释片和控释片按比例灌装胶囊制得。患者服用后,速释片立即释放,产生药效,帮助患者入眠;控释片在经过3~4 h后释放发挥药效。与普通扎来普隆胶囊相比,本品作用时间延长,药效增强,可以保证患者睡眠质量。
1 材料与方法
1.1 材料
1.1.1 仪器:101A-3B烘箱(上海试验仪器厂);ZRS-8G智能溶出试验仪(天津大学无线电厂);DP3U单冲压片机(天津国药尤立科技有限公司);JZ-TY-11-4包衣机(江苏泰兴制药机械二厂);精密分析天平(德国Sartorius仪器公司);YD-20智能片剂硬度仪;(天津大学无线电厂);KQ-300DB超声仪(昆山市仪器有限公司)。
1.1.2 试剂:扎来普隆原料药(批号:20130323)是由河南中帅医药科技发展有限公司生产;扎来普隆标准品(批号:100670-200401)是由中国食品药品检定研究院生产;羧甲基淀粉钠(CMS-Na)、交联羧甲基纤维素钠(CC-Na)、交联聚维酮(PVPP)是由安徽山河辅料股份有限公司生产;微晶纤维素是由FMC Biopolymer生产;硬脂酸镁、乳糖是由上海昌为医药辅料技术有限公司生产;羟丙甲纤维素(HPMC-E5)是由上海运宏化工制剂辅料技术有限公司生产;低取代羟丙基纤维素(L-HPC)是由浙江中维药业有限公司生产;Eudragit RS 100、Eudragit RL 100是由上海卡乐康包衣技术有限公司生产;柠檬酸三乙酯是由阿拉丁试剂上海有限公司生产;磷酸是由国药集团化学试剂有限公司生产;盐酸是由上海中试化工总公司生产;氢氧化钠是由上海凯迪化学试剂有限公司生产;磷酸二氢钾是由上海凌峰化学试剂有限公司生产;无水乙醇、甲醇、乙腈是由南京化学试剂有限公司生产。
1.2 方法
1.2.1 扎来普隆双释放胶囊的制备:称取处方量的扎来普隆、微晶纤维素、羧甲基淀粉钠等原辅料,混合均匀后采用湿法制粒,颗粒烘干后加入硬脂酸镁,混匀后压片即得扎来普隆速释片;将速释片先后经溶胀层包衣、控释层包衣后得到扎来普隆控释片;将速释片和控释片按照1∶1比例灌装胶囊,即得扎来普隆双释放胶囊。
1.2.2 含量测定及方法学考察:
①色谱条件:色谱柱:Kromasil C18(250×4.6mm,5μm);流动相:乙腈-水(35∶65);流速:1.0mL/min;检测波长:230 nm;柱温:25℃;进样量:10μL。
②标准曲线:用“1.2.2①”下的流动相配制浓度为10.4、15.6、20.8、26、31.2 μg/mL的扎来普隆对照品溶液,分别进样测定。以峰面积A与样品浓度C进行线性回归,绘制标准曲线。
③回收率试验:精密称取扎来普隆适量及处方量辅料,用乙腈-水(10∶40)制成低、中、高浓度(81.4,100.4,118.8μg/mL)的扎来普隆溶液,经0.45μm滤膜过滤,取续滤液用流动相稀释5倍后进样测定,计算低、中、高浓度的回收率。
④精密度试验:取“1.2.2②”下的20.8μg/mL的供试溶液连续进样6次,测得峰面积,计算RSD。
⑤稳定性试验:将“1.2.2②”下的20.8μg/mL的供试溶液分别在于 37℃放置 1、2、3、4、6、8 h 后取样测定。
1.2.3 释放度测定方法:参照美国药典USP36-NF30 S1:36(4)中的扎来普隆胶囊质量标准初步建立释放度测定方法[12],采用桨法,供试品以900mL水为溶出介质,在转速75 r/min,温度(37.0 ±0.5)℃条件下溶出;在 5、15、30、45min、1、1.5、2、3、4、5、6、7、8 h 时定时取样 5mL,同时补加等温溶出介质[13],取溶出液用0.45μm或更小滤膜滤过后,作为供试溶液。精密称定扎来普隆对照品14 mg,置100 m L量瓶中,加甲醇5 mL使其溶解后,加水稀释至量瓶刻度;精密移取1mL,置25mL量瓶中,加水稀释至刻度,作为对照溶液。供试溶液和对照溶液进样分析后计算累积释放率[14]。
1.2.4 扎来普隆双释放胶囊中片芯(速释片)处方筛选:①稀释剂筛选:本文考察微晶纤维素、乳糖-微晶纤维素(2∶3)[15]分别作为稀释剂时,颗粒的可压性、流动性,片芯的外观性状和硬度。
②粘合剂种类筛选:本文考察分别以 HPMC-E5、HPC-L、PVP-K30[15]作为粘合剂时,颗粒的成粒性、片剂的硬度、药物释放度。
③粘合剂浓度筛选:通常粘合剂的用量和含量可通过优化实验或经验确定,本文考察浓度分别为2%、5%、10%的HPMCE5乙醇水溶液作为粘合剂时,颗粒的成粒性、片剂的硬度、药物释放度。
④ 崩解剂筛选:本文考察 L-HPC、CMS-Na、CC-Na、PVPP[15]分别作为崩解剂时对片芯崩解时限和药物释放度的影响。
1.2.5 扎来普隆双释放胶囊中控释片包衣处方与工艺筛选:本文采用薄膜包衣法在片芯外面逐次包溶胀层包衣液和控释层包衣液,以改变药物的释放位置和释放速度。
①溶胀层包衣增重筛选:采取单因素方法考察溶胀层包衣增重对药物释放的影响。以HPMC-E5溶胀包衣材料配制的乙醇水溶液作为溶胀包衣液,考察溶胀层分别增重4%、6%、8%和10%时,对药物释放的影响。
②控释层包衣液组成对药物释放的影响:在控制溶胀层包衣和控释层包衣增重不变的情况下,考察Eudragit RS 100和Eudragit RL 100 的不同配比(6∶4、7∶3、8∶2、9∶1)对药物释放的影响。
③控释层包衣增重筛选:在固定溶胀层的包衣增重和控释层包衣液中Eudragit RS 100和Eudragit RL 100的配比的条件下,本文考察控释层分别增重0.8%、1.2%、1.4%、1.6%、1.8%时对药物释放的影响。
④增塑剂使用筛选:本实验考察柠檬酸三乙酯[16]的用量分别为10%、15%、20%时对药物释放的影响。
2 结果
2.1 含量测定及方法学考察结果
2.1.1 标准曲线回归方程为:A=67950C+52497,r=0.9996。结果表明扎来普隆浓度在10.4~31.2μg/mL范围内与峰面积A呈良好线性关系(见图1)。
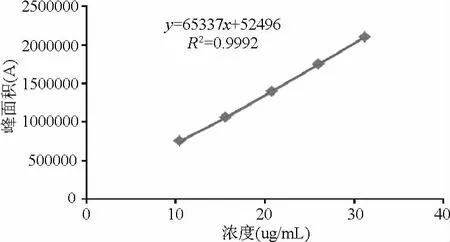
图1 扎来普隆标准曲线Fig.1 Standard curve of zaleplon
2.1.2 回收率实验:计算得到低、中、高浓度的回收率分别为103.46%,103.83%,103.39%。结果表明此方法的回收率良好,方法准确[15]。
2.1.3 精密度试验:测得峰面积RSD为0.02%,结果表明进样精密度良好[16]。
2.1.4 稳定性试验:计算得到RSD为0.09%,结果表明扎来普隆溶液在8 h内保持稳定,溶液稳定性良好。
2.2 片芯(速释片)处方筛选结果
2.2.1 稀释剂筛选结果显示,微晶纤维素单独作稀释剂时制成的片芯:可压性一般,压制的片芯表面不光滑,硬度忽大忽小,片芯在20min时的释放度为82%;而乳糖与微晶纤维素联合使用压制的片芯,可压性较好,压成的片芯表面光滑,且硬度均匀,片芯在20min时的释放度达到90%。最终选择乳糖和微晶纤维素联合使用作为稀释剂。
2.2.2 粘合剂种类筛选结果表明使用HPMC-E5作为粘合剂:制粒后颗粒较多,粉末较少,易于压制成片,硬度适中,且20min测得的药物释放度达85%以上(见表1)。

表1 不同种类粘合剂对片芯的影响Tab.1 The effect of different kinds of adhesive on tablet
2.2.3 粘合剂浓度筛选结果表明使用5%HPMC-E5乙醇水溶液作为粘合剂:颗粒较多,细粉少,成粒性较好;可压性较好,无裂片、黏冲现象,压制的片芯硬度适中,且药物释放度达85%以上,最终选择5%HPMC-E5乙醇水溶液作最终粘合剂(见表2)。

表2 不同浓度HPMC-E5乙醇水溶液对片芯的影响Tab.2 Effect of different concentrations of HPMC-E5 on tablet
2.2.4 崩解剂在处方中的添加方式均相同,结果表明:CMS-Na作崩解剂制备的片芯药物释放度最高,崩解时限符合中国药典规定的普通片崩解时限,最终选择CMS-Na作为崩解剂(见表3)。

表3 不同崩解剂对片芯的影响Tab.3 Effect of different kinds of disintegrant on tablet
2.3 扎来普隆双释放胶囊中控释片包衣处方与工艺筛选结果
2.3.1 溶胀层包衣增重筛选结果表明溶胀层包衣增重8%~10%的处方片芯在2 h内零释放,在4 h时达到爆破式释放且累计释放度大于85%直至溶出完全,最终选择溶胀层包衣增重为8%~10%(见图2)。

图2 溶胀层包衣增重对药物释放的影响Fig.2 Effect of different coating levels of swelling layer on drug release
2.3.2 控释层包衣液组成对药物释放的影响结果表明:在固定溶胀层和控释层的包衣增重前提下,Eudragit RS 100和Eudragit RL 100的配比不同,影响时滞也不同:当配比为6∶4时,药物在2 h内释放较快;当配比为8∶2、9∶1时,药物释放时滞较长,且药物释放度减小;当配比为7∶3时,片芯在2 h内零释放,在4 h时达到爆破式释放。最终选择Eudragit RS 100-Eudragit RL 100(7∶3)乙醇水溶液作为控释层包衣液(见图3)。
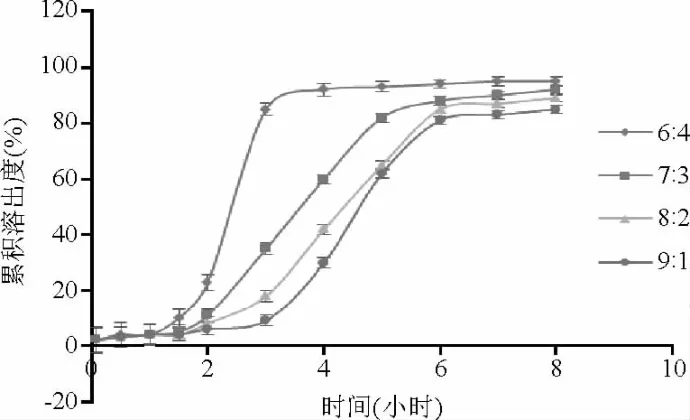
图3 控释层包衣组成对药物释放的影响Fig.3 Effect of different ratio of controlled release layer on drug release
2.3.3 控释层包衣增重筛选结果表明:随着控释层衣膜厚度的增加,时滞延长,药物释放降低。当控释层包衣增重在1.2%~1.4%时,药物呈现爆破式释放,接近理想释放曲线。最终选择控释层包衣增重为1.2%~1.4%(见图4)。
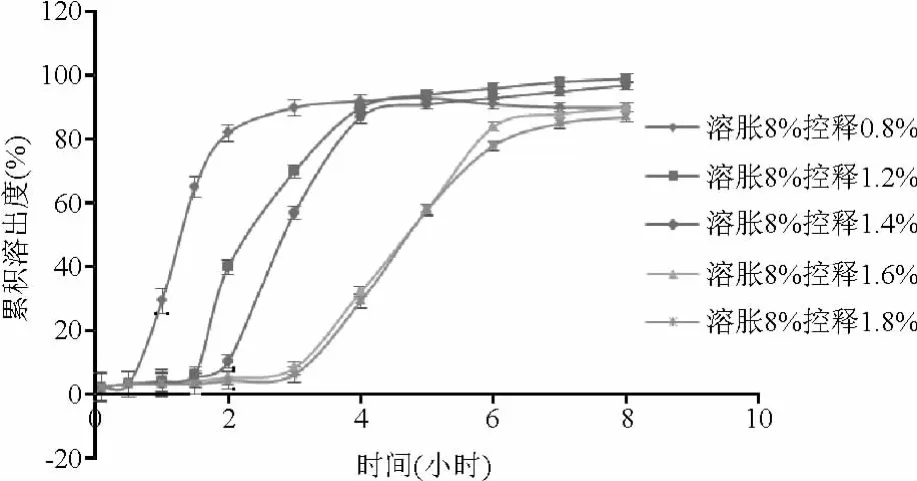
图4 控释层包衣增重对药物释放的影响Fig.4 Effect of different coating levels of controlled release layer on drug release
2.3.4 增塑剂使用筛选结果表明,增塑剂的不同用量对药物释放的影响不大,其中柠檬酸三乙酯用量为20%时,相对于10%、15%的用量药物累积溶出度稍高,所以选定柠檬酸三乙酯的用量为20%(见图5)。

图5 增塑剂使用对药物释放的影响Fig.5 Effect of plasticizer on drug release
2.4 扎来普隆双释放胶囊溶出曲线 按照既定处方自制3批扎来普隆双释放胶囊,由于上市制剂为普通胶囊,与自制扎来普隆双释放胶囊剂型不同,释药行为不同,释放曲线不同,故暂不作比较。3批胶囊溶出结果表明,3批自制胶囊可立即释药,产生药效,在2h时再次释药,增强药效,延长药物作用时间(见图6)。

图6 自制胶囊溶出曲线图Fig.6 The dissolution curve of self-made capsule
3 讨论
本文对扎来普隆双释放胶囊处方及工艺进行筛选,发现控释层包衣液的组成可影响药物释放,调整包衣辅料比例,可改善药物释放效果。控释层的包衣增重是决定药物释放时滞的关键,包衣增重过大,导致药物延迟释放或不释放;包衣增重过小,无法起到改变药物释放位置和速度的作用,或引起提前释放的反作用。增塑剂可改变高分子薄膜的物理机械性质,使其更具柔软性,有利于形成完整薄膜。常用的增塑剂有柠檬酸三乙酯、癸二酸二乙酯、聚乙二醇等,其中柠檬酸三乙酯最稳定,是配合丙烯酸树脂包衣材料最常用的增塑剂。本文制备的扎来普隆双释放胶囊有效作用时间为7~8 h,延长药物作用时间,弥补了普通剂型的缺陷,能够保证患者的睡眠质量。
[1] Drover D, Lemmens H, Naidu S, et al.Pharmacokinetics,pharmacodynamics,and relative pharmacokinetic/pharmacodynamic profiles of zaleplon and zolpidem[J].Clinical therapeutics, 2000,22(12):1443-1461.
[2] 陆峥.失眠症的诊断和药物治疗现状[J].医药专论,2011,32(4):32-37.
[3] Elie R,Rüther E,Farr I,et al.Sleep latency is shortened during 4 weeks of treatment with zaleplon,a novel nonbenzodiazepine hypnotic.Zaleplon Clinical Study Group[J].The Journal of clinical psychiatry,1999,60(8):536-544.
[4] Ancoli-Israel S,Walsh JK,Mangano RM,et al.Zaleplon,a novel nonbenzodiazepine hypnotic,effectively treats insomnia in elderly patientswithout causing rebound effects[J].Primary care companion to the Journal of clinical psychiatry,1999,1(4):114.
[5] Elie R.Zaleplon is effective in reducing time to sleep onset[J].European Neuropsychopharmacology,1999,9:361.
[6] 杨广声,钱东丽,马建东.扎来普隆治疗失眠症的临床疗效与安全性评价[J].Herald of Medicine,2007,26(12):1452-1456.
[7] Richardson GS,Roth T,Kramer JA.Management of insomnia--the role of zaleplon[J].MedGenMed:Medscape general medicine,2002,4(1):9-9.
[8] Moore EC.Zaleplon ( Sonata, Wyeth Ayerst):A new, nonbenzodiazepine sedatative/hypnotic[J].Journal of the Pharmacy Society ofWisconsin,Sept/Oct,2000:33-38.
[9] Rosen A S,FourniéP,Darwish M,etal.Zaleplon pharmacokinetics and absolute bioavailability[J].Biopharmaceutics&drug disposition,1999,20(3):171-175.
[10] Walsh JK,Beer B,Erman M,et al.Treatment of primary insomnia comparing zaleplon,triazolam,and placebo[C]//9th Annual Meeting sleep Research society.1995,79.
[11] 周兰.失眠症治疗的最新进展[J].社会心理学,2009,23(1):116-120.
[12] Waghmare A,Pore Y,Kuchekar B.Developmentand characterization of zaleplon solid dispersion systems:a technical note[J].AAPS PharmSciTech,2008,9(2):536-543.
[13] Zhang B, Zhang Z, Tian Y, et al.High-performance liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry determination of zaleplon in human plasma[J].Journal of pharmaceutical and biomedical analysis,2006,40(3):707-714.
[14] Giroud C,Augsburger M,Menetrey A,et al.Determination of zaleplon and zolpidem by liquid chromatography-turbo-ionspray mass spectrometry:application to forensic cases[J].Journal of Chromatography B,2003,789(1):131-138.
[15] 姚静.药用辅料应用指南[M].北京:中国医药科技出版社,2011:53-234.
[16] 汪多仁.柠檬酸三乙酯的开发与应用进展[J].精细化工原料及中间体,2013(12):25-30.
[17] Foda N H,Abd Elbary A,El-Gazayerly O.Reversed-Phase Liquid Chromatographic Determination of Zaleplon in Human Plasma and its Pharmacokinetic Application[J].Analytical letters,2006,39(9):1891-1905.
[18] Metwally FH, Abdelkawy M, Abdelwahab NS.Application of spectrophotometric,densitometric, and HPLC techniques as stability indicating methods for determination of Zaleplon in pharmaceutical preparations[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2007,68(5):1220-1230.
(编校:王俨俨)
Preparation of zalep lon dual-release capsules
JIN Yue1,LV Bei-bei2,WANG Yong-lu2,WANG Dong2,HAN Jie2,LIXue-ming2Δ
(1.Department of Pharmacy,Nanjing Hospital of Jiangsu General Corps of Peoples Armend Police,Nanjing 210028,China;2.School of Pharmaceutical Sciences,Nanjing University of Technology,Nanjing,211816,China)
Objective To prepare zaleplon dual-release capsules.Methods Zaleplon rapid-release tablets and zaleplon controlled-release tablets(1∶1)were filled in one hard capsule to prepare zaleplon dual-release capsules.The formulation design and preparation of the capsuleswere screened and optimized by single factor test.Results The prepared zaleplon dual-release capsulesmay release drug immediately,and release drug once again after 2 hours.Conclusion The prepared zaleplon dual-release capsules could prolong action and enhance efficacy.
zaleplon;dual-release capsule;controlled release
R94
A
1005-1678(2014)06-0171-04
江苏省博士后科研资助计划(1301012A);江苏政府留学奖学金(2013);国家自然科学基金资助项目(81170492)
金跃,男,硕士,主任药师,研究方向:药物制剂,E-mail:jinyue3001@163.com;李学明,通信作者,男,博士,教授,研究方向:纳米医学,E-mail: xuemingli@njtech.edu.cn。

