富硒酵母对小鼠IL-2水平、空斑形成细胞溶血能力及肠道菌群的影响
秦顺义, 黄宝霞, 秦建华, 王宏祥, 王 昕, 张建斌, 崔 君
(1.天津农学院动物科学与动物医学学院,天津西青 300384;2.河北农业大学动物医学院,河北保定 071001)
硒是人和动物所必需的微量元素,具有多种重要的生物学功能,缺硒可导致动物生产性能、繁殖性能和免疫功能降低 (Weeks等,2012;Chen,2012),因此补硒已成为畜牧业生产中的常规措施。由于亚硒酸钠等无机硒源吸收率较低,毒性较高,且易对环境造成污染,故其应用受到诸多限制。富硒酵母因具有硒含量高、成本低、生物利用率高、毒性小、对环境污染小等优点,已成为最有可能替代亚硒酸钠的有机硒源(Alimohamady等,2013;王宏祥等,2013)。本试验研究富硒酵母对小鼠血浆白细胞介素2(IL-2)水平、空斑形成细胞溶血能力及肠道菌群的影响,以期为富硒酵母的推广应用提供理论依据。
1 材料与方法
1.1 试验材料及主要仪器 富硒酵母:由南京农业大学动物医学院畜禽营养代谢病研究室研制,硒含量为500 mg/kg,其中有机硒含量在90%以上。小牛血清 (中国医学科学院血液学研究所);绵羊红细胞(SRBC)和经绵羊红细胞吸收过的豚鼠血清补体 (江苏省农科院);IL-2测定试剂盒 (解放军总医院科技开发中心放免所)。FMJ-182放射免疫γ-计数器 (上海原子核研究所);721型可见分光光度计(上海菁华科技仪器有限公司);亚硒酸钠(SS,分析纯,天津市化学试剂研究所)。
1.2 试验设计 昆明系清洁级小鼠60只,雌雄各半,体重18~22 g,经3 d的适应性饲养后,随机平均分为3组(雌雄各半):对照组、亚硒酸钠组和富硒酵母组。对照组每日灌胃0.5 mL蒸馏水,亚硒酸钠组和富硒酵母组每日分别灌胃亚硒酸钠(2 μg Se/mL)和富硒酵母(2 μg Se/mL)各 0.5 mL。小鼠自由采食(普通配合饲料)、饮水,饲养过程中,每天换水,隔日换垫料。整个试验期为28 d。
1.3 测定指标及方法 于试验第11天,每组随机选择8只小鼠(雌雄各半),每鼠腹腔注射SRBC 0.2 mL进行致敏。
1.3.1 血浆中IL-2含量的测定 于试验第15天,从致敏小鼠眼眶取血,分离血浆。血浆IL-2含量用放射免疫法在FMJ-182放射免疫γ-计数器上测定。IL-2放射免疫试剂盒由解放军总医院科技开发中心放免所提供,严格按照说明书进行操作。
1.3.2 脾脏空斑形成细胞溶血能力测定 于试验第15天,取致敏小鼠脾脏制成匀浆,用pH 7.4的磷酸缓冲液(PBS)洗涤两次,制成细胞悬液(5×106个/mL),按徐叔云等(2002)的分光光度法测定空斑形成细胞溶血能力:取细胞悬液0.5 mL,加入0.2%的SRBC和10%经SRBC吸收过的豚鼠血清补体各0.5 mL,混匀;另设不加补体的作为空白;置于37℃的水浴锅中,保温1 h,3000 r/min离心5 min,取上清于413 nm处空白调零测吸光值。
1.3.3 肠道菌群的分析 试验结束后,分别用SP、EMB、EC、BLB 和 LBS培养基培养葡萄球菌、大肠杆菌、肠球菌、双歧杆菌及乳杆菌。以无菌方法取小鼠盲结肠内容物0.1~0.2 g,置已称重的带玻珠的灭菌小管中,再次称重,计算出小鼠肠内容物重量。按 1∶10(W/V)加入适量稀释液(灭菌的0.05%酵母粉生理盐水溶液),然后将小管置于振荡器上充分振荡10 min,使其均质化后,再依次进行10倍系列稀释至10-9,然后取100 μL加入到各种培养基上,涂布均匀,每种培养基每个稀释度涂布3个平板。接种完毕,分别将其进行需氧和厌氧培养,37℃,24 h(需氧培养)或 72 h(厌氧培养)后观察结果。根据菌落特点、染色镜检,计算各平板上的菌落数,并计算出每克粪便中该菌的数量,结果以每克肠道内容物中的菌落数的对数表示(lg cfu/g)。
1.4 数据处理及统计方法 数据均以 “平均数±标准差”表示,采用SPSS 12.0软件进行统计分析,采用方差分析进行差异显著性检验,如方差分析有显著性差异,再进行多重比较。
2 结果
2.1 富硒酵母对小鼠血浆中IL-2含量和空斑形成细胞溶血能力的影响 由表1可知,富硒酵母组、亚硒酸钠组小鼠血浆IL-2含量和空班形成细胞溶血能力的OD413较对照组分别提高18.24%(P< 0.01)、17.65%(P < 0.05)和 12.82%(P < 0.01)、7.69%(P<0.05);富硒酵母组小鼠血浆IL-2含量和空班形成细胞溶血能力的OD413较亚硒酸钠组分别提高0.50%和4.76%(P>0.05)。
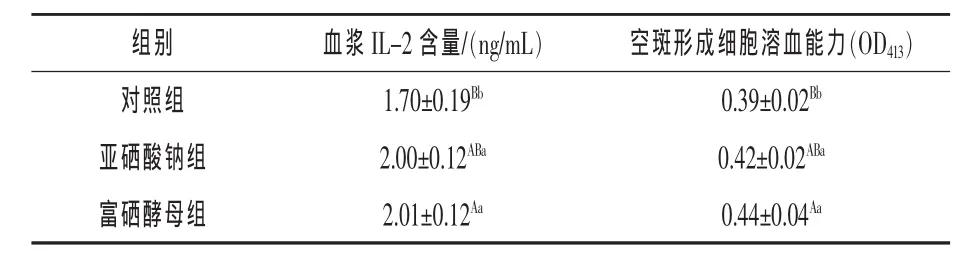
表1 富硒酵母对小鼠空斑形成细胞溶血能力和血浆IL-2含量的影响(n=8)
2.2 富硒酵母对小鼠肠道菌群的影响 从表2可知,富硒酵母组、亚硒酸钠组和对照组小鼠肠道中葡萄球菌、肠球菌、肠杆菌、乳杆菌和双歧杆菌数量均无显著差异(P>0.05)。

表2 富硒酵母对小鼠肠道菌群的影响lg cfu/g
3 讨论
3.1 富硒酵母对小鼠空斑形成细胞溶血能力的影响 空斑形成细胞溶血能力是衡量机体体液免疫功能的重要指标。空斑形成细胞溶血能力越强,说明机体的体液免疫功能越强。杜莹等(2006)研究结果也表明富硒蛋白能够促进小鼠溶血空斑的形成。叶洪平和陈超(2010)也证实富硒绿茶可明显促进小鼠溶血空斑的形成。本试验结果表明,在外来抗原绵羊红细胞作用下,富硒酵母和亚硒酸钠均可显著提高小鼠脾空斑形成细胞溶血能力,但二者作用效果无显著差异。这说明补硒可有效增强机体的体液免疫功能。
3.2 富硒酵母对小鼠血浆中IL-2水平的影响抗原活化的T淋巴细胞分泌的IL-2细胞因子,不仅是T淋巴细胞的生长和活化因子,而且可促进B细胞、NK细胞、巨噬细胞等多种细胞的增殖和分化。在本试验中,富硒酵母组和亚硒酸钠组小鼠血浆IL-2均显著高于对照组,且富硒酵母组和亚硒酸钠组小鼠血浆IL-2含量无显著差异。由此表明,富硒酵母可促进淋巴细胞分泌IL-2,进而增强小鼠的细胞免疫功能,但其作用效果与亚硒酸钠相比无显著差异。这与秦顺义等(2007)和高建忠等(2006)在羔羊和仔猪上的研究结果相一致。杜立芹等(2000)研究也证实,富硒酵母可使环磷酰胺造成的免疫低下小鼠血清IL-2水平显著增高。在体外试验中,He等(2004)和 Brown 等(1985)也报道了类似的研究结果。
3.3 富硒酵母对小鼠肠道菌群的影响 动物体内肠道菌群主要包括专性厌氧菌、兼性厌氧菌和需氧菌。在正常状态下,肠道菌群的组成、种类都是较为稳定的,肠道菌群之间的平衡状态在维持动物机体的正常功能以及抵抗外袭菌方面起着重要的作用(O'Hara和 Shanahan,2007)。 本试验结果表明,富硒酵母对小鼠肠道中的葡萄球菌、肠球菌、肠杆菌、乳杆菌和双歧杆菌数量无显著影响,说明富硒酵母不能改变小鼠肠道菌群的构成和数量。 陈生龙(2009)和 Mathew等(1998)的研究表明,活酵母或酵母培养物对断奶仔猪肠道菌群的构成无影响。周淑芹和孙文志(2004)研究结果表明酵母培养物可显著减少肉仔鸡盲肠中大肠杆菌的数量并可增加双歧杆菌的数量。胡友军等(2003)研究结果也证实活性酵母可显著减少早期断奶仔猪肠道菌群中大肠杆菌的数量,并可调节肠道微生物菌群平衡。以上研究结果的差异可能与酵母菌的种类以及试验动物的种类有关。
4 小结
本试验结果表明,富硒酵母可显著提高小鼠血浆IL-2水平和空斑形成细胞溶血能力,而对小鼠肠道菌群无显著影响。
[1]陈生龙.活酵母对断奶仔猪生产性能、免疫功能和肠道微生物区系的影响:[博士学位论文][D].福州:福建农林大学,2009.
[2]杜立芹,程五凤,史奎雄,等.硒对小鼠免疫功能的影响[J].上海第二医科大学学报,2000,20(1):29 ~ 31.
[3]杜莹,王晓燕,解清,等.富硒蛋白对小鼠免疫功能影响[J].中国公共卫生,2006,22(1):84 ~ 85.
[4]高建忠,黄克和,秦顺义.不同硒源对仔猪组织硒沉积和抗氧化能力的影响[J].南京农业大学学报,2006,29(1):85 ~ 88.
[5]胡友军,林映才,余德谦.活性酵母对早期断奶仔猪肠道微生物区系、肠黏膜形态和挥发性盐基氮的影响[J].养猪,2003,4:3~6.
[6]秦顺义,黄克和,高建忠,等.不同硒源对羔羊抗氧化能力、细胞因子及T3、T4 的影响[J].南京农业大学学报,2007,30(2):102 ~ 106.
[7]王宏祥,王昕,张建斌,等.不同硒源对蛋鸡组织硒含量、GPX活性和肝脏 GPX-4 mRNA 表达的影响[J].中国饲料,2013,11:26 ~ 28.
[8]徐叔云,卞如濂,陈修.药理实验方法学第3版[M].北京:人民卫生出版社,2002:911 ~ 922.
[9]叶洪平,陈超.富硒绿茶对小鼠部分免疫功能的影响 [J].当代医学,2010,16(10):19 ~ 21.
[10]周淑芹,孙文志.酵母培养物与抗生素对肉仔鸡生长性能及免疫机能影响的研究[J].畜牧与兽医,2004,36(11):9 ~ 11.
[11]Alimohamady R,AliarabiH,BahariA,etal.Influence ofdifferent amounts and sources of selenium supplementation on performance,some blood parameters,and nutrient digestibility in lambs[J].Biol Trace Elem Res,2013,154(1):45 ~ 54.
[12]Brown R L,Griffith R L,Ruscetti F W,et al.Modulation of interleukin 2 release from a primate lymphoid cell line in serum-free and serum-containing media[J].Cell Immunol,1985,92:14 ~ 21.
[13]Chen J.An original discovery:selenium deficiency and Keshan disease(an endemic heart disease)[J].Asia Pac J Clin Nutr,2012,21(3):320 ~ 326.
[14]He S,Wu B,Chang X,et al.Effects of selenium on peripheral blood mononuclear cell membrane fluidity,interleukin-2 production and interleukin-2 receptor expression in patients with chronic hepatitis[J].World J Gastroenterol,2004,10(23):3531 ~ 3533.
[15]Mathew A G,Chattin S E,Robbins C M,et al.Effects of a direct-fed yeast culture on enteric microbial populations,fermentation acids,and performance of weanling pigs[J].J Anim Sci,1998,76(8):2138 ~ 2145.
[16]O'Hara A,Shanahan F.Mechanisms of action of probiotics in intestinal diseases[J].Sci World J,2007,7:31 ~ 46.
[17]Weeks B S,Hanna M S,Cooperstein D.Dietary selenium and selenoprotein function[J].Med Sci Monit,2012,18(8):127 ~ 132.■

