饲料用脂肪酶产生菌——黑曲霉G55高产菌株的选育
张 谦, 贾 佳, 林 智, 郭宏涛, 王剑英
(1.深圳技师学院科研办,广东深圳 518045;2.深圳市绿微康生物工程有限公司,广东深圳 518055)
脂肪酶是脂肪代谢的关键酶,它可将脂肪水解为游离脂肪酸、甘油和甘油单酯供动物吸收利用(刘德海等,2012)。研究表明,单胃动物自身能够分泌内源性脂肪酶,但幼龄动物和特殊时期的动物,因为消化机能不健全或内源性脂肪酶分泌不足,造成脂肪消化吸收率低,需要适当添加外源性脂肪酶等以补充其内源酶的不足,而提高动物存活率和生产性能(赵必和李学海,2014;翁晓辉等,2013)。
黑曲霉(Aspergillus niger)是一种重要的微生物,广泛应用于生物酶制造。工业育种技术的运用是提高菌种产量,降低发酵成本的重要手段之一。贺胜英等(2011)和朱琪等(2013)通过工业育种技术,对产脂肪酶黑曲霉实施诱变和选育获得优良菌株,提高菌株的产酶能力。本研究以脂肪酶产生菌Aspergillus niger G55为出发菌株,分别采用紫外线(UV)和亚硝基胍(NTG)单因子诱变和复合诱变的方法处理菌株,使影响产量的基因发生突变,提高菌株的产酶能力,通过自然分离使正向突变株得到显现,结合筛选最终获得稳定的高产脂肪酶菌株。
1 材料与方法
1.1 材料
1.1.1 菌株来源 黑曲霉为深圳绿微康生物工程有限公司提供,该菌株现保藏于公司酶制剂研究中心,保藏号:Aspergillus niger G55。
1.1.2 试剂和仪器 主要试剂:豆粕粉、蔗糖、葡萄糖、玉米淀粉、琼脂等培养基所用试剂均为国产化学级试剂。亚硝基胍(NTG)购自sigma公司。
仪器:净化工作台(苏州净化设备厂);检测用台式紫外灯(灯管为JLCT50330-10,深圳乔麟光电有限公司);PHS-25型pH计(杭州科晓化工仪器设备有限公司);Avanti J-30I高效离心机(美国贝克曼库尔特有限公司)。
1.1.3 培养基 斜面培养基:NaNO33 g,K2HPO41 g,MgSO4·7H2O 0.01 g,蔗糖 30 g,琼脂 15 g,蒸馏水定容至1000 mL,pH 7.0。
种子培养基:NaNO33 g, 葡萄糖30 g,NaH2PO40.5 g,K2SO40.1 g,蒸馏水定容至 1000 mL,pH 7.0。
发酵培养基:豆粕粉 40 g,NaNO310 g,葡萄糖 20 g, 玉米淀粉 10 g,NaH2PO42 g,K2SO40.2 g,CaCO35 g,蒸馏水定容至 1000 mL,pH 7.2。
1.2 方法
1.2.1 菌株培养 斜面种子培养条件:将-80℃保藏的菌株或经分离的单菌落,用接种针取1环均匀涂布于斜面培养基表面,于30℃恒温静置培养3 d,制备成斜面种子,于3~5℃冰箱保存备用。
摇瓶种子培养条件:将斜面种子用接种针取1环接种于装有30 mL种子培养基的250 mL摇瓶,于30℃ 恒温220 r/min振荡培养20~32 h,见培养液浑浊,OD600值在0.24~0.5,得到摇瓶种子备用。
摇瓶发酵培养条件:将培养好的摇瓶种子液按照1%接种量装于有50 mL发酵培养基的500 mL摇瓶中,于30℃恒温220 r/min振荡培养 48 h,发酵液在 10000 r/min,4℃离心 10 min,取上清液检测脂肪酶活性。
1.2.2 诱变因子和诱变方法 自然分离方法:取斜面种子试管,加入5 mL无菌蒸馏水用接种针刮下表面孢子,转移到盛有玻璃珠瓶中振荡2 min形成单孢子悬液,孢子量约107个/mL,将该单孢子液稀释,加入到20 mL斜面培养基的平皿中,控制菌落数为20~50个/皿,30℃静置培养3 d,进行摇瓶发酵,测定每一个菌落产脂肪酶活性。
UV诱变方法:取斜面种子制备成单孢子悬液,孢子量约107个/mL,取2 mL单孢子悬液于平皿中,在波长254 nm,功率10 W紫外灯下,照射距离20 cm,照射时间0~25 s,照射时将平皿往复振荡,照射后的平皿用黑布包裹并在暗环境下稀释分离,涂布平皿培养,培养方法同自然分离方法。
NTG诱变方法:取斜面种子以pH 6.0磷酸缓冲液制备单孢子悬液,孢子量约107个/mL,取1 mL单孢子悬液于20 mL试管,加入3 mL的NTG溶液(最终浓度为1×10-6mmol/mL)充分混合,于30℃恒温水浴振荡处理0~60 min,将诱变后的菌悬液在10000 r/min,4℃离心10 min,用无菌生理盐水洗涤终止反应,并进行稀释分离,涂布平皿培养,培养方法同自然分离方法。
UV+NTG诱变方法:取斜面种子制备成单孢子悬液,孢子量约107个/mL,取2 mL单孢子悬液于平皿中,在紫外灯下照射15 s,取1 mL孢子液于20 mL试管中,加入3 mL的NTG溶液(最终浓度为1×10-6mmol/mL),充分混合,于30℃恒温水浴振荡处理0~60 min,诱变后的菌悬液处理方法同NTG诱变方法,培养方法同自然分离方法。
1.2.3 筛选方法 菌株经过自然分离和不同诱变处理后分离得到的正常菌落直径为1.5~2 mm,呈白色,边缘整齐。观察菌落形态,根据异常菌落和正常菌落的比值计算菌落变异率;用消毒牙签取少许菌体接种于鉴别培养基平皿,根据菌落所形成的荧光圈大小,判断该菌落产脂肪酶活性,实施菌落的初筛。对于初筛得到的高产菌落转接斜面培养并进行3批复筛,每一批复筛做3瓶平行,测定菌株的产脂肪酶活性。
1.2.4 斜面传代试验 将经过筛选得到的高产脂肪酶菌株的斜面种子连续传接5代,实施摇瓶发酵,测定菌株经过传代后的产脂肪酶活力,考察菌株的遗传稳定性。
1.2.5 脂肪酶活性测定 初筛检测方法:在斜面培养基中添加1.2 g/L三丁酸甘油脂和显色剂罗丹明B(Rhodamine B,Sigma)构成固体鉴别培养基,产脂肪酶的菌落在该培养基上可以形成浅黄色荧光圈,并判断菌落的产脂肪酶活性(Kouker等1987)。
复筛检测方法:以碱滴定法测定发酵液中脂肪酶活性。脂肪酶活性单位定义为:在一定温度和pH条件下,每分钟释放出1μmol脂肪酸的酶量,定义为1 个酶活性单位,以 U/g(U/mL)表示(Tian 等 2013)。
2 结果及分析
2.1 诱变及筛选效果评价
2.1.1 UV诱变及筛选 当UV照射微生物细胞时DNA大量吸收260nm光谱而引起突变或杀伤作用 (施巧琴和武松刚,2003)。以脂肪酶产生菌Aspergillus niger G55为出发菌株,用UV照射0~25 s,稀释分离,在平皿中培养得到单菌落。以未经UV照射的G55菌株为对照,计算每个UV照射时间点的死亡率和菌落变异率,结果见图1。从经过UV照射的菌株中挑选出931株单菌落进行初筛,确定了产酶活性高出对照菌株5%以上的菌落共92株,接种斜面实施复筛,经过3批复筛,得到5个产脂肪酶活性稳定高于G55菌株的菌株,结果见表1和表2。
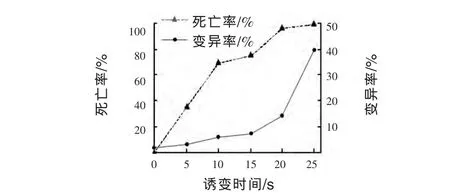
图1 UV对于G55菌株的诱变效果
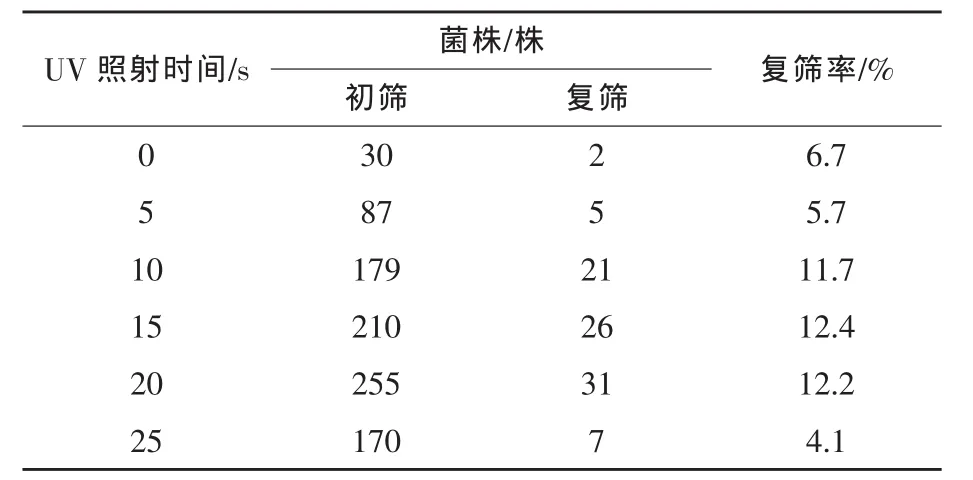
表1 G55经UV诱变的初筛结果
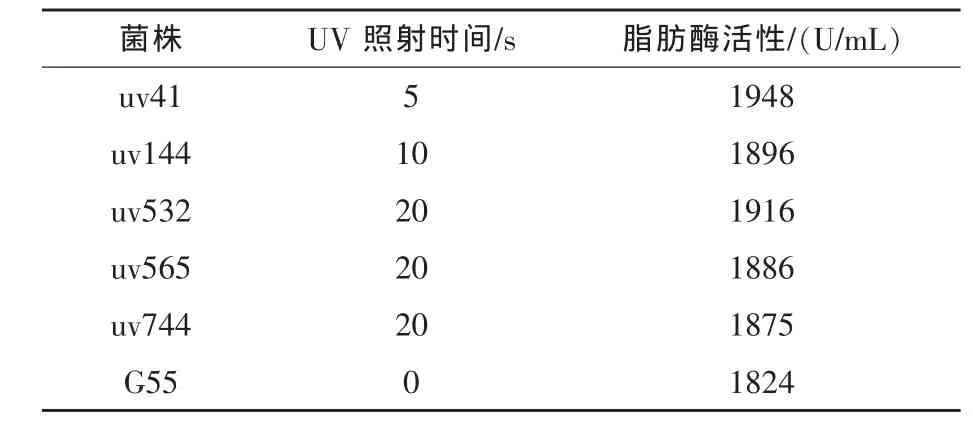
表2 G55与复筛菌株产脂肪酶活性比较
由图1可见,G55菌株不实施UV照射的对照组,菌落自然变异率为2.1%。照射10~15 s时为亚致死量的照射时间,菌株死亡率为69.5%~74.7%,变异率为5.6%~7.8%。当照射时间为20~25 s时,菌株死亡率96.6%~99.8%,变异率显著提高。
由表1可见,经过初筛进入复筛的菌落大多集中在UV照射10、15、20 s的3个组中,出现正变菌株较多,复筛过程绝大多数菌株没有表现出稳定的高产特性,产脂肪酶活性退化。由表2可见,通过复筛的5个菌株以uv41最佳,UV照射时间为5 s,产脂肪酶活性为1948 U/mL,高于G55菌株6.7%。对此菌株进行了2次分离纯化得到uv41(s)。
2.1.2 NTG诱变及筛选 NTG是一种烷化剂,可以诱发并取代DNA分子中活泼的氢原子,直接与一个或者多个碱基起烷基化作用,从而改变DNA分子结构,引发突变 (施巧琴等,2003)。以Aspergillus niger uv41(s)为新的出发菌株,用 NTG诱变处理(最终浓度为1×10-6mmol/mL),经过稀释分离,在平皿中培养得到单菌落,诱变效果见图2。从NTG诱变菌株中,挑选出1085个单菌落实施初筛,从中挑选112株接种斜面实施复筛,经过3批复筛,得到8个产脂肪酶活性稳定高于uv41(s)菌株的菌株,结果见表3和表4。
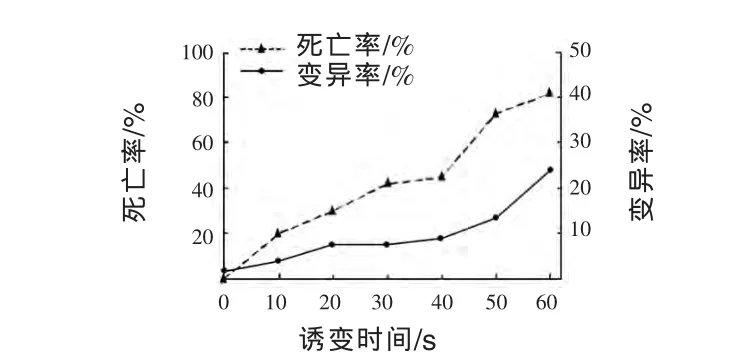
图2 NTG对于uv41(s)菌株的诱变效果
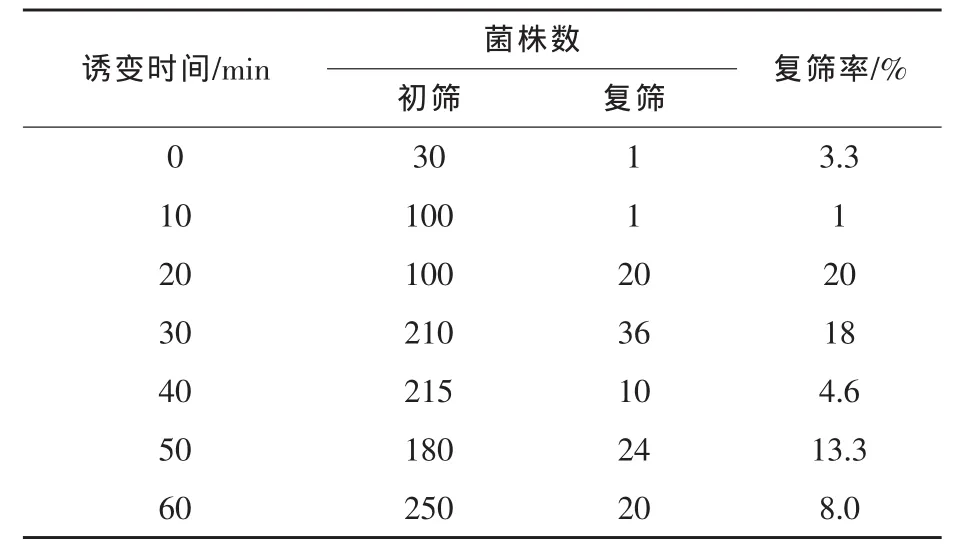
表3 uv41(s)经NTG诱变的初筛结果

表4 uv41(s)与复筛菌株产脂肪酶活性比较
由图2可见,uv41(s)菌株不实施诱变的对照组,菌落自然变异率为2.7%。NTG诱变10~40 min时为亚致死诱变时间,死亡率为20.1%~45.4%;诱变50 min时,死亡率显著提高,变异率仅为13.3%;当诱变60 min以上时,菌株死亡率为82.2%,变异率接近24.7%。
由表3可见,经过初筛进入复筛的菌落大多集中在NTG诱变20、30、50 min 3个组中,出现正变菌株的几率比较高,进行复筛的110株,绝大多数菌株出现产脂肪酶活性退化。由表4可见,通过复筛的8株菌中以ntg349最佳,NTG诱变时间为30 min时,产脂肪酶活性为2323 U/mL,高于uv41(s)菌株15.7%。对此菌株进行了2次分离纯化得到 ntg349(s)。
2.1.3 UV+NTG复合诱变及筛选 不同诱变剂可以诱发菌株DNA发生不同形式的改变和变异,在微生物育种过程中通过有目的的选择两种或者两种以上的诱变剂,实施复合诱变,可以实现DNA分子的多重变异和叠加效用,提高菌株对诱变剂的敏感性,获得更好的育种效果 (施巧琴和武松刚,2003)。 以 Aspergillus niger ntg349(s)为出发菌株,采用UV+NTG复合诱变,首先用UV诱变,照射时间为15 s,然后,将孢子液加入到NTG溶液(最终浓度为1×10-6mmol/mL)中,诱变时间0~60 min,经过稀释分离,在平皿中培养得到单菌落,UV+NTG复合诱变效果评价见表5。挑选出1152株单菌落实施初筛,从中挑选118株接种斜面进行复筛,经过3批复筛,有11个菌株的产酶活性稳定高于ntg349(s)菌株,结果见表6和表 7。
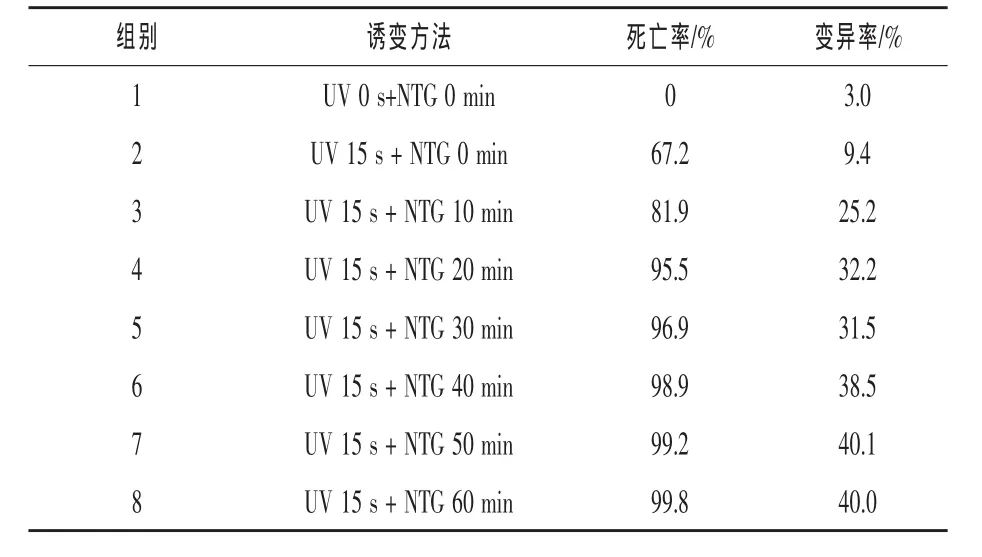
表5 UV+NTG对于ntg349(s)菌株的诱变效果
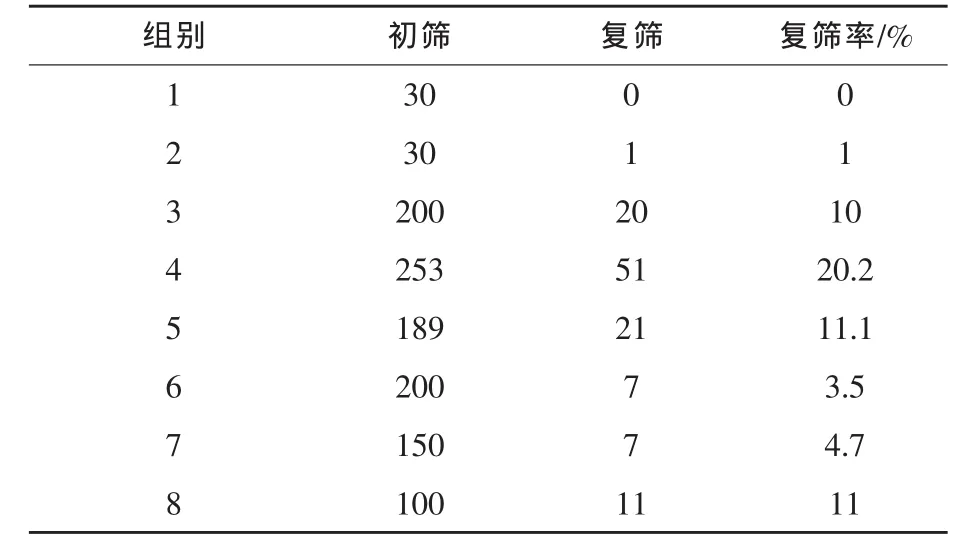
表6 ntg349(s)经UV+NTG诱变的初筛结果
由表5可见,单独使用UV照射ntg349(s)15 min时,菌株死亡率为67.2%,变异率为9.4%,与G55对UV的耐受程度相近。采用UV复合NTG诱变时,表现出较高的死亡率和变异率,随着复合诱变剂量加大,菌株死亡率在90%以上,变异率在30%以上。
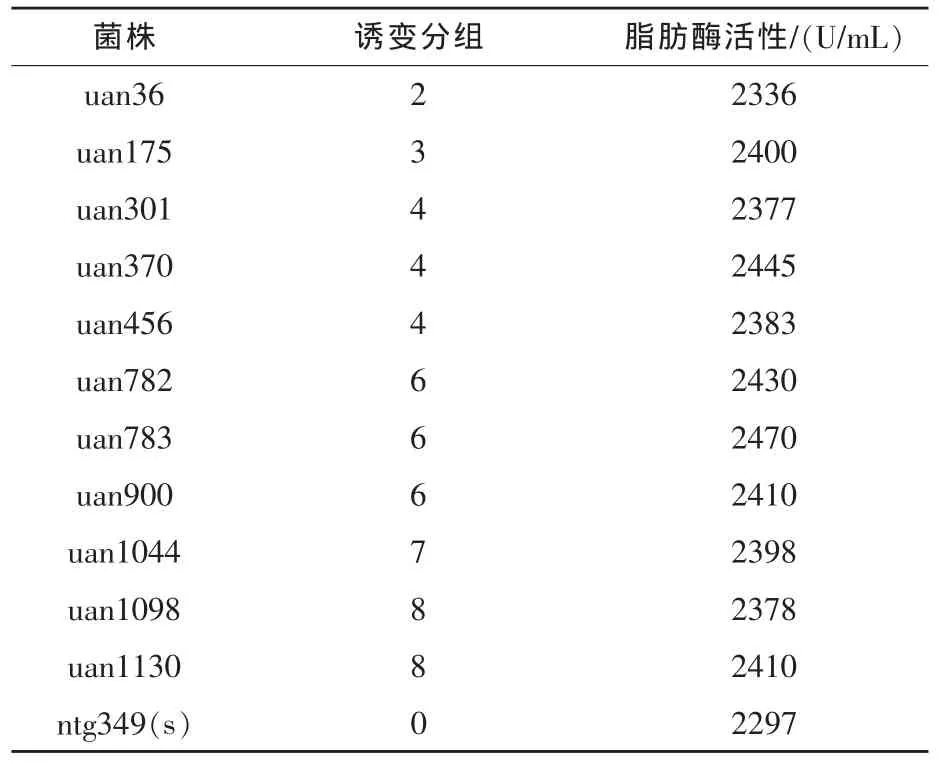
表 7 ntg349(s)与复筛菌株产脂肪酶活性比较
由表6可见,经过初筛进入复筛的菌落在UV+NTG诱变的3、4、5组和8组出现正变菌株的几率比较高,有118株进行了复筛。由表7可见,通过复筛所得到的11株高产菌株中以uan783最佳,菌株诱变剂量为UV 15 s+NTG 40 min(最终浓度为 1×10-6mmol/mL),产脂肪酶活性为 2470 U/mL,高于ntg349(s)菌株7.5%。对此菌株分别进行了3次分离纯化,得到 uan783(s)。
2.2 菌株的遗传稳定性研究
2.2.1 G55菌株系谱 脂肪酶产生菌Aspergillus niger G55为出发菌株,针对于UV和NTG单因素诱变和复合诱变获得的8个菌株的系谱如图3所示。
2.2.2 菌株的斜面传代产脂肪酶活性比较 分别对于脂肪酶产生菌Aspergillus niger G55和筛选得到的8个菌株的斜面种子进行连续传接5代,考察斜面孢子生长情况和产脂肪酶活性。由表8可知,对于筛选得到的菌株连续5次传代,所试验的9株菌传代斜面生长正常,表面产孢子丰富,经过多次诱变最终获得 uan370(s)和 uan783(s)菌株, 产脂肪酶活力分别为 (2435±62.7)U/mL和(2511±69.4)U/mL,CV 值分别为 2.6%和2.8%,说明该菌株传代稳定,具有良好的遗传稳定性和高产脂肪酶特性。
3 结论
综上所述,通过对脂肪酶产生菌Aspergillusniger G55分别采用UV和NTG单因子诱变和复合诱变,结合筛选最终获得稳定的高产脂肪酶菌株 uan783(s)和 uan370(s),产脂肪酶活力分别为2486 U/mL和2410 U/mL,相比原始出发菌种G55产脂肪酶活力提高32.1%和36.3%。同时,通过传代试验,证明获得的菌株具有高产酶活性和遗传稳定性。
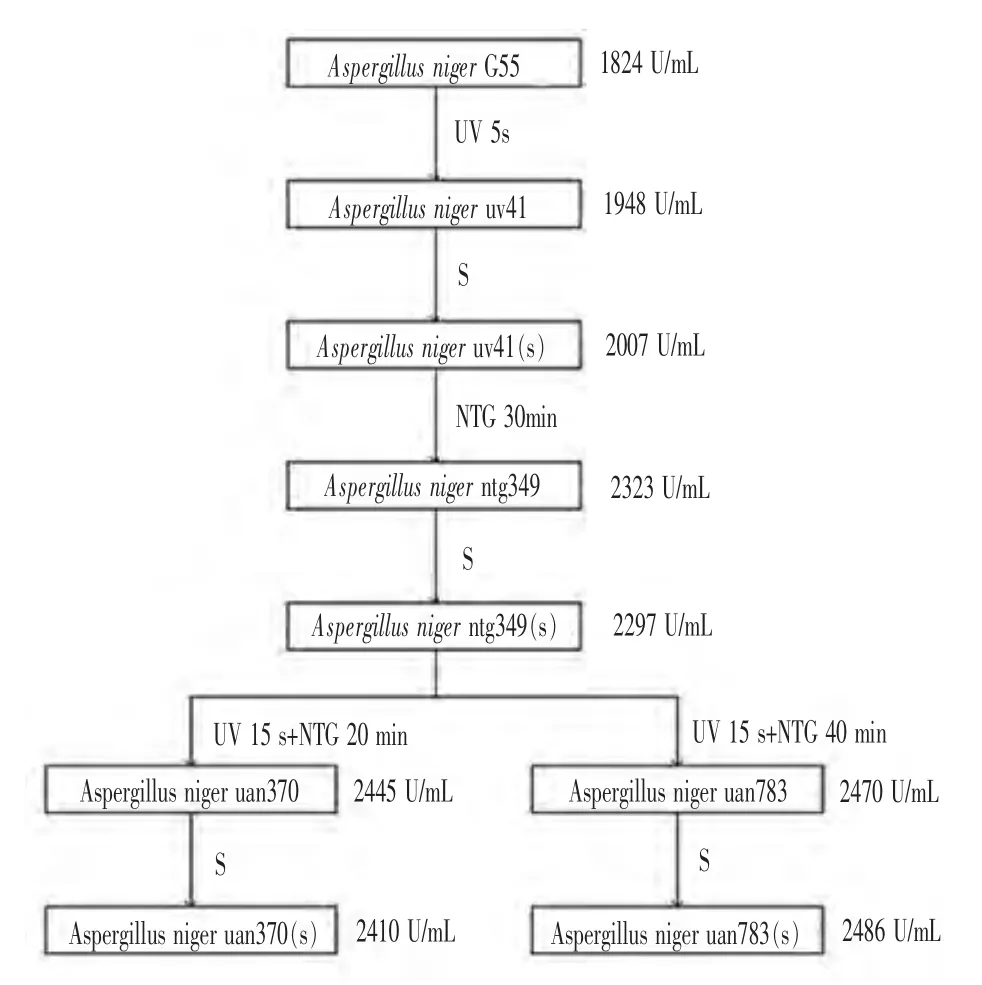
图3 Aspergillus niger G55菌株系谱

