钙/钙调素依赖性蛋白激酶Ⅱ抑制剂对心房肌细胞钙超载的影响
岑运光,陈相健
(1.海南省人民医院 医疗保健中心,海南 海口 570311;2.南京医科大学第二附属医院 心内科,江苏 南京 210029)
心房纤颤(atrial fibrillation,AF)是临床常见的持续性心律失常,随着年龄的增长其发病率逐渐增加[1]。心房电生理性重构目前被认为与增龄性房颤密切相关,其主要涉及到心房有效不应期缩短或频率适应性降低,心房肌结构适应性及非适应性改变等[2-3]。在介导房颤短期或长期的电重构及房颤发生的病理生理机制中,钙超载为首要因素,而钙/钙调蛋白依赖性蛋白激酶(calmodulin-dependent protein kinase II,CaMKII)的过表达是近年来被广泛关注的心房电重构中的信号转导途径[4-5]。本研究旨在通过观察钙/钙调素依赖性蛋白激酶Ⅱ抑制剂KN93对心房肌细胞中钙超载及CaMKII蛋白的影响,为房颤防治提供理论支持。
1 材料与方法
1.1 主要实验试剂与仪器 伊屋诺霉素(ionomycin)、KN93、FLUO-3/AM(S1056)钙离子荧光探针、Pluronic-F127凝胶均产自美国Sigma公司;D-hanks液产自美国Hyclone公司;新生牛血清产自德国PAA公司;DMEM培养基、考马斯亮蓝G250购自上海恒远生物科技有限公司;CaMKII抗体产自英国Abcam公司;FITC标记山羊抗小鼠IgG购自武汉博士德公司。主要仪器有激光共聚焦显微镜(Zeiss LSCM 510 META,德国),蛋白核酸分析仪(美国Bio-Rad公司)。
1.2 实验分组 采用差速贴壁分离技术分离纯化培养心房肌细胞96 h,筛选搏动性嫩良好的细胞随机分为5组,每组细胞数100,对照组和钙超载组细胞置入无血清培养基,KN93药物处理组细胞分别置入KN93终浓度为0.25、0.5、1.0μmo/L剂量的无血清培养基中。除对照组外,其它各组给予Fluo-3/AM(终浓度为4μmol/L)荧光指示剂负载,并加入钙离子导入剂ionomycin 1.0μmo/L孵育0.5 h。
1.3 Fluo-3/AM钙离子荧光负载 细胞给药24 h后,弃去原培养液,适量Pluronic-F127(终浓度为1 ul/mL)和Fluo-3/AM(终浓度为4μmol/L)加于负载心房肌细胞的盖玻片上,37℃,5%的CO2细胞培养箱避光孵育45 min。负载后的细胞以D-hanks液清洗3次,DMEM孵育0.5h(对照组)。
1.4 激光扫描共聚焦显微镜检测细胞内Ca2+激光共聚焦显微镜测定用Fluo-3/AM负载的细胞,激发波长488 nm,发射波长526 nm激光下光切扫描(物镜×40),扫描密度512×512,每张样本取15~20个视野,待实验结束后对图像进行数据化分析。每组检测100个细胞,3个视野动态监测15 min。
1.5 Western blot测定细胞内CaMKⅡ的表达 分离纯化后的心房肌细胞按每3×106个细胞加入2 uL PMSF和0.2mL RIPA,提取CaMKII蛋白,考马斯亮蓝法测定蛋白浓度。经SDSPAGE凝胶电泳、硝酸纤维素膜转印后、Tween 37℃封闭,加入CaMKII抗体(1∶1000),37℃反应过夜,经辣根酶标记的羊lgG(1∶2000)反应2 h(37℃),DAB显色,用Quantity one凝胶成像分析系统进行光密度扫描,结果以积分光密度值表示。实验重复3次。
1.6 评价指标 细胞内游离[Ca2+]i:以记录时间内(80 s)的细胞平均荧光强度代表细胞内游离钙浓度;收缩频率:记录时间内(80 s)的心肌细胞自发收缩次数;平均钙瞬变幅度:表示在心肌细胞收缩时细胞内游离Ca2+浓度的相对变化幅度;平均钙瞬变幅度=(峰值荧光强度-波谷荧光强度)/(收缩次数×对照组荧光强度);抑制率%=(钙超载组荧光值-KN93干预钙超载组荧光值)/钙超载组荧光值×100%
1.7 统计学方法 采用SPSS17.0进行统计分析,正态计量资料采用“±s”表示,采用单因素方差分析比较组间差异,采用LSD-t法进行两两检验。以P<0.05为差异有统计学意义。
2 结果
2.1 KN93对心房肌细胞内游离[Ca2+]i和钙瞬变的影响
通过实验方案,观察KN93对心肌细胞内游离[Ca2+]i的纠正作用。结果显示,ionomycin诱导的心肌细胞内的游离[Ca2+]i较对照组明显增强,提示心肌细胞钙超载模型构建成功;给予KN93后,心房肌细胞内游离[Ca2+]i受到明显抑制(见图1)。0.25μmol/L,0.5μmol/L,1.0μmol/L不同浓度的KN93对细胞内游离[Ca2+]i的抑制率分别为10.02%,22.55%,27.78%,提示KN93可抑制ionomycin诱导的心肌细胞钙超载。
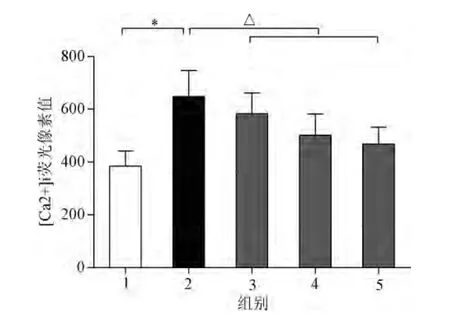
图1 不同组间心房肌细胞内游离Ca2+荧光像素值1.对照组;2.钙超载组3.KN93组(0.25μmol/L);4.KN93组(0.5μmol/L);5.KN93组(1.0μmol/L);*P<0.05,与对照组相比;ΔP<0.05,与钙超载相比Fig.1 Free Ca2+fluorescence pixels in atrial muscle cells within different groups1.Control group;2.calcium overload group;3.KN93group(0.25μmol/L);4.KN93group(0.5μmol/L);5.KN93group(1.0μmol/L)*P<0.05,compared with control group;ΔP<0.05,compared with calcium overload group
2.2 KN93对心房肌细胞钙瞬变和自发性收缩频率的影响
钙超载组心肌细胞钙瞬变较对照组明显增强,给予KN93后,心房肌细胞内钙瞬变受到抑制,且不同浓度的KN93对细胞内钙瞬变的抑制呈剂量反应关系(见图2)。但KN93对心肌细胞的自发性收缩频率影响的比较中,差异未见统计学意义(见图3)。
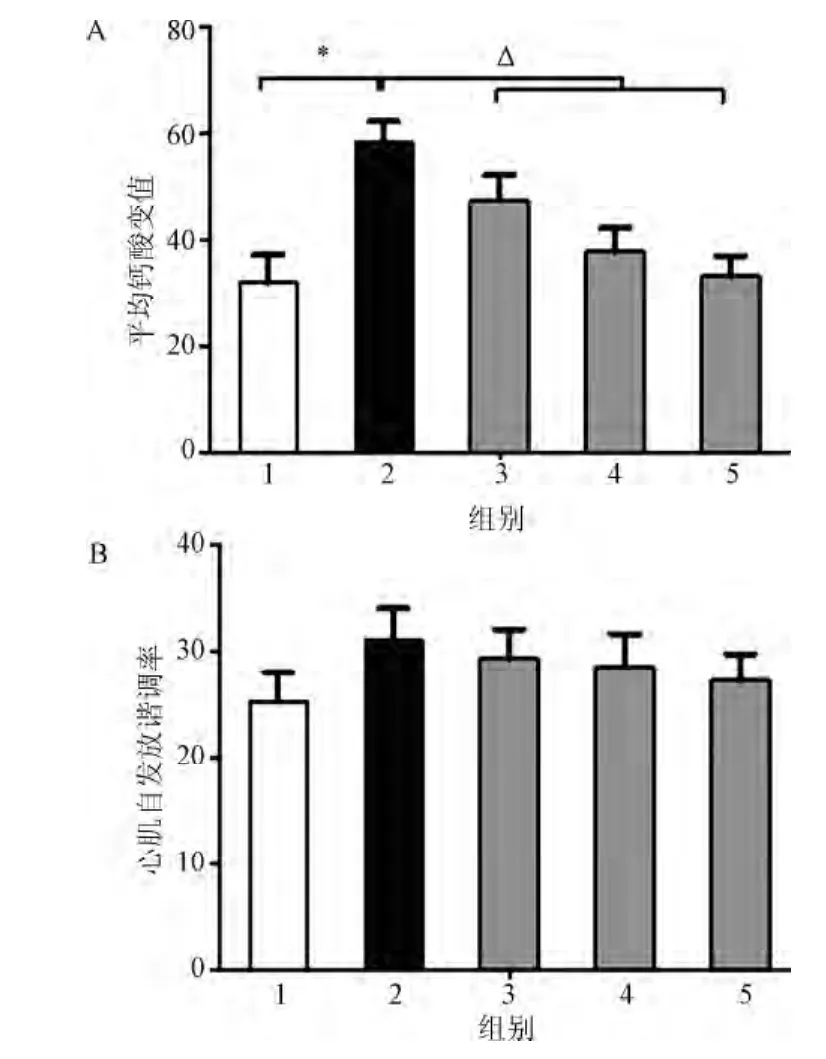
图2 不同组间心房肌细胞内平均钙瞬变值(a)和心房肌细胞自发性收缩频率(b)1.对照组;2.钙超载组;3.KN93组(0.25μmol/L);4.KN93组(0.5μmol/L);5.KN93组(1.0μmol/L);Fig.2 Average calcium transient value in atrial muscle cells within different groups1.Control group;2.calcium overload group;3.KN93 group(0.25μmol/L);4.KN93 group(0.5μmol/L);5.KN93 group(1.0μmol/L)
2.3 KN93对CaMKⅡ表达水平的影响 为了消除误差带来的影响,以β-actin蛋白浓度为内参,用Western blot检测不同实验组细胞CaMKⅡ的表达水平(见图3),不同实验组所测蛋白浓度与β-actin的蛋白浓度的比值为该组蛋白的标准值,结果显示:对照组、钙超载组,KN93(0.25、0.5、1.0 μmol/L)组CaMKⅡ/β-actin 分别为:0.52,1.49、0.41、0.58、0.45。钙超载组心房肌细胞内CaMKⅡ表达较对照组明显升高,KN93处理后,心房肌细胞CaMKⅡ表达下降,且随KN93浓度的增加CaMKⅡ表达呈下降趋势,KN93 1.0μmol/L组CaMKⅡ水平降至对照组水平(见表1)。

图3 Western blotting检测心房肌细胞中CaMKⅡ蛋白1.对照组;2.钙超载组;3.KN93组(0.25μmol/L);4.KN93组(0.5μmol/L);5.KN93组(1.0μmol/L)Fig.3 Western bloting analysis of CaMKⅡprotein in atrial myocardium1.Control group;2.calcium overload group;3.KN93 group(0.25μmol/L);4.KN93 group(0.5μmol/L)

表1 不同组间心房肌细胞内CaMKII比较Tabl.1 Comparison of CaMKII in atrial muscle cells within different groups
3 讨论
房颤发生时心房肌细胞膜L型钙离子通道电流密度下调是导致心房肌细胞动作电位时程、有效不应期缩短以及传导速度减慢等电生理学特性改变的分子基础[6-7]。而心房肌细胞内游离[Ca2+]的平衡即取决于细胞膜上L型钙离子通道的调节作用。Ca2+的细胞学功能主要通过钙调素(calmodulin,CaM)信号转导通路和其重要的下游信号分子功能来决定[8]。研究显示,房颤的持续时间与CaM蛋白含量呈正相关,提示房颤时的钙调控异常是导致房颤发生和维持的重要机制。钙/钙调素依赖性蛋白激酶(Calcium/calmodulin dependent protein kinase,CaMK)是一种广泛存在于机体组织中的多功能蛋白激酶,其中亚型II,即CaMKII在心肌细胞中最为丰富,参与细胞内钙离子的水平调节,对心脏肌细胞的机械收缩,电活动及基因转录等均发挥着潜在的调节作用[9]。即往研究结果表明,在房颤动物模型及房颤患者中均发现心房肌细胞内存在钙代谢紊乱现象[10],而CaMKII活性的增高可以导致心肌收缩力下降及细胞内钙离子增加。由此,有学者推测心房肌细胞CaMKII的活化可能与心房纤颤的发生密切相关。新近研究结果证实了这一点,从慢性房颤患者分离的心肌细胞中发现存在钙超载,而Ca2+/CaMKII信号转导途径被认为是其重要的病理生理基础[11-12],而CaMKII抑制剂被发现可抑制由电场刺激诱导的心脏成纤维细胞的增殖[13],因此推测CaMKII抑制剂可能对心房肌纤维化的发生起阻滞作用。
本研究以心肌细胞内游离的Ca2+和平均钙瞬变幅度作为主要的评价指标,探讨 CaMKII抑制剂KN93对心肌细胞Ca2+超载的影响。结果显示,KN93可下调心肌细胞内游离[Ca2+]i,且不同浓度的KN93对钙负荷的抑制程度有剂量依赖性,说明KN93在一定程度上可抑制心房肌细胞钙超载。KN93是一种高效的CaMKII特异性抑制剂,它通过与CaM结合位点的相互作用[14],使CaM与CaMKⅡ的结合受到阻滞,抑制了CaMKⅡ的自身磷酸化活性。因此推测KN93对心房肌细胞钙超载的抑制作用主要是通过降低CaMKⅡ的自身磷酸化活性而实现的。
另外,除钙离子通道异常与房颤有关外,肌浆网对钙离子的释放异常也是房颤发生的原因[15],而CaMKⅡ的系统性抑制则是其靶向的另一选择途径。因此,CaMKⅡ抑制剂是否通过下调肌浆网内钙离子释放则需进一步研究。
综上所述,CaMKⅡ抑制剂可在一定程度上抑制心房肌细胞钙超载,其是否还存在其它的干预机制尚需进一步研究,但可以明确的是,通过CaMKⅡ抑制剂的开发,可能会提供心房纤颤这一病理生理过程的靶向治疗机会,从而进行有效的抗心律失常药物开发。
[1]周自强,胡大一,陈捷.“中国心房颤动流行病学研究”结果解读[J].中华内科杂志,2010,49(3):198-199.
[2]李耀东,汤宝鹏.钙离子通道与老龄心房颤动心房电重构的研究进展[J]. 心血管病学进展,2011,32(5):718-720.
[3]赵晟,杨水祥.心脏电重构的影响及意义进展[J].中华临床医师杂志,2013,7(19),8874-8877.
[4]逯星竹,毕学苑,于晓江,等.钙/钙调蛋白依赖性蛋白激酶Ⅱ与心血管疾病的研究进展[J].生理科学进展,2014,45(1):32-36.
[5]秦瑶.CaMKⅡδ对心房肌细胞钙离子流影响的研究[D].第三军医大学,2011,5.
[6]Kato T,Iwasaki Y,Giordanetto F,etal.Does T-type Calcium Channel Blockade Protect against Atrial Fibrillation Related Remodeling?[C]//CIRCULATION.530 WALNUT ST,PHILADELPHIA,PA 19106-3621 USA:LIPPINCOTT WILLIAMS& WILKINS,2012,126(21).
[7]Chen WJ,Yeh YH,Lin KH,etal.Molecular characterization of thyroid hormone-inhibited atrial L-type calcium channel expression:implication for atrial fibrillation in hyperthyroidism[J].Basic research in cardiology,2011,106(2):163-174.
[8]Nattel S,Dobrev D.The multidimensional role of calcium in atrial fibrillation pathophysiology:mechanistic insights and therapeutic opportunities[J].European heart journal,2012,33(15):1870-1877.
[9]van Oort RJ,McCauley MD,Dixit SS,etal.Ryanodine receptor phosphorylation by calcium/calmodulin-dependent protein kinase II promotes life-threatening ventricular arrhythmias in mice with heart failure[J].Circulation,2010,122(25):2669-2679.
[10]Yamashita T,Inoue H,Okumura K,etal.Randomized trial of angiotensin II-receptor blocker vs.dihydropiridine calcium channel blocker in the treatment of paroxysmal atrial fibrillation with hypertension(J-RHYTHM II study)[J].Europace,2010,13(4):473-479.
[11]Neef S,Dybkova N,Sossalla S,etal.CaMKII-dependent diastolic SR Ca2+leak and elevated diastolic Ca2+levels in right atrial myocardium of patients with atrial fibrillation[J].Circulation research,2010,106(6):1134-1144.
[12]Heijman J,Voigt N,Wehrens XHT,etal.Calcium dysregulation in atrial fibrillation:the role of CaMKII[J].Frontiers in pharmacology,2014,4(5):30.
[13]钟拥军,陈东芹,姚小燕.CaMKⅡ抑制剂抑制AngⅡ或电场刺激诱导的心肌成纤维细胞TNF-α,TGF-βcollagenⅠ,Ⅲ的表达[J].中国病理生理杂志,2010,26(8):1549-1554.
[14]于倩,葛志强.钙调神经磷酸酶抑制剂的研究进展[J].中国生化药物杂志,2007,28(3):210-212.
[15]梁峰,胡大一,沈珠军.心房颤动抗心律失常药物研发的前景方向[J].中华临床医师杂志(电子版),2013,7(14):6596-6599.

