大蒜素与奥沙利铂对大肠癌细胞HCT-8生长的影响
黄鉴,珠珠,陈昌望,李少,洪敏,董坚Δ
(1.昆明医科大学第一附属医院 肿瘤科,云南 昆明 650032;2.恩施州中心医院胃肠外科 湖北恩施 445000)
随着人们生活环境的恶化及饮食习惯的改变,我国大肠癌的发病率逐年升高。大肠癌的发生与遗传因素、饮食因素及相关疾病等关系密切[1]。目前治疗大肠癌方法主要是手术为主的综合治疗[2],大部分大肠癌患者在临床诊断时已属Ⅳ期,单纯手术治疗往往易复发和转移,因此化疗对治疗大肠癌有重要意义[3]。奥沙利铂是目前治疗大肠癌的第三代铂类衍生物,其具有抑制肿瘤细胞增殖及促进细胞凋亡的作用,但是有严重的神经毒性,临床上应尽量减少奥沙利铂的给药量[4]。大蒜素又名大蒜新素,具有多种生物活性,最近几年发现大蒜素还具抗肿瘤作用[5],且其是从食物大蒜球茎中分离出的天然化合物,其毒性远远小于合成化疗药物[6]。本实验旨在研究大蒜素与奥沙利铂联合应用治疗大肠癌的可行性及其作用机制。
1 材料与方法
1.1 材料与试剂 人结肠癌HCT-8细胞(中国科学院上海细胞库);大蒜素标准品(上海基免实业有限公司生产);奥沙利铂标准品(上海谷研科技有限公司);DMSO二甲基亚砜(AR)购于国药集团化学试剂有限公司,四甲基偶氮唑盐(MTT)、胰蛋白酶(碧云天生物技术研究所),胚胎/小牛血清、DMEM培养基(Gibico公司);苏木素染液、小鼠抗人Caspase-3单克隆抗体、SP染色试剂盒、DAB检测试剂盒(上海研生实业有限公司生产);凯基AnnexinV-FITC细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司);SPEETRA MAX190酶联免疫检测仪(美国Molecular Devices);Gallios流式细胞仪(美国贝克曼)
1.2 实验方法
1.2.1 大蒜素和奥沙利铂联合对HCT-8细胞增殖的影响:参照MTT法,取处于对数生长期状态良好的肿瘤细胞HCT-8,用0.25%胰蛋白酶(含0.02%EDTA)消化后,1 500 r/min离心5 min,将细胞重悬于完全培养基中,计数,调整其浓度为2×104个/mL,以100μL每孔接种于96孔细胞培养板中,放置于相对湿度90%,37℃,5%CO2培养箱内培养,24 h后将细胞分成4组。大蒜素组加入终浓度为9μg/mL的大蒜素,奥沙利铂组加入终浓度为5μg/mL的奥沙利铂,联用组同时加入终浓度为9μg/mL的大蒜素和5μg/mL的奥沙利铂(终浓度依据预试验中大蒜素和奥沙利铂对HCT-8细胞72h的1/2 IC50浓度设置),阴性对照组加入终浓度为0.5%的DMSO,各组均设3个复孔。加入药物72 h后吸去培养液,每孔加入5mg/mL的MTT试剂20μL,37℃继续培养4 h后吸弃上清,每孔加入DMSO 100μL,振荡至结晶物充分溶解,置于全自动酶标仪上,测定各孔在波长570 nm处的吸光度值(A),取复孔吸光度平均值进行比较。细胞增殖抑制率:抑制率(%)=(1-实验组吸光度/对照组吸光度)×100%。以金正均法考察2药合用的协同作用,其公式为q=E(a+b)/(Ea+Eb-Ea×Eb)。若0.85<q<1.15为2药合用单纯相加,若q>1.15为有协同作用,若q<0.85表示2药合用有拮抗作用[3]。
1.2.2 流式细胞仪检测细胞周期及细胞凋亡:用无血清培养基培养HCT-8细胞24 h,细胞生长同步化后常规培养。瓶底70%面积长满细胞时进行分组,分组及处理同1.2.1,每组平行做5份,作用72 h后终止,0.25%胰酶消化,1 500 r/min离心5 min,PBS重悬2次,调整细胞浓度为1.5×106个/mL,取各组各管细胞悬液2mL用于细胞周期检测。另取各组各管细胞悬液100μL于5mL流式管中,用于细胞凋亡检测,加人5μL Annexin-V/PE,加入400μL结合缓冲液,轻轻混匀,室温避光孵育15 min,800 r/min离心5 min沉淀细胞,用孵育缓冲液洗1次。重悬后及时上流式细胞仪检测凋亡细胞。取上述预留各组各管细胞悬液1.5mL置于流式管中,加入预冷的70%冰乙醇3mL,置于4℃冰箱过夜后1 000 r/min离心5 min,除去上层乙醇,PBS洗3次,细胞浓度稀释为1×106个/mL。取100μL细胞悬液,加入RNase使终浓度为100 ug/mL,于37℃消化0.5 h,加人PI使终浓度为50 ug/mL,于4℃染色1 h。300目尼龙网过滤细胞悬液,用流式细胞仪检测细胞周期[4]。实验重复3次。
1.2.3 免疫组化法检测caspase-3的表达:取处于对数生长期、状态良好的肿瘤细胞HCT-8,加入0.25%胰蛋白酶(含0.02%EDTA)消化后,1 500 r/min离心5 min,将细胞重悬于完全培养基中,计数,调整其浓度为2×104个/mL,以1mL/孔接种于24孔细胞培养板中,放置于相对湿度90%、37℃、5%CO2培养箱内培养,24 h后当细胞长满瓶底70%时按“1.2.1”下分组并加入药物。作用72 h后终止,弃除培养液,PBS冲洗2次,每孔加4%多聚甲醛2mL,固定0.5 h。吸去甲醛,PBS漂洗3次,每次5 min。剩余步骤严格按照DAB试剂盒说明书操作,苏木素复染色后于显微镜下观察异常分裂细胞,约10 s细胞核变蓝后自来水冲洗终止复染,实验重复3次。结果判定:caspase-3阳性细胞胞浆/胞核出现棕黄色颗粒,以胞浆为主。异常分裂细胞主要指有丝分裂期两个子代细胞的细胞核形态明显不对称或细胞核数目>2个。在高倍镜视野(×400)下。随机选择10个视野,每个视野计算100个细胞,然后计算阳性细胞百分率,对3次染色后的细胞阳性率计算均值。在高倍镜视野(×400)下,随机选择500个细胞视野,计算视野中异常细胞数n,以n/500×100%表示异常分裂细胞占分裂期细胞的百分比,试验重复3次,计算均值[5]。
1.3 统计学方法 应用SPSS l5.0软件分析,正态计量资料采用“±s”表示,组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 大蒜素和奥沙利铂单用及联合作用对HCT-8细胞增殖的影响 与单药组比较,联用组的细胞生长抑制率明显增加,差异具有统计学意义(P<0.01)。依据金正均公式计算,q=1.34,说明2药联用具有协同作用(见图1)。
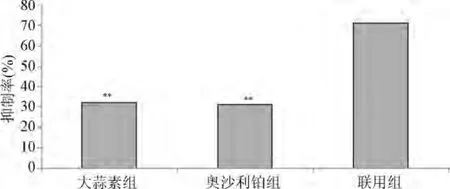
图1 大蒜素和奥沙利铂作用72 h后对HCT-8细胞增殖的影响**P<0.01,与联用组比较Fig.1 Effect of allicin and oxaliplatin on HCT-8 cell proliferation**P<0.01,compared with the combination group
2.2 大蒜素和奥沙利铂单独及联合作用72 h后对细胞周期的影响 大蒜素和奥沙利铂单独及联合作用72 h后,奥沙利铂组各周期百分比与对照组比较无明显变化。与对照组比较,大蒜素组和联合用药组的G0/Gl期细胞均明显减少,G2/M期细胞均明显增加(P<0.01),而S期细胞无明显变化(见图2、图3)。

图2 各处理组处理72 h后对HCT-8细胞周期的影响A:4组总细胞;B:以PE-A(相对荧光强度)/PE-W(PE通道的宽度)为横纵坐标,P1门里的细胞为分析对象;C:对照组;D:大蒜素组;E:奥沙利铂组;F:联用组Fig.2 Effect of four treatment groups on HCT-8 cell cyclesA:the total cells in four groups;B:PE-A(relative fluorescence intensity)/PE-W(PE channel width)for the horizontal and vertical coordinates,select the P1 inside cells as the analysis object;C:control group;D:allicin group;E:oxaliplatin group;F:the group of combination

图3 大蒜素和奥沙利铂单独及联合作用72 h后对细胞周期的影响**P<0.01,与奥沙利铂组比较;ΔΔP<0.01,与大蒜素组比较;##P<0.01,与对照组比较Fig.3 Effect of allicin and oxaliplatin on cell cycles**P<0.01,comparied with oxaliplatin group;ΔΔP<0.01,compared with allicin group;##P<0.01,compared with control group
2.3 大蒜素和奥沙利铂单独及联合作用24 h后对细胞凋亡及caspase-3表达的影响 流式结果显示:大蒜素组、奥沙利铂组及联合用药组的凋亡率均明显大于对照组(P<0.01);与单独组比较,联合用药组细胞凋亡率明显增高(P<0.01)。免疫细胞化学SP法结果显示:大蒜素组、奥沙利铂组及联合用药组的caspase-3的阳性表达率明显高于对照组(P<0.01);与奥沙利铂组比较,大蒜素组的caspase-3阳性表达率差异无统计学差异(P<0.01),联用组的caspase-3阳性表达率显著高于奥沙利铂组及大蒜素组,差异有统计学意义(P<0.01,见图4、图5)。
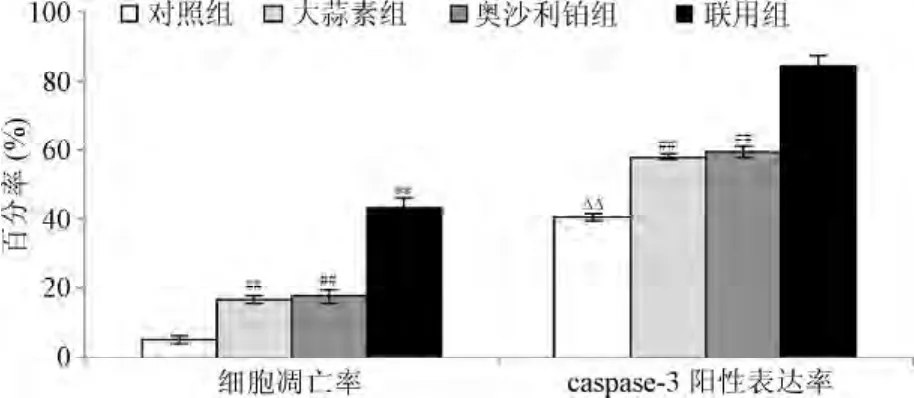
图5 大蒜素和奥沙利铂单独及联合作用24 h后对HCT-8细胞凋亡及caspase-3表达的影响**P<0.01,与奥沙利铂组比较;ΔΔP<0.01,与大蒜素组比较;##P<0.01,与对照组比较Fig.5 Effect of allicin and oxaliplatin on cell apoptosis caspase 3 expression after treatment with 24 h**P<0.01,comparied with oxaliplatin group;ΔΔP<0.01,compared with allicin group;##P<0.01,compared with control group
3 讨论
奥沙利铂具有阻断DNA双链复制和转录,诱导细胞凋亡的药理作用,目前是大肠癌术后辅助化疗的第三代铂类衍生物,比前两代铂类衍生物具有更强的抗肿瘤作用[7-8]。但是奥沙利铂的神经毒性很强,且发生率高,因此临床上应尽量减少奥沙利铂的给药剂量[9]。
大蒜素(allicin)又名大蒜新素,为无色油状物,具有强烈蒜臭味,化学名二烯丙基三硫化物,结构式为CH2=CH-CH2-S-S-SCH2-CH=CH2[10]。大蒜素具有多种生物活性,如抗细菌、抗真菌、降血压、降血醋、防治动脉粥样硬化等。近年来发现大蒜素具有抑制肿瘤细胞增殖、阻滞细胞周期、诱导凋亡及调节化疗敏感性等抗肿瘤作用[11]。研究发现,常食蒜类可降低肠道肿瘤的发生率,国内外亦有报道大蒜素联合顺铂或紫杉醇作用于前列腺癌、宫颈癌、食管癌及胃癌等细胞,且疗效显著[12]。因此本文考虑将大蒜素与奥沙利铂联合作用于大肠癌,一方面减少奥沙利铂的给药剂量及临床毒性,另一方面提高奥沙利铂的抗肿瘤疗效,减少对大肠癌的耐药性。
本文考察了大蒜素与奥沙利铂联合应用对大肠癌细胞增殖和凋亡的影响。Gunjan Tyagi等[13]报道大蒜素作用于肺癌A549细胞72 h后的IC50值约为30 ug/mL,本文预实验中大蒜素对HCT-8细胞的IC50值约为18 ug/mL,说明大蒜素对HCT-8细胞的抑制增殖敏感性强于A549细胞。本文研究发现,单用终浓度为9μg/mL的大蒜素和5μg/mL的奥沙利铂作用于HCT-8细胞72 h后的生长抑制率分别为(32.13±1.87)%和(31.11±2.73)%,联用组作用于HCT-8细胞72 h后生长抑制率为(71.18±3.68)%,通过金正均公式计算,说明2者具有协同作用。关于2者协同抑制HCT-8细胞增殖的作用机制尚需进一步研究。
关于大蒜素影响细胞周期的研究已有多篇文献报道[14-15]。本文研究发现,各给药组处理后,奥沙利铂组各周期百分比与对照组比较无明显变化。与对照组比较,大蒜素组和联合用药组的G0/Gl期细胞均明显减少,G2/M期细胞均明显增加(P<0.01),而S期细胞无明显变化。因此大蒜素能将HCT-8细胞周期阻滞于G2/M期,而奥沙利铂对细胞周期没有影响。Gunjan Tyagi等[16]研究结果显示:大蒜素能与DNA、tRNA上碱基结合从而破坏DNA的合成和tRNA的表达,而G2/M期调控点是细胞周期的监控机制,能防止受损的DNA和未完成复制的DNA进入有丝分裂。因此,HCT2-8细胞周期阻滞于G2/M期的作用机制可能与细胞核内DNA和tRNA上碱基结合有关[17-18]。奥沙利铂也能与DNA形成复合物,阻断DNA双链的复制和转录,进而诱导细胞凋亡[19]。大蒜素与奥沙利铂协同抑制HCT-8细胞增殖的作用机制可能与共同作用于DNA的复制和转录有关。
本文还对大蒜素与奥沙利铂联用对HCT-8细胞凋亡进行了分析,结果显示:与单独组比较,联合用药组细胞凋亡率明显增高(P<0.01)。caspase-3表达情况结果显示:大蒜素组、奥沙利铂组及联合用药组的caspase-3的阳性表达率明显高于对照组(P<0.01);与奥沙利铂组比较,大蒜素组的caspase-3阳性表达率差异无统计学意义(P<0.01),联用组的caspase-3阳性表达率显著高于奥沙利铂组及大蒜素组,差异均有统计学意义(P<0.01)。因此,大蒜素与奥沙利铂联用促进HCT-8细胞凋亡可能与诱导caspase-3阳性表达有关。
[1]Wouter W,Marc M,Dirk VD,etal.Lymphatic spread,nodal count and the extent of lymphadenectomy in cancer of the colon[J].Cancer Treatment Reviews,2014,40(3):405-413.
[2]张敏,奚杰,孙大伟,等.大蒜素对宫颈癌细胞生长的影响及作用机制[J].中国实用妇科与产科杂志,2011,27(1):39-41.
[3]李鹏辉.大蒜素对人肝癌HepG2细胞增殖抑制作用的研究[J].中国现代医生,2010,48(16):7-9.
[4]陈兰英,宋巍,杨海波,等.大蒜素对人食管癌 EC9706细胞凋亡的诱导作用[J].癌变畸变突变,2013,25(3):201-203.
[5]张小虎,唐超雄,陈小华,等.大蒜素诱导骨肉瘤细胞凋亡的作用及其机制的实 验研究[J].肿瘤药学,2012,2(3):180-183.
[6]Abdul Majid,Safdar Ali,Mubashar Iqbal,etal.Prediction of human breast and colon cancers from imbalanced data using nearest neighbor and support vector machines[J].Computer Methods and Programs in Biomedicine,2014,113(3):792-808.
[7]余文燕,孙珏,许建华,等.肠胃清药物血清协同奥沙利铂对人结肠癌耐药细胞增殖及凋亡的影响[J].中国实验方剂学杂志,2013,19(10):182-186.
[8]秦琼,杨林,王金万,等.Ⅱ期结肠癌根治术后奥沙利铂 联合氟尿嘧啶类药物辅助化疗疗效和获益人群分析.中国肿瘤临床,2013,40(5):275-279.
[9]宋亚芳,杨红,聂珍贵,等.大蒜素在Caco-2细胞模型转运特征的研究[J].现代医药卫生,2014,30(1):6-7.
[10]蒋淑婉,李云,陈鹤.大蒜素的抗肿瘤作用及其机制研究进展[J].医学综 述,2013,19(8):1420-1422.
[11]杜亚明,郑伟,王中彬,等.大蒜素对人肺癌 H460细胞增殖及凋亡的影响[J].山东医药,2011,51(8):1-2.
[12]王若天,邝健辉.大蒜素联合替加氟对人HepG2肝癌细胞增殖的影响[J].中国 生化药物杂志,2012,33(4):453-454.
[13]Bat-Chen W,Golan T,Peri I,etal.Allicin purified from fresh garlic cloves induces apoptosis in colon cancer cells via Nrf2[J].Nutr Cancer,2010,62(7):947-957.
[14]Amri R,Bordeianou LG,Sylla P,etal.Treatment delay in surgicallytreated colon cancer:does it affect outcomes?[J].Ann Surg Oncol,2014.DOI 10.1245/s10434-014-3800-9.
[15]Birgisson H.To improve prognosis and treatment of patients with colon and rectal cancer[editorial].Laeknabladid,2014,100(2):73-76.
[16]van Erning FN,Bernards N,Creemers GJ,etal.Administration of adjuvant oxaliplatin to patients with stage III colon cancer is affected by age and hospital[J].Acta Oncol,2014,53(3):975-980.
[17]屠世良,袁航,何徐军,等.BH3-only在奥沙利铂诱导结肠癌细胞凋亡中的作用.中华胃肠外科杂志,2013,16(6):538-542.
[18]周喜汉,黄赞松,向发良.中药抗结直肠癌作用的研究进展[J].世界华人消化杂志,2013,21(18):1720.
[19]Gao Y,Liu YQ,Cao WK,etal.Effects of allicin on invasion and metastasis of colon cancer LoVo cell line in vitro[J].Zhonghua Yi Xue Za Zhi,2009,89(20):1382-1386.

