白细胞介素-8-251T/A基因多态性和肺癌易感性的Meta分析
真德智 王晓彬 李云松 李 杰 韩 毅 刘志东*
(1.首都医科大学附属北京胸科医院/北京市结核病胸部肿瘤研究所胸外科,北京101149;2.内蒙古林业总医院胸心血管外科,内蒙古牙克石022150;3.首都医科大学附属北京胸科医院/北京市结核病胸部肿瘤研究所肿瘤科,北京101149)
虽然近些年肺癌诊断和治疗技术不断发展,但是肺癌仍是目前全球最致命的癌症之一[1]。在世界很多国家和地区肺癌的发病率已经达到高峰而且成为主要的公共卫生问题,这一问题在中国也尤为突出[2]。肺癌的发病机制至今仍不完全清楚,而除了吸烟之外,宿主因素包括遗传多态性已成为导致肺癌的最重要单一因素,而且越来越多的肺癌发生机制相关研究开始关注这一因素[3]。
作为趋化因子家族的一员白细胞介素-8(interleukin-8,IL-8)是中性粒细胞和淋巴细胞的化学诱导剂[4-5]。单核细胞、中性粒细胞、成纤维细胞和内皮细胞等多种正常细胞均可分泌IL-8[6]。IL-8的首要作用是白细胞趋化活性,主要参与急性炎性反应的启动和放大[7]。另外,多种肿瘤细胞也可分泌 IL-8[8],并参与血管生成和新生血管依赖的肿瘤生长[9-10]。在多种类型肿瘤的侵袭和转移中都能检测出IL-8过表达[11-13]。IL-8-251T/A(rs4073)的基因多态性分为主要的T/T纯合子基因型、T/A杂合子基因型和罕见的A/A纯合子基因型。
目前已有许多关于IL-8-251T/A(rs4073)基因多态性与肺癌发生风险相关性的研究,但是结果并不一致。单中心研究,尤其是样本量特别小的研究,无法检测出基因多态性在肺癌中微小的影响。而基因多态性在不同人群中也会有不同作用。因此,本研究对符合纳入标准的研究进行Meta分析,以期得到更准确的IL-8-251T/A(rs4073)基因多态性与肺癌发生风险的相关性。
1 材料和方法
1.1 文献检索与筛选
在 PubMed 中 应 用“IL-8”、“interleukin-8”、“-251T/A”、“rs4073”、“polymorphism”和“lung cancer”词语检索2013年12月1日之前、全部语种和研究对象为人类的文献。同时,对综述中相关的参考文献进行手工检索。只筛选可得到全文的文献,排除综述、信件、评述和病理报告。对于相同数据的文献,只纳入近期或有完整数据的文献进行Meta分析。
文献纳入标准:①评估了IL-8-251T/A基因多态性和肺癌发生风险的文献;② 研究设计为病例对照研究;③提供了肺癌组和对照组的IL-8-251T/A各基因亚型例数。
1.2 数据提取
2名作者分别从符合上述纳入标准的文献中提取数据。如果出现分歧,由2位作者讨论解决。
从每篇文献中提取如下数据:第一作者姓氏、发表年份、种族、肺癌组例数、对照组例数、肺癌组基因亚型(T/T、T/A和A/A)例数和对照组基因亚型(T/T、T/A和A/A)例数。如果上述项目任何一项没有在文献中报道,那么这篇文章不被纳入。其中种族按亚裔和非亚裔分类。对于病例数过少的研究不被纳入本研究Meta分析。
1.3 统计学方法
所有的统计应用STATA11.0(Stata Corporation,College Station,TX)软件进行分析。用比值比(odds ratios,OR)及95%置信区间(confidence intervals,CI)来计算IL-8-251T/A基因多态性和肺癌发生风险的相关性。A/A纯合子基因型和携带A等位基因的(T/A+A/A)杂合子基因型与T/T纯合子基因型的OR值进行合并计算。根据种族进行亚组分析。用基于卡方的Q检验对异质性进行评估[14]。当Q检验P>0.1时表明研究间没有异质性,采用固定效应模型(Mantel-Haenszel method)对OR进行合并计算[15],否则用随机效应模型(DerSimonian and Laird method)[16]。用单向敏感性分析来评估结果的稳定性,即每次从Meta结果中剔除一项研究,以反映该项被剔除研究对结果的影响[17]。对于潜在的发表偏倚采用log(OR)的标准误和log(OR)为横纵坐标的漏斗图进行评估。不对称的点表示可能存在的发表偏倚。漏斗图的不对称性用OR的自然对数作为坐标的线性回归方法进行评估即Egger’s线性回归检验。其截距的意义用t检验反映Egger结果(P<0.05被认为有显著的发表偏倚)[18]。
2 结果
2.1 文献检索结果
本篇Meta分析,根据纳入标准共纳入6篇文献,其中肺癌组3 265例和对照组3 607例[19-24],主要特征见表1。所纳入的6篇均为英文文献,标本量从231~4 260例不等,所有病例均有病理证实,其中对照组主要是健康人群。6篇文献中2篇为针对亚裔人群的研究,另外4篇为非亚裔人群。
2.2 Meta 分析结果
Meta分析的主要结果见表2。合并计算所有纳入研究A/A纯合子和携带A等位基因的(T/A+A/A)杂合子与野生型纯合子(T/T)的OR值,肺癌组3 265例OR=1.03(95%CI:0.92~1.14,异质性 P=0.235),对照组3 607例 OR=1.07(95%CI:0.96~1.19,异质性P=0.245,图1)。对数据按种族进行亚组分析,发现在亚裔人群中携带A等位基因(T/A+A/A)杂合子(OR=1.48,95%CI:1.04 ~2.11,异质性P=0.030)和 A/A纯合子(OR=1.35,95%CI:
1.02~1.92,异质性P=0.090)与T/T纯合子有着显著的肺癌发生风险相关性。而在非亚裔人群中,无论是A/A纯合子和T/T野生型纯合子(OR=1.12,95%CI:0.72~1.25,异质性P=0.284)还是携带A等位基因(T/A+A/A)杂合子和野生型T/T纯合子(OR=1.03,95%CI:0.92 ~1.15,异质性 P=0.602)都没有发现显著的肺癌发生风险相关性。

表1 纳入Meta分析的IL-8-251T/A基因多态性与肺癌发生风险相关性研究主要特点Tab.1 Main characteristics of studies investigated the association between IL-8-251 T/A polymorphisms and lung cancer risk in the Meta-analysis
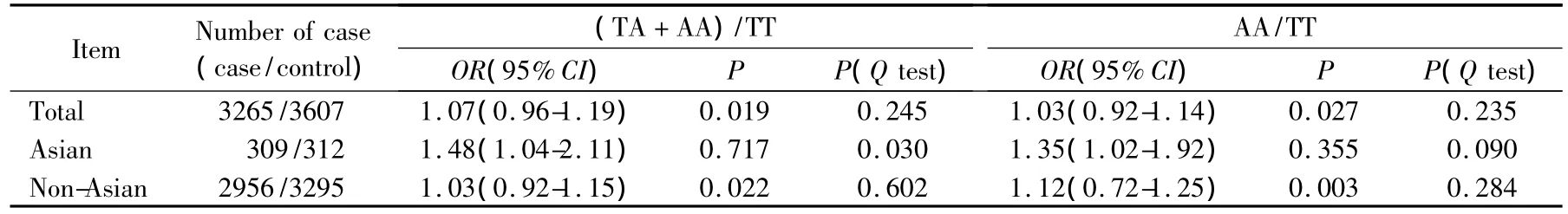
表2 Meta 分析中合并的比值比(OR)和95%置信区间(CI)Tab.2 Main results of pooled odds ratios(OR)with confidence interval(CI)in the meta-analysis

图1 IL-8-251 T/A基因多态性(TA+AA)和TT与肺癌发生风险相关性的森林图Fig.1 Forest plot(fixed-effects model)of lung cancer risk associated with IL-8-251 T/A polymorphism for(TA+AA)versus TT
2.3 敏感性分析
每次剔除Meta分析中的一项研究重新合并计算OR值,来观察剔除该单个研究后的OR值是否有改变,结果证实没有某一研究被剔除后导致合并后OR值发生明显变化。
2.4 发表偏倚
用Begg’s漏斗图和Egger’s检验来评估文献的发表偏倚。经Egger’s检验评估发表偏倚,未发现明显的发表偏倚(P=0.283)。此外,发表偏倚的漏斗图也没显示不对称性(图2)。上述检验结果未发现潜在的发表偏倚。

图2 IL-8-251 T/A基因多态性(TA+AA)和TT与肺癌发生风险相关性的Begg’s漏斗图Fig.2 Begg’s funnel plot of IL-8-251 T/A polymorphism and lung cancer risk for(TA+AA)versus TT
3 讨论
IL-8基因位于4号染色体q13-21,包括4个外显子、3个内含子和邻近的启动子区。这个基因的编码序列表现出多种功能上的基因多态性,已知的特征有15个。研究[25]发现,在同样的致癌因素暴露中一些个体对某类肿瘤存在易感性。宿主因素即参与致瘤作用的基因多态性,导致这种易感性的差异。因此,癌症的基因易感性已成为目前研究的热点。最近,IL-8基因多态性与多种肿瘤的发生相关性被越来越多的关注。近期,有2篇关于IL-8-251A>T基因多态性的Meta分析[26-27]发现IL-8-251T/A基因多态性与胃癌、乳腺癌和鼻咽癌发病风险增加有显著相关性。本研究Meta分析总结了IL-8-251T/A基因多态性与肺癌发生风险相关性的数据,包括肺癌组3 265例和对照组3 607例。本研究结果显示在全部人群中IL-8-251T/A基因多态性和肺癌发生风险没有相关性,但是在亚裔人群中IL-8-251T/A基因多态性与肺癌发生风险相关性显著增加。
当按种族进行亚组分析[28]时,发现在亚裔人群中携带A等位基因(T/A+A/A)杂合子和A/A纯合子个体比野生型T/T纯合子个体表现出更高的肺癌发生风险。而在非亚裔人群中,无论何种基因型均未发现与肺癌发生风险具有相关性。这一发现表明IL-8-251T/A基因多态性在某个特定种族中是肺癌发生的重要影响因素,A等位基因对于肺癌发生风险的影响因种族而有所不同。种族不同反映的是遗传背景及环境因素的不同,对于全部人群可能出现疾病与标志物相关性的假阳性或假阴性结果,因此按人群特征分层研究具有重要意义。
IL-8-251T/A的A等位基因可以增加肺癌发病率的机制还不清楚。T/A单核苷酸多态性在具有251对碱基的IL-8基因的启动子区上游的转录启始位点,并且体外实验已经证实其可影响IL-8的产生和IL-8启动子的转录活性[29-30]。几乎先前所有的研究[30-32]都证实-251的A等位基因与较高的IL-8转录活性直接相关。因此,A/A基因型可能具有激活代谢诱导剂和致癌物质作用。
本研究Meta分析存在局限性。第一,Meta的结果分析存在潜在的异质性。虽然试图通过全面的检索策略、严格的纳入标准和严谨的数据提取及分析尽可能最小化异质性的影响,但异质性仍出现在几乎所有研究间。异质性可因为对照组选择、年龄分布、生存环境因素等的差异而产生。尽管大多数研究选择健康人群作为对照组,但一些研究在肺癌患者的亲属或朋友中或在其他疾病的患者中选择对照组,从而产生不可避免的异质性。第二,仅纳入已发表的文献,那些得到不明显的阳性或阴性结果的研究没有被发表导致发表偏倚的存在。第三,本研究结果均是未修正的,如果能够得到个人数据,可以根据年龄、种族、家族史、环境因素和生活习惯等因素对结果进行修正,从而得到更加精确的分析结果。最后,即便观察到种族差异,也可能是因为标本量少导致的统计效力不足所致。本篇Meta分析仅纳入2篇亚裔人群的研究,因此所观察到的种族差异也可能是样本量少导致的偶然结果。因此,还需要进行采用标准化、科学方法,入组同质性肺癌患者和匹配的对照组的大样本双盲实验进一步验证。
综上所述,本篇Meta分析表明IL-8-251T/A基因多态性在全部人群中与肺癌发生风险无相关性,但是在亚裔人群中A等位基因的存在与肺癌发生风险显著相关。
[1] Alberg A J,Samet J M.Epidemiology of lung cancer[J].Chest,2003,123(Suppl 1):21-49.
[2] Molina J R,Yang P,Cassivi S D,et al.Non-small cell lung cancer:epidemiology,risk factors,treatment,and survivorship[J].Mayo Clin Proc,2008,83(5):584-594.
[3] Toh C K,Gao F,Lim W T,et al.Never-smokers with lung cancer:epidemiologic evidence of a distinct disease entity[J].J Clin Oncol,2006,24(15):2245-2251.
[4] Hull J,Ackerman H,Isles K,et al.Unusual haplotypic structure of IL8,a susceptibility locus for a common respiratory virus[J].Am J Hum Genet,2001,69(2):413-419.
[5] Baggiolini M,Walz A,Kunkel S L.Neutrophil-activating peptide-1/interleukin 8,a novel cytokine that activates neutrophils[J].J Clin Invest,1989,84(4):1045-1049.
[6] Rollins B J.Chemokines[J].Blood,1997,90(3):909-928.
[7] Du H,Bay B H,Mahendran R,et al.Endogenous expression of interleukin-8,interleukin-10 in nasopharyngeal carcinoma cells,the effect of photodynamic therapy[J].Int J Mol Med,2002,10(1):73-76.
[8] Heinzmann A,Ahlert I,Kurz T,et al.Association study suggests opposite effects of polymorphisms within IL8 on bron-chial asthma,respiratory syncytial virus bronchiolitis[J].J Allergy Clin Immunol,2004,114(3):671-676.
[9] van Aken B E,Reitsma P H,Rosendaal F R.Interleukin 8,venous thrombosis:evidence for a role of inflammation in thrombosis[J].Br J Haematol,2002,116(1):173-177.
[10] Koch A E,Polverini P J,Kunkel S L,et al.Interleukin-8 as a macrophage-derived mediator of angiogenesis[J].Science,1992,258(5089):1798-1801.
[11]Kitadai Y,Haruma K,Mukaida N,et al.Regulation of disease-progression genes in human gastric carcinoma cells by interleukin 8[J].Clin Cancer Res,2000,6(7):2735-2740.
[12] Bendre M S,Gaddy-Kurten D,Mon-Foote T,et al.Expression of interleukin 8 and not parathyroid hormone-related protein by human breast cancer cells correlates with bone metastasis in vivo[J].Cancer Res,2002,62(19):5571-5579.
[13] Li A,Dubey S,Varney M L,et al.IL-8 directly enhanced endothelial cell survival,proliferation,and matrix metallopro-teinases production and regulated angiogenesis[J].J Immunol,2003,170(6):3369-3376.
[14] Cochran W G.The combination of estimates from different experiments[J].Biometrics,1954,10(1):101-129.
[15] Mantel N,Haenszel W.Statistical aspects of the analysis of data from retrospective studies of disease[J].J Natl Cancer Inst,1959,22(4):719-748.
[16] DerSimonian R,Laird N.Meta-analysis in clinical trials[J].Control Clin Trials,1986,7(3):177-188.
[17] Tobias A.Assessing the influence of a single study in the meta-analysis estimate[J].Stata Tech Bull,1999,8(47):15-17.
[18]Egger M,Davey Smith G,Schneider M,et al.Bias in metaanalysis detected by a simple,graphical test[J].BMJ,1997,315(7109):629-634.
[19]Bhat I A,Pandith A A,Bhat B A,et al.Lack of association of a common polymorphism in the 3'-UTR of interleukin 8 with non small cell lung cancer in Kashmir[J].Asian Pac J Cancer Prev,2013,14(7):4403-4408.
[20] Rafrafi A,Chahed B,Kaabachi S,et al.Association of IL-8 gene polymorphisms with non small cell lung cancer in Tunisia:a case control study[J].Hum Immunol,2013,74(10):1368-1374.
[21]Lee K M,Shen M,Chapman R S,et al.Polymorphisms in immunoregulatory genes,smoky coal exposure and lung cancer risk in Xuan Wei,China[J].Carcinogenesis,2007,28(7):1437-1441.
[22] Vogel U,Christensen J,Wallin H,et al.Polymorphisms in genes involved in the inflammatory response and interaction with NSAID use or smoking in relation to lung cancer risk in a pro-spective study[J].Mutat Res,2008,639(1-2):89-100.
[23] Campa D,Hung R J,Mates D,et al.Lack of association between-251T/A polymorphism of IL8,lung cancer risk[J].Cancer Epidemiol Biomarkers Prev,2005,14(10):2457-2458.
[24]Campa D,Zienolddiny S,Maggini V,et al.Association of a common polymorphism in the cyclooxygenase 2 gene with risk of non-small cell lung cancer[J].Carcinogenesis,2004,25(2):229-235.
[25] Hull J,Rowlands K,Lockhart E,et al.Haplotype mapping of the bronchiolitis susceptibility locus near IL8[J].Hum Genet,2004,114(3):272-279.
[26]Cheng D,Hao Y,Zhou W,et al.Positive association between Interleukin-8-251A>T polymorphism and susceptibility to gastric carcinogenesis:a meta-analysis[J].Cancer Cell Int,2013,13(1):100.
[27] Wang Z,Liu Y,Yang L,et al.The polymorphism interleukin-8-251A/T is associated with a significantly increased risk of cancers from a Meta-analysis[J].Tumour Biol,2014,35(7):7115-7123.
[28]Hirschhorn J N,Lohmueller K,Byrne E,et al.A comprehensive review of genetic association studies[J].Genet Med,2002,4(2):45-61.
[29] Canedo P,Castanheira-Vale A J,Lunet N,et al.The interleukin-8-251*T/*A polymorphism is not associated with risk for gastric carcinoma development in a Portuguese population[J].Eur J Cancer Prev,2008,17(1):28-32.
[30] Hull J,Thomson A,Kwiatkowski D.Association of respiratory syncytial virus bronchiolitis with the interleukin 8 gene region in UK families[J].Thorax,2000,55(12):1023-1027.
[31] Hull J,Ackerman H,Isles K,et al.Unusual haplotypic structure of IL-8,a susceptibility locus for a common respiratory virus[J].Am J Hum Genet,2001,69(2):413-419.
[32]Taguchi A,Ohmiya N,Shirai K,et al.Interleukin-8 promoter polymorphism increases the risk of atrophic gastritis and gastric cancer in Japan[J].Cancer Epidemiol Biomarkers Prev,2005,14(11 Pt 1):2487-2493.

