微波处理对米糠蛋白结构及功能性的影响
郝天舒,王长远
黑龙江八一农垦大学食品学院,大庆 163319
米糠蛋白的必需氨基酸完全,氨基酸组成接近FAO/WHO 的推荐模式;米糠蛋白中赖氨酸含量高于大米胚乳、小麦面粉以及其它谷物,生物效价与牛奶中的酪蛋白相近,消化率达90%以上,是一种营养价值很高的植物蛋白。另外,由于其具有低过敏性的特点,故可在婴幼儿食品中应用[1-3]。尽管米糠蛋白的营养价值较高,但米糠蛋白的有效提取及功能性发挥相对受制,因而现今的研究多围绕增进米糠蛋白提取率及合理米糠蛋白改性展开。其中微波技术是一种米糠蛋白辅助增溶及提高制取率的常用技术,但目前对此技术的研究多集中在以提高得率为目标的提取工艺上,对于微波处理下米糠蛋白结构特征及功能性的变化研究尚未见报道。
目前,在蛋白质的构象研究中,由于受到分散介质的影响,较多结构分析仪器无法完成正常测定或受到一定测定影响,由于水的拉曼散射很微弱,拉曼光谱是研究水溶液中的生物样品和化学化合物的理想工具。从蛋白质的拉曼光谱可以得到有关它的芳香族组成氨基酸的信息,还能进一步得到二级结构的信息。有关利用拉曼光谱分析多肽及蛋白质构型的研究国内外均有报道[4-7]。
本研究拟采用拉曼光谱研究微波处理对米糠蛋白结构的影响,并探究了微波处理对米糠蛋白功能性的影响,以期通过结构变化的辨认为探清微波处理下米糠蛋白功能性改良提供指导。
1 材料与方法
1.1 材料与仪器
材料:米糠蛋白,由实验室制备(米糠蛋白蛋白含量为89.21%);其它化学试剂均为国产分析纯。
主要仪器:格兰仕WP800TL23-K3 微波炉,格兰仕集团;PE Raman Station 400 激光显微拉曼光谱仪,美国PE 公司;TD5A-WS 台式低速离心机,湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 米糠蛋白的制备及微波处理
将新鲜粗米糠(蛋白质含量约为14.0%),经60 目筛除杂质,向过筛米糠中以1∶6 的比例加入正己烷,室温下搅拌2 h,然后停止搅拌静止5 min 将上清液倒入回收瓶待回收,再用料液比为1∶4 的比例加入正己烷继续搅拌2 h,4000 rpm 离心5 min,沉淀在通风橱中室温风干,制得脱脂米糠备用。
脱脂米糠100 g,按料液比1∶10 加入1000 mL水,用NaOH 溶液调pH 至9,45 ℃下恒温水浴搅拌2 h,4000 rpm 下离心20 min,收集上清液,调节pH至4.5,静止沉淀后4000 rpm 离心15 min,倾去上清液,沉淀于4 ℃对蒸馏水透析48 h,沉淀真空冷冻干燥,即为米糠蛋白粉,所制备的米糠蛋白粉经DE-52纤维素阴离子交换层析初步纯化后,利用Sephadex G-75 凝胶过滤层析柱再次纯化。纯化后样品冻干并于-20 ℃保存备用。经测定,所制备的米糠蛋白蛋白含量为89.21%。
将米糠蛋白溶解在pH 7.4、10 mM 的磷酸缓冲液(标准缓冲液)中,磁力搅拌2 h 配制成浓度为3%的米糠蛋白溶液。4000 rpm 离心10 min 除去不溶物,以用作储备液。然后将储备液用标准缓冲液稀释分装在三角瓶中,用软胶塞塞住瓶口避免水分蒸发。
将充分水合的米糠蛋白液置于微波炉物料仓中,调整微波炉的功率输出分别为136、296、528、680、800 W,设置加热时间为5 min。微波处理结束后将米糠蛋白液冷却、冻干,留样待测。对应于微波功率136、296、528、680、800 W,处理后的米糠蛋白液温度分别为90、90、92、100、102 ℃,将微波处理后的米糠蛋白样品分别记为W-1、W-2、W-3、W-4、W-5;未经微波处理的米糠蛋白作为对照样品,记为RBP。
1.2.2 拉曼光谱分析
将米糠分离蛋白分散在相应的pH 缓冲液中配制成100 mg/mL 溶液进行拉曼实验,激发光波长785 nm,发射功率300 mW,测量拉曼谱范围为400~2000 cm-1。每个样品都重复扫描3 次以上,各样品的拉曼谱图都由计算机做信号累加平均并绘图输出,峰位误差小于±3 cm-1。
拉曼图谱基线校正、归属采用OMINIC 软件,归一化处理以苯丙氨酸的1003 cm-1为内标,以此作为各拉曼峰强度变化的依据,谱图的拟合采用Origin 8.0 软件。
1.2.3 溶解性
蛋白的溶解性以氮溶指数表示。精确称取2.00 g 蛋白样品,溶解于45 mL 蒸馏水中,调节pH 至7.0,室温下搅拌1 h 后,在4000 rpm 下离心20 min除去沉淀,测定上清液中的氮含量。

1.2.4 乳化及乳化稳定性
微波处理后米糠蛋白的乳化性及乳化稳定性测试方法参照Agyare 等[8]。准确称取1.00 g 样品,加入到0.05 mol/L,pH 7.0 的磷酸缓冲液中,配置成1%的蛋白溶液100 mL,使之充分溶解。取75 mL蛋白溶液与25 mL 大豆油充分混合,在高速剪切乳化机下10000 rpm 乳化2 min,然后立刻在0 min 烧杯底部吸取20 μL 乳状液,加入至5 mL 0.1%的SDS 溶液中混合均匀,使之稀释250 倍。以浓度为0.1%的SDS 溶液为空白样品,测定500 nm 下的吸光值。按下面公式计算乳化活性EAI。

其中:T=2.303;N 为稀释倍数,250;c 为乳化液未形成前蛋白质溶液的浓度(g/mL);Φ 为乳化液中油相体积分数,0.25;A0为0 min 时的吸光值。
测定蛋白的乳化稳定性,则待乳化液放置10 min 后,再从烧杯底部吸取乳状液(一定要与0 min取样点的高度相同),按如上方法测定吸光值。按下面公式计算乳化稳定性ES。

其中:A0为0 min 时的吸光值;A10为10 min 时的吸光值;t 为间隔时间,10 min。
1.2.5 起泡及起泡稳定性
微波处理后米糠蛋白的起泡性及泡沫稳定性测试方法参照Agyare 等[8]。将蛋白样品取一定量加入到0.01 mol/L 的pH 7.0 磷酸缓冲液中,配置成5%蛋白溶液,取200 mL 样品,在高速均质机下以10000 rpm,搅打2 min,快速移至500 mL 量筒中,记录0 min,15 min 泡沫的高度,表示蛋白起泡能力的大小,并进行3 次重复试验。按如下公式计算:

其中,H 为未搅打时溶液的高度,cm;H0为搅打停止时泡沫的高度,cm。

其中,H15为搅打停止静置15 min 时泡沫的高度,cm。
1.2.6 数据处理
单项实验重复三次,采用SPSS19.0 对数据进行差异显著性分析,其他数据拟合处理采用Origin8.5软件。
2 结果与分析
2.1 微波处理对米糠蛋白结构影响的拉曼分析
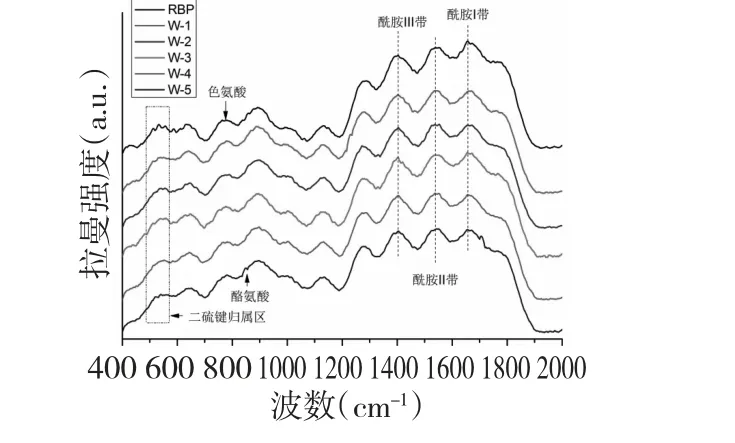
图1 不同微波处理条件下米糠蛋白的拉曼光谱图Fig.1 Raman spectra of rice bran protein under different conditions
图1 所示为不同拉曼处理条件下米糠蛋白的拉曼光谱图,谱线以苯丙氨酸在1003 cm-1处的拉曼归属峰作为内标,利用OMINIC 软件归一化处理,在此基础上计算了不同微波处理条件下米糠蛋白中各个基团的谱线强度的变化率。此后采用Orgin8.0 软件进行分峰指认及平滑处理,最终拟合结果如图1所示。
2.1.1 微波处理对米糠蛋白二级结构影响的拉曼分析
为确定米糠蛋白的二级结构组成在超声处理下的变化,试验采用OMINIC 软件对米糠蛋白拉曼光谱的酰胺I 区进行解析,经整合现有文献得知蛋白质的二级结构单元的拉曼峰位归属为[9]:α-螺旋结构1645~1660 cm-1;β-折叠结构1665~1680 cm-1;β-转角结构1680~1690 cm-1;无规卷曲结构1660~1670 cm-1,进一步分析得到相应结果如表1 所示。

表1 利用酰胺Ⅰ带拟合米糠蛋白二级结构组成结果Table 1 Secondary structure of rice bran protein fitted by amide I
由表1 可知,未经微波处理的米糠蛋白二级结构组成主要为β-折叠构象,α-螺旋结构及无规则卷曲结构含量次之,β-转角结构含量最少。相比于未处理的米糠蛋白,微波处理总体降低了米糠蛋白的α-螺旋结构和β-折叠结构含量,但增加了β-转角结构和无规则卷曲结构含量。
随着微波强度的增大,米糠蛋白的α-螺旋结构含量和β-转角结构均呈先降低后增加的变化趋势,而β-折叠结构含量总体呈降低趋势,无规则卷曲结构含量则呈现先增加后降低的变化趋势。
2.1.2 微波处理对米糠蛋白侧链结构影响的拉曼分析
850 cm-1和830 cm-1是酪氨酸残基的苯环的呼吸振动和面外弯曲倍频之间的费米共振[10],通过公式(1)可进一步精确地表征酪氨酸分子暴露与包埋数[11]。

通过公式计算,酪氨酸分子暴露与包埋数比值如表2,由表2 可知未微波处理的米糠蛋白其酪氨酸主要呈现暴露态,总体而言,微波处理后酪氨酸的暴露分子数呈现微量增加,但微波功率强度的增加并未显著影响酪氨酸分子的分布状态。
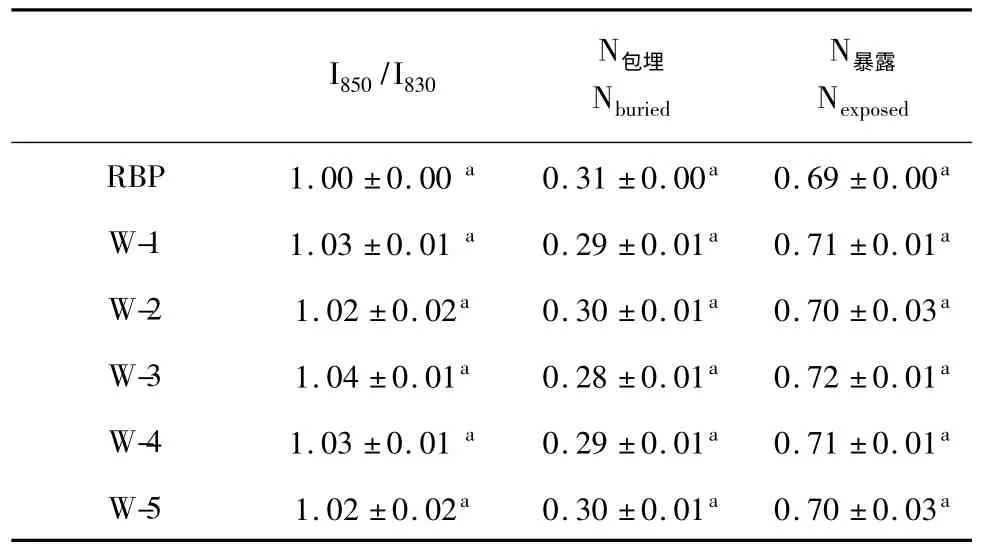
表2 酪氨酸费米共振线I850/I830及残基暴露与包埋分子数Table 2 Ratio of the intensity of the Fermi-resonance doublet of tyrosine and the number of exposed and the buried tyrosines per molecules
756 cm-1附近的拉曼谱带归属为色氨酸侧链,图2 所示为不同微波处理下色氨酸侧链的变化。由图可知,色氨酸的相对拉曼强度经微波处理后有较为明显的降低,Li-Chan 研究指出色氨酸相对拉曼强度的降低与微环境状态有关,色氨酸相对拉曼强度降低时色氨酸更趋近于“暴露态”。但随着微波功率的进一步增大,色氨酸相对拉曼强度呈现增大的变化趋势,而色氨酸的增大主要是由于微波引起的米糠蛋白聚集使内部的疏水性残基包埋引起的。
2.1.3 微波处理对米糠蛋白二硫键振动模式影响的拉曼分析
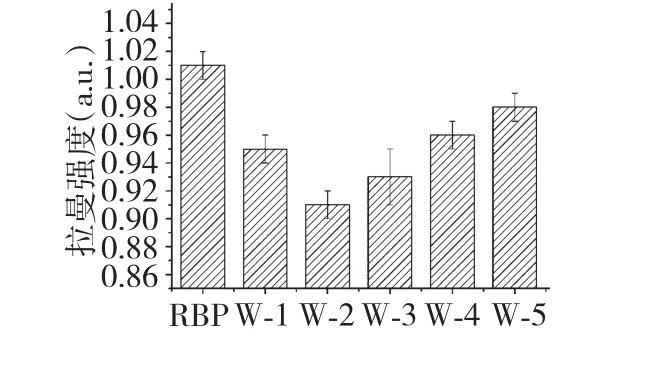
图2 微波处理对色氨酸侧链环境的影响Fig.2 Effect of microwave treatment on tryptophan side chain environment

图3 米糠分离蛋白拉曼谱带在490~560 cm-1区域内的高斯拟合Fig.3 The decomposition of the components of rice bran protein in the ranges of 490-560 cm-1
500~550 cm-1范围内是二硫键的特征谱带。二硫键在不同振动模式下所反应出来的拉曼位移有所不同,如500~510 cm-1处为gauche-gauche-gauche(g-g-g)模式,515~525 cm-1为gauche-gauche-trans(g-g-t)模式,535~545 cm-1为trans-gauche-trans(tg-t)模式[11]。

图4 微波处理对米糠蛋白的二硫键的影响Fig.4 Effects of microwave treatment on the conformation of the S-S bonds of rice bran protein
由此结合图4 可知,t-g-t 模式为米糠蛋白最主要的二硫键振动模式,微波处理后t-g-t 模式总体增多,而其他两种二硫键振动模式含量在微波处理后均有所降低。随着微波处理功率的增大,t-g-t 模式和g-g-g 模式均呈现先增大后降低的变化趋势,而二硫键的g-g-t 振动模式含量则呈现先减少后增加的变化趋势。对于随着微波处理功率的增大二硫键的变化规律现今研究尚不能全面解析,因为伴随着微波输出功率增大,微波极化作用及蛋白质聚集作用的混合作用更为明显,而上述两种作用对蛋白质二硫键的振动模式影响更无法衡量。但有研究指出,二硫键的构型特征与蛋白质二级结构构成(尤其是α-螺旋结构)有关,并呈现一定的相关性[12]。可以看出,随着微波功率的增强,二硫键g-g-t 构型变化趋势与α-螺旋结构变化相符,而其他二硫键构型也表现出与β-转角、无规则卷曲结构含量相似的变化趋势,也在一定印证了二硫键研究的正确性,为后续深入探讨奠定基础。
2.2 溶解性
蛋白质的溶解性是蛋白质最主要功能特性,溶解性的表达在很大程度上影响着其他功能性质,另外,蛋白质的溶解性也会较为显著地影响蛋白质的商用及营养价值。

图5 微波处理对米糠蛋白溶解性的影响Fig.5 Effects of microwave treatment on solubility of rice bran protein
由图5 可知,微波处理后米糠蛋白的溶解性有所增大,溶解性在微波功率为528 W 时有最大值63.5%。另外,由图5 也可得知,米糠蛋白在高功率下溶解性有所降低。
2.3 乳化性及乳化稳定性
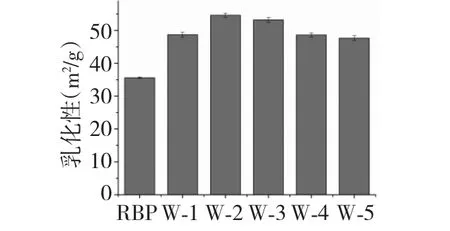
图6 微波处理对米糠蛋白乳化性的影响Fig.6 Effects of microwave treatment on emulsion of rice bran protein
乳化性是指互不相溶的液体在机械搅拌后形成乳液的能力。乳化性是蛋白质较为重要的表面性质之一,这主要是由于蛋白分子链内分布有较多的亲水或疏水基团,亲水性及疏水性基团的存在也决定了蛋白质的表面活性特点[13,14]。米糠蛋白乳化性在食品加工过程中起到了重要的作用,因此,现今研究多围绕此功能性质展开。
由图6 可知,微波处理后米糠蛋白乳化性得到较大幅度提高,微波处理功率为296 W 时米糠蛋白乳化性有最大值54.6 m2/g。而在高微波功率下,米糠蛋白乳化性呈小幅降低,相较于微波处理功率为296 W,微波处理功率800 W 时米糠蛋白的乳化性为45.12%。

图7 微波处理对米糠蛋白乳化稳定性的影响Fig.7 Effects of microwave treatment on emulsion stability of rice bran protein
如图7 所示,微波处理有益于米糠蛋白乳化性的稳定,主要表现为微波处理下米糠蛋白乳化稳定性均有所增加,米糠蛋白分子柔性的增强及内部疏水性基团的暴露是上述现象的主要原因。
2.4 起泡性
为了测试米糠蛋白的起泡性,试验采用泡沫膨胀率为指标进行分析。微波处理对米糠蛋白起泡性的影响如图8 所示,由图可知未处理条件下米糠蛋白的起泡性较差,这主要是由于米糠蛋白的结构相对致密,内部富含二硫键增进了结构的紧实性,难以分散形成泡沫[9]。

图8 微波处理对米糠蛋白起泡性的影响Fig.8 Effects of microwave treatment on foamation of rice bran protein
由图8 可知,微波处理后米糠蛋白的起泡性增大,微波处理功率为528 W 时米糠蛋白起泡性有最大值63.5%。而由于微波处理强度的进一步增大,使米糠蛋白在高功率下起泡性降低。

图9 微波处理对米糠蛋白起泡稳定性的影响Fig.9 Effects of microwave treatment on foamation stability of rice bran protein
由图9 可知,微波处理后米糠蛋白的泡沫稳定性并未发生显著变化,这可能是由于微波处理下米糠蛋白的结构重排主要影响了其起泡性,对于泡沫的形成稳定性影响较不明显。
3 讨论与结论
微波处理总体降低了米糠蛋白的α-螺旋结构和β-折叠结构含量,但增加了β-转角结构和无规则卷曲结构含量现有研究表明,蛋白质的分子极化现象是微波处理的主要变化,微波处理下米糠蛋白的分子极化使维持蛋白空间结构的非共价键被破坏,蛋白质分子结构部分展开[9]、疏水性基团的暴露,因而蛋白质分子内主要的有序结构逐渐转变为无序结构。g-g-g 模式是典型的分子内二硫键振动模式,其含量的减少可以说明微波处理诱导了蛋白质的极化现象,蛋白质在此过程中结构展开,更多的分子内二硫键通过巯基-二硫键交换反应形成分子间二硫键。
上述蛋白质在微波处理下的结构变化,有利于水分子的浸入,进而增强了水合作用,提高了米糠蛋白的溶解性[15]。且由于微波处理后米糠蛋白的分子结构变得更为松散,内部疏水性基团暴露,促进了其与油脂之间的结合,而极性基团与水之间亦发生明显的水合作用,综合效应使米糠蛋白乳化性得以增强。微波场诱导下米糠蛋白分子结构的展开也在一定程度上促进了水-空气界面的形成,另外,展开的蛋白质分子间彼此作用构成更加稳定的网络结构及界面膜,使米糠蛋白的起泡性得以增强[16,17]。
随着微波强度的增大,米糠蛋白的α-螺旋结构和β-转角结构含量先降低后增加,而β-折叠结构含量总体呈降低趋势,无规则卷曲结构含量先增加后降低。这种现象主要是由于蛋白分子结构更大程度地展开,极化的蛋白分子之间相互吸引,通过疏水相互作用、二硫键、静电相互作用及氢键等重新形成分子聚集体[12]。而蛋白质的聚集现象考虑可能是米糠蛋白二级结构在高功率微波处理下特殊变化的原因。另有部分研究表明,微波所引起的蛋白质聚集是β-折叠构象减少的一个重要原因[13]。对于无规则卷曲结构在高功率微波处理下的降低,也能很好地证明米糠蛋白在此条件下发生了较为明显的聚集现象。而在高功率下色氨酸趋于“包埋态”亦能说明米糠蛋白在此条件下发生了蛋白质的聚集现象。
米糠蛋白在高微波处理条件下的溶解性降低与蛋白质的变性及分子聚集有关,且由于蛋白质分子之间的聚合使蛋白分子柔性降低,蛋白质表面疏水性降低,进而造成了米糠蛋白乳化性的降低。而米糠蛋白分子展开程度增大,内部的疏水基团和巯基暴露程度增加,极化的蛋白分子之间通过非共价键重新形成更大的分子聚集体,水-空气界面膜的稳定性下降[18-20]。
综上所述,适当的微波处理可以改善米糠蛋白的溶解性、乳化性、乳化稳定性、起泡性等,拓宽米糠蛋白产品的应用领域。
1 Prakash J.Rice bran proteins:properties and food use.Crit Rev Food Sci,1996,36:537-552.
2 Zhu L (朱磊),Wang XD (汪学德),Yu XG (于新国).Research advance on integrated of rice bran protein.China Oils Fats (中国油脂),2013,11(2):81-83.
3 Zheng YY(郑煜焱),Zeng J(曾洁),Li J(李晶),et al.Composition and functional properties of rice bran proteins.Food Sci (食品科学),2012,23(6):56-59.
4 Deckert-Gaudig T,Deckert V.Ultraflat transparent gold nanoplates--ideal substrates for tip-enhanced Raman scattering experiments.Small,2009,5:432-436.
5 Deckert-Gaudig T,Kämmer E,Deckert V.Tracking of nanoscale structural variations on a single amyloid fibril with tip-enhanced Raman scattering.J Biophotonics,2012,5:215-219.
6 Oladepo SA,Xiong K,Hong Z,et al.UV resonance Raman investigations of peptide and protein structure and dynamics.Chem Rev,2012,112:2604-2628.
7 Duan S,Xu X,Luo Y,et al.Molecular polarization bridging physical and chemical enhancements in surface enhanced Raman scattering.Chem Commun (Camb),2011,47:11438-11440.
8 Agyare KK,Addo K,Xiong YL.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt.Food Hydrocolloids,2009,23:72-81.
9 Sun BY(孙冰玉),Shi YG(石彦国).Effects of ultrasonic wave on emulsification of ALSPC.J Chin Cereals Oils Assoc(中国粮油学报),2006,21(4):60-63.
10 Charoen R,Jangchud A,Jangchud K,et al.Influence of biopolymer emulsifier type on formation and stability of rice bran oil-in-water emulsions:whey protein,gum arabic,and modified starch.J Food Sci,2011,76:165-172.
11 Stathopulos PB,Scholz GA,Hwang YM,et al.Sonication of proteins causes formation of aggregates that resemble amyloid.Protein Sci,2004,13:3017-3027.
12 Narhi LO,Li CH,Ramachander R,et al.Molecular biophysics for the life sciences.New York:Springer,2013:33-90.
13 Lu X,Al-Qadiri HM,Lin M,et al.Application of mid-infrared and Raman spectroscopy to the study of bacteria.Food Bioproc Tech,2011,4:919-935.
14 Militello V,Vetri V,Leone M.Conformational changes involved in thermal aggregation processes of bovine serum albumin.Biophys Chem,2003,105:133-141.
15 Xiong J(熊犍),Feng LL(冯凌淩),Ye J(叶君).The effects on solubility of SPC by microwave radiation.Food Ferment Ind (食品与发酵工业),2006,32:107-110.
16 Tu ZC,Zhang L,Wang H,et al.Structure and antioxidant activity of milk model systems after microwave heating.Food Sci Tech Res,2014,20:345-355.
17 Li YQ(李迎秋),Chen Z(陈正).Effect of high intensity pulsed electric field on the functional properties of protein isolated from soybean.Trans CSAE (农业工程学报),2006,22:194-198.
18 Yang XQ(杨小泉),Xiong J(熊健),Chen Z(陈中),et al.Effects of ultrasonification on protein extraction of defatted soy flakes and functionality of SPI.J South China Univ Technol,Nat Sci(华南理工大学学报,自科版),2003,31(11):30-32.
19 Rabiey L,Britten M.Effect of protein composition on the rheological properties of acid-induced whey protein gels.Food Hydrocolloid,2009,23:973-979.
20 Donato L,Schmitt C,Rouvet M,et al.Mechanism of formation of stable heat-induced β-lactoglobulin microgels.Int Dairy J,2009,19:295-306.

