如何画原子结构图
王春凤 管 靖 郭玉英
(1.北京师范大学物理学系,北京 100875;2.北京师范大学学报自然科学版编辑部,北京 100875)
学生经常提出这样的问题:“说到原子模型,原子是不是实物呢?有人说原子不是一种特定的实物,而只是个模型.我们对这个说法不太理解,有点疑问.”怎么会有这样的问题呢?可能有一个原因,就是在经典思维中,既然是实物就不同于场,实物就一定要有一个实实在在的样子,但是现在只看见各种各样的原子模型,可还是不知道原子到底是什么样子,所以就出现了这样的说法和疑问.要解决这个问题,涉及到如何才能正确地理解微观世界的问题.
1 原子的认识过程
首先应确认,物质分为两大类:实物和场.不但原子是实物,原子核、质子、中子、电子等等都是实物,只有由场“粒子化”而来的光子才不是实物.
物理学的特征之一就是模型化,对于原子结构也是一样,历史上出现过的、有影响的原子模型不少,其中就有汤姆逊(即开尔文爵士)的“葡萄干蛋糕模型”、长冈半太郎的“土星模型”、卢瑟福的“行星模型”和玻尔的“玻尔模型”等等.
回顾一下人类对原子的认识过程,最早的原子学说,可以追溯到古代,古代西方哲学家就曾经设想,物质由最简单的不可分割的基本单元——原子所构成.然而建立在科学基础上的原子学说是近300年发展起来的.18世纪以后,随着物理学和化学的发展,人们真正认识到物质是由分子组成,而分子又是由原子组成的,但当时仍把原子看成是组成物质的基本单元,这时原子的模型差不多就是个小球,不可再分,也就没有结构.
从1895年开始,由于放射性和电子的发现使人们确信,原子是可以分割的、存在着内部结构,从而开始了对原子结构的研究.人们设想了很多实验来确定原子的内部结构.因为已经知道电子的质量和线度比原子的质量和线度小得多;再根据光电效应和放射性物质可以发出β射线(电子射线),可以断定原子内包含电子.因此就需要进一步研究:一个原子中有几个电子?原子是电中性的,所以其中一定有带正电荷的部分,这种带正电荷的成分是什么?它们在原子中是如何分布的?
汤姆逊于1904年提出了一个有影响的原子的“葡萄干蛋糕模型”.他设想原子是一个带正电荷的实心小球,正电荷均匀分布于其中,其正电荷总电荷量与原子中电子的总电荷量相等,电子则嵌在小球之中,犹如葡萄干蛋糕一般.
汤姆逊的学生卢瑟福指导他的助手盖革和马斯顿进行了α粒子散射实验,用来验证汤姆逊的原子模型是否正确.卢瑟福本来当然是相信汤姆逊模型的,依据汤姆逊模型,可以估算出散射角大于90°的α粒子数小于总数的10-3500.卢瑟福最初的实验结果也证实了散射角较小的α粒子在数量上占有优势,但1909年在实验中发现散射角大于90°的α粒子数占总粒子数的比率为万分之一而不是10-3500,这使卢瑟福大吃一惊.正如他自己所说:“这简直是我们一生中所遇到的最难以置信的事件,几乎同你们把一发15in炮弹射向一张薄纸时它会回过来打中你们自己一样难以置信.”因为按照汤姆逊的葡萄干蛋糕模型计算,原子决不能提供如此强大的斥力,使具有巨大动能的α粒子做反向散射.实验的结果使卢瑟福放弃了汤姆逊的原子模型,受长冈半太郎的原子土星模型的启发,而产生了原子具有线度很小而质量很大的核心的想法,并于1911年提出了原子的行星模型:“一切原子都有一个核,它的半径小于10-14m,原子核带正电,其电荷为Ze,原子半径为10-10m,电子位于以核为中心以10-10m为半径的球内或球面上,为了平衡,电子必须像行星一样绕核旋转.”在1911—1913年间,盖革和马斯顿在卢瑟福的指导下继续做α粒子散射实验,记录下了10万个以上的数据,以一系列精美的实验证实了卢瑟福的原子有一个半径小于10-14m的原子核的理论.
卢瑟福的原子模型依然是一个经典的原子模型,模型中原子具有线度很小而质量很大的原子核的理论得到实验的证实,但电子像行星一样绕核旋转的理论却遇到了无法克服的困难.按照经典电磁理论,如果电子绕核旋转,则由于做曲线运动的电子具有加速度,电子将不断地辐射能量而减速,其轨道半径会不断减小,最后将掉到原子核上去,这样的原子是非常不稳定的,可估算出其寿命不到10-8s.而在现实中,原子稳定地存在于自然界,在经典物理面前,这个问题无法解决.此外,卢瑟福模型也无法对原子光谱作出解释,成为该模型无法解决的第2个困难.由于卢瑟福模型的成功仅在于“有核”,所以我们认为应该称它为“有核模型”.
卢瑟福也知道自己的理论存在问题,他认为科学不但有今天还有明天,寄予科学进一步发展的希望于年轻一代.卢瑟福是正确的,曾在他的实验室工作过的年轻的玻尔就找到了解决这个问题的道路.卢瑟福的学生中有十余人获得诺贝尔奖,所以他或许不是最优秀的物理学家,但他可能是最优秀的教师.
本分老实的盖革和马斯顿对科学的发展作出了他们的贡献,然而更具创新精神的玻尔却离开了卢瑟福的实验室,另辟蹊径地提出了原子的玻尔模型.下面就是玻尔模型要点中的两个.
(1)定态假设.电子在原子中绕核做圆周运动时,并不发生电磁辐射,这样的圆轨道运动状态是电子的稳定状态(简称定态).每一个定态与一定的电子能量相对应,电子的能量为E1、E2…等离散值.[1]
(2)跃迁假设和频率法则.只有当电子从能量高的轨道i向能量低的轨道f(即由定态i向定态f)跃迁时,才发射电磁波,其频率满足频率法则hν=Ei-Ef.[1]
如果说能量量子化的概念还可以从普朗克的能量子假说和爱因斯坦的光量子理论中得到启发,定态和量子跃迁的概念和频率法则是玻尔了不起的创见,玻尔理论“规定”了原子的稳定性,并在解释氢原子光谱方面取得了巨大的成功.
1913年玻尔的理论使早期量子论趋于完善.定态和能级跃迁是两个不能从经典物理概念中得出的全新的概念,它们是量子理论的基本思想,是玻尔对量子理论的伟大贡献.玻尔理论的重要成就在于继普朗克、爱因斯坦等人之后进一步冲破经典物理的束缚,真正打开了人们认识原子结构的大门,架起了由经典物理通向量子物理的桥梁,这是玻尔对物理学发展的革命性的贡献.
在1904年到1913年的10年间,人类对微观世界的认识发生了两次飞跃,玻尔理论为解释原子结构提供了一个简单直观的理论体系,可解释许多有关的现象,直到现在,当讨论和原子有关的现象时,仍常用玻尔理论作定性分析和估算.
物理学的每一次重大变革是经历了许多物理学家相继创造的结果,在这种“接力赛”中每个物理学家只能完成各自的一段任务.玻尔做了从经典到量子的搭桥工作,但并没有登上量子力学的彼岸.
玻尔理论是半经典、半量子的混合物,它一方面指出经典物理不适用于原子内部,提出了电子运动定态的概念,另一方面又保留了电子有确定的位置和动量,绕原子核按轨道运动的经典概念,并用经典力学加以计算.玻尔理论虽解决了原子稳定性的问题,但在理论上仍然是矛盾的,因为电子如果按经典轨道运行,则必发生电磁辐射,也就不可能存在定态.玻尔理论虽然能通过能级跃迁解释氢原子光谱的一些规律,但却不能解释光谱线的强度.同时,对即使是只比氢原子多1个电子的氦原子,玻尔理论也不能解释其光谱规律,等等.
从理论体系上看,玻尔理论基本是在经典物理的框架中加入了几条本来与经典理论不相容的量子理论的假设,虽然这些量子理论的假设导致了其理论的局部成功并充分体现了玻尔的智慧,但这些假设多少带有人为强加的性质,并没有从根本上揭示出量子化的本质.玻尔理论的缺陷和弱点,使人们认识到早期量子论对经典理论的革命是不彻底的,仅依靠在经典理论的基础上强加量子化条件的办法讨论微观现象是行不通的,必须设法认识微观现象的本质,建立新的更深刻的理论.
2 几种典型原子结构模型分析
最早的小球模型和葡萄干蛋糕模型大家想象起来太容易了,不用画图都能明白.卢瑟福的行星模型也易于想象,画个图也不难.正因为玻尔模型有相当的经典成分和直观性,画出图来和卢瑟福的行星模型也没多大差别,图1画的就是碳原子的玻尔模型,这可能是我们们真正能够画出来的最近代的一个模型了,立足现代,这样的图一定要加图注“玻尔模型”,因为这不是真实的原子结构图示.
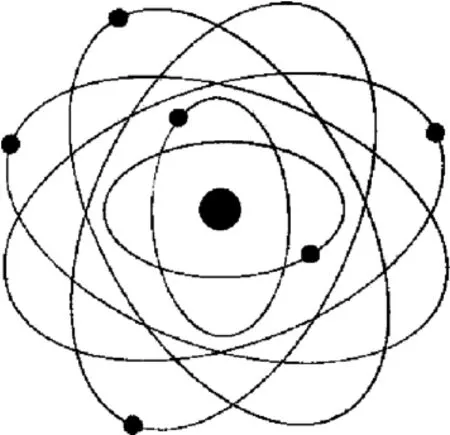
图1
上面讨论的都是具有经典图像的经典和半经典模型,模型的改进表征了人类对原子认识的逐步深化.在量子力学建立以后,人类对于微观世界的认识达到了前所未有的深刻程度,但是,现代的原子结构模型却再也不可能像以前的模型一样具有“直观而有形”的图像了.对此,下面就结合“原子结构图该怎么画?”进行讨论.目前可以见到不少的原子结构图,如图2-图5所示.
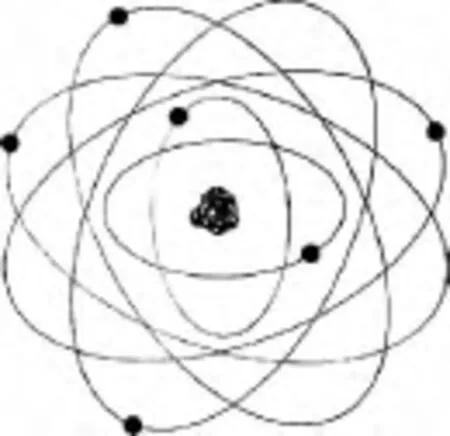
图2
图3

图4

图5
有人说图2和图3也是玻尔模型,我们不这么认为,在玻尔模型中不涉及原子核的结构,这超出了玻尔提出的玻尔模型对原子结构的认识水平.图2比图3好的地方是把碳原子的6个电子画成2层,比把6个电子画在一个球面上好些.图3比图2好的地方是画出了电子的动态,看起来比较生动.因为如果按原子、原子核和电子大小的真实比例是无法画图的,所以图4的好处是标出了原子、原子核和电子大小的尺度.图5脱胎于图3,只是没有画电子运动的轨道.
实际上一些教材曾以类似图2或图3的图作为原子结构图,但受到了指责,原因是在现代微观理论中没有粒子运动轨道的概念,所以画出电子运动的轨道是不对的.也正因为如此,一些教材把原子结构图改成了类似于图5,好像就不受指责了.但我们以为,按照现代微观理论,图5相对图3没有原则的改进,原因如下.
(1)质子和中子是小球吗?电子是小球吗?这里就以电子为例,电子具有“波粒二象性”,但电子的粒子性绝不是说电子就如同经典力学中的质点,只是说它在与物质的相互作用(包括观测)中总是以不可分割的整个电子出现,测量时它总是出现在一个点,具有颗粒性;电子在运动中波动性更为主要,没人知道运动中的电子是什么样子,但是电子绝不可能是图中画的小球.
(2)对于微观粒子,比如电子,没有轨道的概念,这是因为微观粒子遵循的是概率性的规律,不遵循经典牛顿力学决定性的规律.依据经典牛顿力学的决定性规律,知道质点现在的运动状态,就可以知道质点以后和以前的运动状态,于是就有了轨道的概念,还可以追寻质点由哪里来,把各个质点区分开来.所以图4和图5中既然画出了运动电子拖着的“尾巴”,就等于说明知道了电子的是从哪里过来的,也就等于承认了电子运动遵循经典力学决定性的规律,这和画出电子运动的轨道没有区别.
那么,在现代微观理论中原子的结构如何呢?现在知道,原子大小的尺度为10-10m;原子有一个原子核,它大小的尺度为10-15m~10-14m,由质子和中子构成;电子大小的尺度小于10-18m,电子在原子的空间范围内运动;正常状态的原子内的电子数与原子核内的质子数相等,原子整体呈现电中性.如果问原子结构到底是什么样子,我们不知道,我们想也没人知道,就像没人知道电子到底是什么样子一样,所以,真正的原子结构图没人会画,也不能画,能画出来的就一定是错的.其实连表述都得注意,比如可以说“电子在原子的空间范围内运动”,但最好不说“电子绕原子核转动”,因为“转动”只是一个经典的概念.
如果非要画图说明原子结构,就只能画“经典示意图”了,严格说来是原子模型图.人类在认识原子结构的过程中建构了多个不同的模型,这是学生学习的重要资源,对于学生认识物理的本质非常重要.至于用图1-图5中的哪一种图,就看各人的喜好了,提醒读者一定注意,如果你是教师,一定要告诉学生这些图不是真实的;如果你是教材编写者,一定要注明这是经典模型示意图,不是真实的.图2是碳原子的经典示意图,没什么问题,原子核由6个质子和6个中子构成.图3是碳原子、图4是锂原子的经典示意图;但我们认为最好不把电子画在同一个球面上,图4还是画上轨道更好,反正是经典示意图,不画轨道也还是经典示意图.图5没什么优点.在教材和教学中使用经典示意图没有问题,即使在大学的量子力学课程和教材中,有时也只能画出和使用各种经典示意图,只要说清楚了就没问题.
我们认为图1的碳原子的玻尔模型,是一个和现代微观理论最接近的、而又能直观地反映一个在物理学史中有重要地位的原子模型的图.对于中学生而言,既直观又便于理解原子的基本结构.我国的科学研究中最薄弱可能就是教学研究了,教学研究是和教学实践直接相关的非理论性的研究,研究教学的内容和教学的方式,关注教学中具体讲什么、怎么讲,等等.国际物理教育研究中的大量选题都是教学研究.例如,大学量子力学课程中原来一般都是先讲玻尔理论,再讲量子力学本身,有人对此提出质疑,先讲清一个有很多缺陷的玻尔理论,再告诉学生玻尔理论如何不对,然后再讲量子力学,这完全没有必要.这样的质疑看似很有道理,但是,近年美国的教学研究专家花费5年时间,经过严谨的调查研究证明,先讲玻尔理论后讲量子力学的传统方法比不讲玻尔理论的效果更好,对看来有道理的质疑给出了科学的否定.这个研究既说明了教学研究的重要性,也说明了玻尔理论在教学中的现实意义,这也是我们喜欢图1的一个原因.按照人类认知过程的讲授方法不但有利于学生逐渐理解并进而把握量子论的基本观点和思维方式,而且有助于学生从物理学发展史的角度理解科学的本质,后者对于学生的终身发展更为重要.
3 小结
原子和原子的结构是实在的客观存在,模型只不过是对它的描述,所以原子是实物,不是模型.到目前为止,人类能画的图,以致一般人的形象思维所能设想的,都是经典的,因此想要用经典的方法画出非经典的、由现代微观理论描述的原子结构图是不可能的.但是这不能说明原子不是实物,也不能说明原子结构不是客观存在的事实,在微观世界中,客观存在实物并不一定就非得要有个实实在在的“模样”.
现代的电子显微镜可以“看见”原子,比如晶体中原子如何分布、C60[2]分子中60个碳原子如何排成一个“足球”,等等,因此我们想现在可以把原子的整体看成类似于小球.至于原子结构,现在没有“直观”或“形象”的描述方法,当然,这并不表示不可能有更好的描述方法,因为卢瑟福说得特别对:科学不但有今天还有明天!
1 曾谨言.量子物理学百年回顾[J].物理,2003:10-24.
2 M Arndt,O Nairz,J Voss-Andreae,C Keller,G van der Zouw & A Zeilinger.Wave-particle duality of C60 molecules[J].Nature,1999:401,680-682.

