濒海战创伤动物模型腹腔感染细菌学特点及药敏试验研究
王代勇,徐先锋,唐玉娟,王 瑜,王 烈,张再重
濒海战创伤动物模型腹腔感染细菌学特点及药敏试验研究
王代勇,徐先锋,唐玉娟,王 瑜,王 烈,张再重
目的探讨濒海实地海水中动物模型腹部火器伤后腹腔感染的细菌学特点及其药敏试验研究。方法将小型猪分为海水中腹部火器伤组(n=8)和陆地腹部火器伤组(n=8)。海水中腹部火器伤组浸泡于海水中,在距离10 m处步枪射击左麦氏点处,继续浸泡30 min,陆地腹部火器伤组固定于陆地支架上,相同方法射击后于陆地观察30 min;之后两组行剖腹探查术,术中取腹腔液5 ml行细菌检测。细菌鉴定分析仪进行细菌学鉴定,抗菌药物敏感试验使用K-B 纸片琼脂扩散法。同时采集8份海水进行细菌鉴定。结果两组共同检测出表皮葡萄球菌、奇异变形杆菌、大肠埃希菌等内源性肠道菌群,其中海水中腹部火器伤组检测出特有的副溶血弧菌(4%)、溶藻弧菌(8%)。细菌药敏实验结果显示,对革兰阴性菌敏感率大于70%的抗菌药物包括亚胺培南、阿莫西林/克拉维酸、替卡西林/克拉维酸妥布霉素等。对革兰阳性菌敏感率大于70%的抗菌药物包括环丙沙星、达托霉素、呋喃妥因等。结论濒海实地海水中腹部火器伤后腹腔感染为内源性肠道菌群、皮肤表面菌群和海水中特有弧菌的混合感染,故提倡早期联合使用广谱抗生素控制感染。
濒海实地;腹部;火器伤;细菌;药敏试验
火器伤伤后感染是现代战争战伤救治中迫切需要解决的问题之一。海水中火器伤后伤口细菌的繁殖速度明显快于地面火器伤,感染时间提前[1]。目前,关于濒海实地腹部火器伤腹腔感染的研究未见报道,本研究从模拟濒海实战环境下以巴马小型猪海水腹部火器伤为模型,观察濒海腹部火器伤后机体腹腔感染的主要细菌种类,为海战伤抗感染治疗提供借鉴。
1 材料与方法
1.1 材料 选择16只成年健康雄性巴马小型猪,平均体重约为18 kg,由南京军区福州总医院比较医学科提供,实验动物许可证编号:SCXK(沪) 2010-0028。按随机数表法将小型猪随机分为2组:(1)海水中腹部火器伤组8只;(2)陆地腹部火器伤组8只。
1.2 实验地点及条件 实验地点为福建宁德三都海域。该海域海水理化指标为:pH=8.1,比重为1.05~1.06,渗透浓度为717.0 mmol/L,Na+为320.0 mmol/L,Cl-为383.0 mmol/L,K+为8.3 mmol/L。实验时海面平均温度为29.5℃(8月份),海水平均温度为26℃,空气湿度为80%~90%。
1.3 动物模型的制备 实验前12 h禁食。麻醉采用3%戊巴比妥钠(30 mg/kg)。麻醉后小型猪以45°仰卧位将四肢固定于支架上,完全暴露腹部,于左麦氏点做标记点。A组:将固定于支架上的小型猪置于海水中,浸泡平面达剑突,专业射手距离10 m处用国产81-1式突击步枪(7.62 mm,7.91 g,750 m/s)射击标记点,射击后在海水中浸泡30 min后打捞出水;B组:将固定于支架上的小型猪置于陆地,同样方法射击后观察30 min。
1.4 剖腹探查及样本采集 小型猪建模成功后,送至手术室,腹部常规消毒、铺巾,行剖腹探查,术中用5 ml无菌注射器取腹腔液,即刻常温送检,用L形棒分别在巧克力平板、血平板和麦康凯平板表面涂布均匀,放置片刻待稍干燥,倒置放入37℃孵箱,孵育18~24 h后观察结果。
海水采集选择福建宁德三都海域距岸100 m处4个采集点,以灭菌培养瓶在海水表面下20 m处采集海水样本250 ml,每处2份,共8份。
1.5 细菌培养与鉴定 (1)增菌培养基:嗜盐菌增菌液、碱性蛋白胨水、营养肉汤(BIOMERIEUX 公司产品)。(2)分离培养基:TCBS平板、巧克力平板、血平板和麦康凯平板( BIOMERIEUX 公司产品)。(3)细菌鉴定分析仪:MicroScan WalkWay96(SIEMENS公司),GNI和GPI鉴定卡(SIEMENS公司)。(4)细菌鉴定:取分离平板菌落涂片染色,根据染色结果,进行细菌鉴定药敏分析检测。(5)药物敏感实验:取标本接种在适当的培养基上,于37 ℃培养;同时将分别沾有一定量各种抗生素的纸片贴在培养基表面,培养24 h后观察结果。
1.6 样本处理
1.6.1 处理海水样本 (1)海水90 ml中加入嗜盐菌增菌液10 ml,35 ℃培养18~24 h。取表面培养物接种于TCBS平板,观察菌落,根据菌落特征,按照弧菌科进行鉴定。(2)海水90 ml无菌培养瓶中加入浓缩碱性胨水10 ml,35 ℃培养6~8 h。取表面培养物接种于TCBS平板,35 ℃培养18~24 h,观察菌落,根据菌落特征,按照弧菌科进行鉴定。(3)海水90 ml中加入营养肉汤10 ml,35 ℃培养18~24 h。取培养物接种于巧克力平板、血平板和麦康凯平板,观察菌落,根据菌落特征,按照肠杆菌科、非发酵菌及革兰染色阳性菌进行鉴定。
1.6.2 腹腔液样本处理 术中用5 ml无菌注射器取腹腔液,即刻常温送检,用L形棒分别在TCBS平板、巧克力平板、血平板和麦康凯平板表面涂布均匀, 35℃培养18~24 h,观察菌落,根据菌落特征,按照弧菌科、肠杆菌科、非发酵菌及革兰染色阳性菌进行细菌鉴定分析。
1.7 细菌药敏实验 细菌药敏实验采用 K-B 纸片琼脂扩散法。革兰阴性菌药敏实验抗菌药物18种:阿莫西林/克拉维酸、替卡西林/克拉维酸、左旋氧氟沙星、头孢他啶、头孢噻肟、头孢西丁、头孢唑啉、环丙沙星、头孢吡肟、头孢呋辛、厄他培南、庆大霉素、亚胺培南、哌拉西林/他唑巴坦、复方新诺明、四环素、妥布霉素、阿米卡星。革兰阳性球菌药敏实验抗菌药物 15种:阿莫西林/克拉维酸、头孢曲松、环丙沙星、达托霉素、红霉素、呋喃妥因、庆大霉素、左旋氧氟沙星、利奈唑胺、莫西沙星、苯唑西林、青霉素、利福平、万古霉素、氨苄西林/舒巴坦、复方新诺明。
1.8 统计学处理 采用 SPSS 19.0统计软件进行数据分析,计量资料采用表示,计数资料采用构成比表示,结果采用描述性分析。
2 结 果
2.1 致伤情况 海水腹部火器伤组动物伤道均呈贯通伤,伤道入口与弹径基本相似,面积约0.8 cm×1 cm,表现为入口边缘整齐;伤道出口面积大于入口面积,约3 cm×4 cm,伤道出口周围皮肤形状不规则断裂,呈星状或锯齿状,伤道周围组织红肿;腹腔可见血性腹水,少量泥沙及腹腔损伤脏器水肿。陆地腹部火器伤组伤道出口周围组织较濒海腹部火器伤组颜色鲜红,腹腔损伤脏器水肿较濒海腹部火器伤组轻,未见泥沙存在。
2.2 动物死亡情况 海水腹部火器伤组总共死亡4只,死亡时间为(45.0±10.8) min,其中建模后至抢救前死亡2只,死亡时间分别为35、40 min,抢救过程中死亡2只,死亡时间分别为45、60 min,抢救后存活4只。陆地腹部火器伤组总共死亡3只,死亡时间为(64.3±19.1)min,其中建模后至抢救前死亡1只,死亡时间为43 min,抢救过程中死亡2只,死亡时间分别为70、80 min,抢救后存活5只。
2.3 培养细菌鉴定 海水细菌检测其中弧菌科细菌21株(63.6%),肠杆菌科细菌6株(18.2%),革兰阳性球菌4株(12.1%),其他2株(6.1%)。海水腹部火器伤组细菌检出率:革兰阴性杆菌70.0%,革兰阳性球菌26.0%,其他4.0%;细菌感染率从低到高:副溶血性弧菌<人葡萄球菌人亚种、孔氏葡萄球菌科氏亚种、肺炎克雷伯菌、假结核耶尔森菌、溶藻弧菌<表皮葡萄球菌<奇异变形杆菌<大肠埃希菌;陆地腹部火器伤组细菌检出率:革兰阴性杆菌60.0%,革兰阳性球菌33.0%,其他7.0%;细菌感染率从低到高:假结核耶尔森菌<孔氏葡萄球菌科<肺炎克雷伯菌、人葡萄球菌人亚种<表皮葡萄球菌<奇异变形杆菌<大肠埃希菌(表1)。
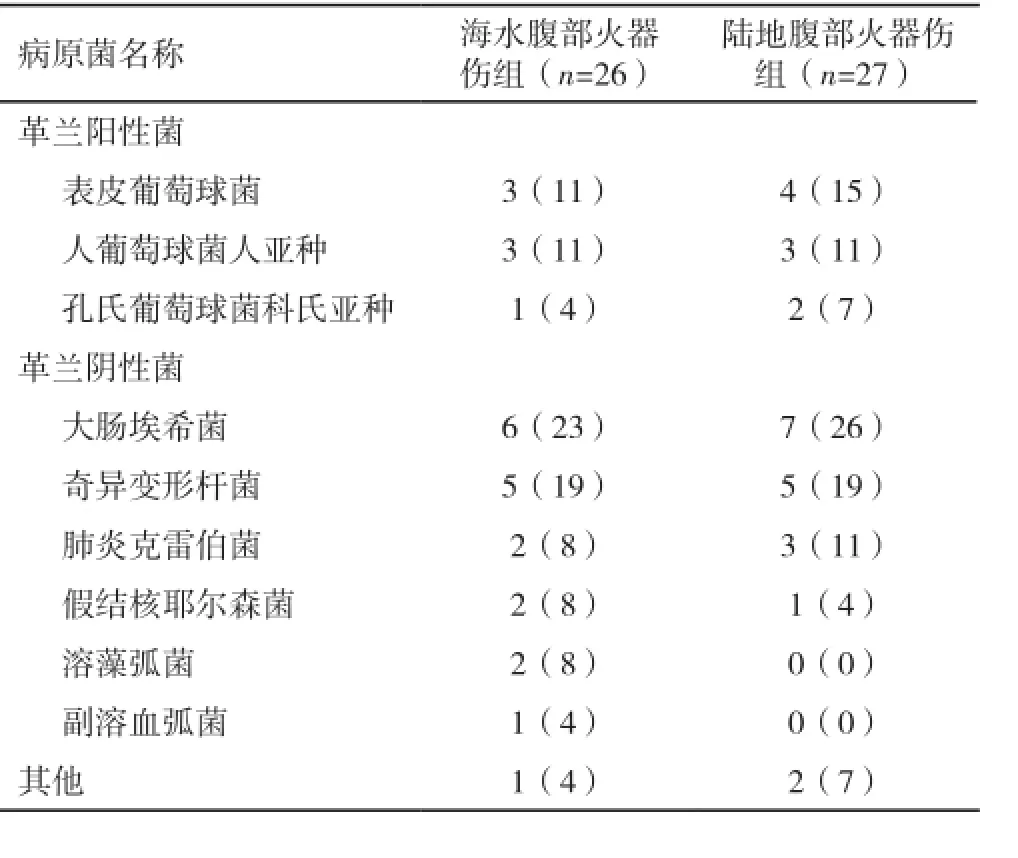
表1 海水腹部火器伤组与陆地腹部火器伤组细菌构成(株;%)
2.4 致伤动物感染细菌药敏实验情况 对革兰阴性菌敏感率大于70%的抗菌药物包括厄他培南、亚胺培南、阿莫西林/克拉维酸、替卡西林/克拉维酸、哌拉西林/他唑巴坦、妥布霉素、阿米卡星、庆大霉素、左旋氧氟沙星、头孢西丁。对革兰阴性菌敏感率小于70%的抗菌药物包括头孢他啶、头孢噻肟、头孢唑啉、环丙沙星、头孢吡肟、头孢呋辛、复方新诺明、四环素。
对革兰阳性菌敏感率大于70%的抗生素包括呋喃妥因、庆大霉素、左旋氧氟沙星、利奈唑胺、莫西沙星、利福平、万古霉素。对革兰阳性菌敏感率小于70%的抗菌药物包括头孢曲松、红霉素、苯唑西林、青霉素、氨苄西林/舒巴坦、复方新诺明。
3 讨 论
抗生素的大量应用导致战创伤合并耐药菌感染的不断出现,进而给卫勤保障工作带来巨大压力[1]。
海水中火器伤的含义为实验动物首先海水浸泡,随后火器伤,最后弹道组织内因瞬时空腔效应的负压吸引作用而带有海水及皮毛中的细菌,造成带菌海水对伤口和伤道的污染。大量坏死组织为细菌的生长提供了良好的培养基,而且震荡区肌组织的继发性损伤和坏死因海水浸泡而加重,因此海水中火器伤后伤口细菌的繁殖速度、感染时间明显快于地面火器伤[2]。目前关于濒海实地腹部火器伤腹腔感染的研究未见报道。本实验发现濒海腹部火器伤组腹腔感染细菌种类主要为内源性肠道菌群(如大肠埃希菌、奇异变形杆菌)和皮肤表面菌群(如表皮葡萄球菌),还存在海水中特有菌群(如副溶血弧菌),而陆地腹部火器伤组未检出海水特有菌群。
濒海腹部火器伤组合并海水浸泡后,肠屏障功能受到严重损害,导致肠道内大量细菌和内毒素向肠外组织迁移,导致释放大量炎性反应介质,肠黏膜细胞通透性增加,细菌进入肠壁组织、肠系膜淋巴结、门静脉及其他远隔脏器,造成全身感染,此外,多种细菌造成感染时限提前感染程度加重原因是动物腹部火器伤合并海水浸泡引起的[3-7]。同时,濒海腹部火器伤组与陆地腹部火器伤组感染途径也不完全相同,陆地腹部火器伤组细菌感染主要通过弹丸瞬时空腔效应的负压吸引将皮肤表面细菌带入伤道及腹腔,子弹损伤肠管导致内源性肠道菌群的腹腔感染;而濒海腹部火器伤组细菌感染因海水中的细菌随着弹丸瞬时空腔效应的负压吸引进入重要脏腔,伤后早期的全身感染随腹腔对海水的吸入而加重。多种细菌造成的混合感染致使感染概率及程度明显加重,因此濒海腹部火器伤的治疗更为困难[8-10]。
经验性地联合选用广谱抗生素如β-内酰胺类抗生素联合氨基糖苷类药物在早期濒海腹部火器伤十分重要,感染严重时可选用抗菌谱更广的抗生素如亚胺培南等,在条件允许的情况下,可以采集标本做细菌培养和药物敏感性试验,治疗及用药选择时根据药敏结果及时调整用药方案。如果口服或肌肉注射达不到有效的浓度且吸收缓慢时,可以选择其他多途径用药治疗,如全身用药应静脉注射,局部采用庆大霉素对伤道、腹腔冲洗,此方法具有高浓度、高效、副作用小的优点,且具有抗弧菌作用。此外,还可在抗感染的基础上,加强对腹腔的冲洗引流,及时清除坏死组织,保护肠黏膜屏障,改善微循环,防止组织继发性损伤。通过联合应用抗生素、保护肠黏膜屏障、改善微循环等措施对濒海腹部火器伤进行综合治疗具有至关重要的意义,且在处理海水浸泡伤时,应尽早、合理使用抗生素[11,12]。
[1]徐锡明,魏显招,李 明,等. 战创伤合并多重耐药菌感染研究进展[J]. 第一军医大学学报,2014,35(3): 312-316.
[2]Fackler M L. Gunshot wound review [J]. Ann Emerg Med, 1996, 28(2): 194-203.
[3]黄 宏,王正国,周 萍,等. 海水浸泡伤道骨骼肌组织的超微结构变化[J]. 创伤外科杂志,2001, 3(3): 200-203.
[4]王志伟,吴印爱,刘献棠,等. 腹腔海水浸泡对大鼠肠粘膜屏障功能的影响[J]. 中华航海医学与高气压医学杂志,2003,10(3): 129-132.
[5]宁浩勇,孟宇宏,王大鹏,等. 创伤合并海水浸泡后愈合过程延迟的因素分析[J]. 转化医学杂志, 2013,2(5): 272-274.
[6]孟 辉,申 洪,卜海激,等. 海水中肢体火器伤伤后伤道细菌种类分析[J]. 西北国防医学杂志,2007,28(2): 98-100.
[7]李 欣,孙 涛. 外伤时肠功能障碍的发生机制和防治的研究进展[J]. 海军总医院学报,2009,22(3): 162-166.
[8]韦 兴,侯树勋. 海水浸泡火器伤的特点与救治原则[J]. 解放军预防医学杂志,2003,21(1): 76-78.
[9]赵 灵,唐三元,高树梓,等. 严重开放性多发伤合并海水浸泡伤的早期救治[J]. 中华急诊医学杂志,2007,16(7): 760-762.
[10]宁浩勇,孟宇宏,刘 肖,等. 火器伤合并海水浸泡后的愈合过程观察[J]. 中国医药导刊,2015,17(1): 86-88.
[11]任雅瑾,张贞良,张柳瑛,等. 抗弧菌抗生素在海水浸泡严重创伤中的应用[J]. 华南国防医学杂志,2013,27(7): 471-473.
[12]张文华,周 松,张行健,等.乌司他丁联合血必净可抑制海水浸泡腹腔开放伤兔的炎症反应[J]. 中医临床研究,2014,6(27): 471-473.
(2015-06-24 收稿 2015-09-02 修回)
(责任编辑 罗发菊)
Experimental study on the characteristics of bacteriology and drug sensitivity test of naval warfare injury animal model with abdominal infection
WANG Daiyong, XU Xianfeng, TANG Yujuan, WANG Yu, WANG Lie, and ZHANG Zaizhong. Department of General Surgery, Fuzhou General Hospital, Nanjing Military Region, Chinese People’s Liberation Army, Fuzhou 350025, China
Corresponding author: ZHANG Zaizhong, E-mail: fzptwk@163.com
ObjectiveTo investigate the bacteriological characteristics and drug sensitivity test for abdominal infection of animal model after abdominal firearm injury in littoral seawater.MethodsMini-pigs were randomly divided into two groups, the group of abdominal firearm injury in littoral seawater(n=8) and the group on land (n=8).The pigs of abdominal firearm injury in littoral seawater group were soaked in sea water, and were shot from a distance of 10 m, hitting the left mcburney point, finally immersed into seawater for 30 min. Pigs in another group were fixed on fixator on land and were shot in the same way, finally observed on land for 30 min. The animals in two groups underwent exploratory laparotomy. 5 ml peritoneal fluid was taken by disposable sterilized syringe for bacterial and antimicrobial susceptibility analysis. Bacteriology analyzer was applied in bacteria identification and K-B paper agar diffusion method was used in antibacterial drug sensitive test. Meanwhile 8 samples of littoral seawater were collected and cultured to identify bacterial species.ResultsBoth two groups were detected to have epidermis staphylococcus, singular proteus, E.coli and other endogenous gut bacterial flora, and abdominal firearm injury in littoral seawater group was particularly detected to carry with vibrio parahaemolyticus (4%), vibrio alginolyticus (8%). The results of drug susceptibility test showed that antimicrobial drugs, including imipenem, amoxicillin/clavulanic acid, ticarcillin amoxicillin/clavulanate clavulanic acid tobramycin, etc., of which the gram-negative bacteria sensitive rate was more than 70%, and antimicrobial drugs including ciprofloxacin, dato mold element, nitrofurantoin, etc., of which gram-positive bacteria sensitive rate was more than 70%.ConclusionsAbdominal infection after abdominal firearm injury in littoral seawater is caused by the mixed infection for endogenous gut bacteria, flora on the skin surface and unique vibrio in seawater, therefore early joint use of broad-spectrum antibiotics is advocated to control infection.
littoral field; abdominal; firearm injury; bacterial; antimicrobial susceptibility test
R826.1
10.13919/j.issn.2095-6274.2015.10.003
南京军区医学科技创新项目(13ZX29);南京军区医学科技创新项目(14ZX25)
王代勇,硕士,医师,E-mail:825836002@qq.com
350025,南京军区福州总医院普通外科
张再重,E-mail: fzptwk@163.com

