两种玻璃化冷冻方法在大鼠卵巢组织冷冻中的应用效果观察
李冬秀,耿杨柳,吴小华,于晓惠,张 敏,徐清华,许鹏宇
两种玻璃化冷冻方法在大鼠卵巢组织冷冻中的应用效果观察
李冬秀,耿杨柳,吴小华,于晓惠,张敏,徐清华,许鹏宇

[摘要]目的比较直接覆盖玻璃化冷冻(direct cover vitrification, DCV)及常规玻璃化冷冻(conventional vitrification, CV)在大鼠卵巢组织冷冻中的应用效果。方法将雌性Wistar大鼠30只随机分为A、B、C组,每组10只,切除大鼠双侧卵巢组织。A组为对照组,B组和C组分别应用CV和DCV冻存2周。复苏后观察3组卵泡的形态,并用末端脱氧核酰转移酶介导的脱氧尿苷三磷酸标记实验(TUNEL)检测各组卵泡的凋亡率。结果A组各级卵泡形态正常;B组卵泡形状不规则,卵母细胞核固缩;C组较大的窦状卵泡损伤。除C组原始卵泡外,B组和C组形态正常的各级卵泡比例均低于A组(P<0.05);C组形态正常的各级卵泡比例高于B组(P<0.05)。B、C组卵泡凋亡率高于A组,且C组低于B组(P<0.01)。结论DCV较CV卵巢组织效果更好,可以有效保存卵巢组织中的原始卵泡。
[关键词]卵巢;玻璃化作用;低温保存;大鼠,Wistar
随着恶性肿瘤诊断技术的提高,女性恶性肿瘤患病率呈逐年年轻化趋势,肿瘤治疗后患者的生育力及内分泌功能丧失[1],放、化疗后有近30%的患者因卵巢功能破坏而丧失生育能力[2]。另外,伴随现代社会女性对事业和自身价值的追求及观念的改变,越来越多的健康女性要求推迟生育年龄、保存生育能力,这些社会因素也给医学界提出了新的挑战。von Wolff等[3]的调查发现,在德国,有此需求的女性逐年增加,到2013年出现了迅猛增长趋势。与胚胎和卵母细胞冷冻相比,卵巢组织冷冻兼具保存生育能力和内分泌功能的优势,已成为人类生殖医学和生殖工程研究的热点。2004年Donnez等[4]通过腹腔镜手术将冻存的卵巢组织自体原位移植成功,并使患者成功分娩,这一成果更加激发了后续研究者们的热情。卵巢组织冷冻目前还没有达成共识的方案,世界范围内通过卵巢组织冷冻方法出生的婴儿也仅有20余例,卵巢组织冷冻移植的成功率及妊娠率仍较低[5],亟待完善冷冻和移植方案。卵巢组织冷冻从慢速程序化冷冻到玻璃化冷冻均有成功案例,而玻璃化冷冻以其独有的优势越来越趋于占主导地位。Chen等[6]对传统的玻璃化冷冻方案进行了改良,首次报道了直接覆盖玻璃化冷冻法(direct cover vitrification, DCV),通过使小鼠卵巢组织与液氮直接接触进行冷冻保存,降温速率可达15 000℃/min,冷冻效果优于传统玻璃化冷冻。本研究拟比较常规玻璃化冷冻(conventional vitrification, CV)及DCV对大鼠卵巢组织的冻存效果,以期为更有效地保存人类卵巢组织提供实验依据。
1材料与方法
1.1实验动物及分组性成熟雌性Wistar大鼠30只(购自河北医科大学动物研究中心),8~10周龄,体重200~220 g,随机分为A、B、C组,每组10只。A组(对照组):取新鲜的大鼠卵巢组织进行后续研究;B组(CV组):用CV法冷冻大鼠卵巢组织,冻存2周后复苏进行后续研究;C组(DCV组):用DCV法将大鼠卵巢组织冷冻,余同B组。本研究经解放军白求恩国际和平医院伦理委员会批准,于该院动物实验中心进行,该中心达到SPF条件。对动物处置符合科学技术部2006年《关于善待实验动物的指导性意见》的要求。
1.2实验方法
1.2.1标本采集:每日对大鼠进行阴道涂片,通过观察阴道脱落细胞类型推测动情周期,于大鼠动情期时取材。给予1%戊巴比妥钠50 mg/kg腹腔注射麻醉,手术部位脱毛,完整切除大鼠双侧卵巢,用生理盐水冲洗干净,皮质切为2 mm×2 mm×4 mm小块,所有操作在冰盒上进行。A组卵巢组织皮质切片直接甲醛固定;B、C组卵巢组织分别用CV和DCV法冷冻。
1.2.2玻璃化冷冻过程
1.2.2.1B组:将卵巢组织块浸入平衡液[7.5%乙二醇(v/v)+7.5%二甲基亚砜(v/v)+0.5 mol/L蔗糖+DPBS]中,渗透平衡15 min,再移入冷冻液[15%乙二醇(v/v)+15%二甲基亚砜(v/v)+0.5 mol/L蔗糖+DPBS]中,继续渗透平衡5 min。轻柔夹取小块卵巢组织,置于1.8 ml的无菌冷冻管中,封盖,投入液氮罐中储存。
1.2.2.2C组:渗透平衡同B组,将卵巢组织放入无菌冷冻管中后,迅速浸入装有无保存组织的液氮容器中,使之灌满液氮,覆盖卵巢组织后,盖好冷冻管,投入液氮罐中储存2周。
1.2.3复苏过程:液氮保存2周后,取出冷冻管,37℃水浴中30 s,将卵巢组织块依次移入解冻液a、b、c(分别为0.5、0.25、0.125 mol/L蔗糖+基础液)中各5 min,再用含20%胎牛血清的DMEM冲洗卵巢组织2次,甲醛固定。
1.3观察指标
1.3.1组织学观察:石蜡包埋卵巢组织皮质块,5 μm连续切片,HE染色。光学显微镜下观察卵泡的形态、计数正常和异常形态的卵泡个数,并计算形态正常卵泡的百分比。形态正常的各级卵泡百分比=形态正常的各级卵泡个数/各级卵泡总个数×100%。为避免重复计数,卵泡计数以卵母细胞核为标记。各级卵泡形态的判定参照Gougeon[7]创建的标准。
1.3.2冻融卵巢组织凋亡情况:采用末端脱氧核酰转移酶介导的脱氧尿苷三磷酸标记实验(TUNEL)观察新鲜、冻融后卵巢组织中卵母细胞DNA损伤情况。TUNEL试剂盒购自美国Roche公司,实验按说明书进行。判定标准:阳性细胞定位于卵母细胞及颗粒细胞核,呈棕黄色。卵母细胞核呈阳性或>50%的颗粒细胞为阳性,认为该卵泡凋亡。卵泡凋亡率=卵泡凋亡数/总卵泡数×100%。
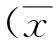
2结果
2.1组织形态学A组:新鲜卵巢组织间质细胞排列紧密规律,间质细胞将各级卵泡紧密地包裹在卵巢皮质内。各级卵泡形态正常,呈圆形或椭圆形,排列整齐、呈多层排列,基底膜完整,卵母细胞和颗粒细胞均未见核浓缩。B组:卵巢组织间质细胞分离明显,卵泡形状不规则,卵母细胞核固缩。C组:部分间质细胞相互分离,原始卵泡形态保存较好,次级及窦状卵泡可见损伤,颗粒细胞与基底膜部分分离,排列欠整齐。见图1。除C组原始卵泡外,B组和C组形态正常的各级卵泡比例均低于A组(P<0.05);C组形态正常的各级卵泡比例高于B组(P<0.05)。见表1。
2.2细胞凋亡A、B、C组卵泡凋亡率分别为(8.54±1.17)%、(40.31±3.87)%、(18.28±2.48)%,3组两两比较差异有统计学意义(P<0.01)。3组卵巢组织卵泡凋亡情况见图2。
3讨论
卵巢组织冷冻兼具保存女性生育力和内分泌功能的独特优势。卵母细胞冷冻和胚胎冷冻只适用于生育力保存,不能同时保留内分泌功能,适应人群局限,对未成年人及未婚女性来说无法实现,卵巢组织冷冻几乎是青春期前女性保存生育力的最佳选择。而卵巢组织冷冻移植既可以保存生育力,还兼具恢复女性内分泌功能,不需要长时间的促排卵治疗,是需要尽快治疗的肿瘤患者的理想选择,而且,有些雌激素依赖性肿瘤,病情本身不允许长时间促排卵治疗[8],以免加剧肿瘤的进展。卵巢皮质中含有大量的原始卵泡及初级卵泡,这些未成熟的卵泡体积较小、未分化,无透明带及颗粒细胞,代谢活动更少,更能耐受冻融保存[9]。
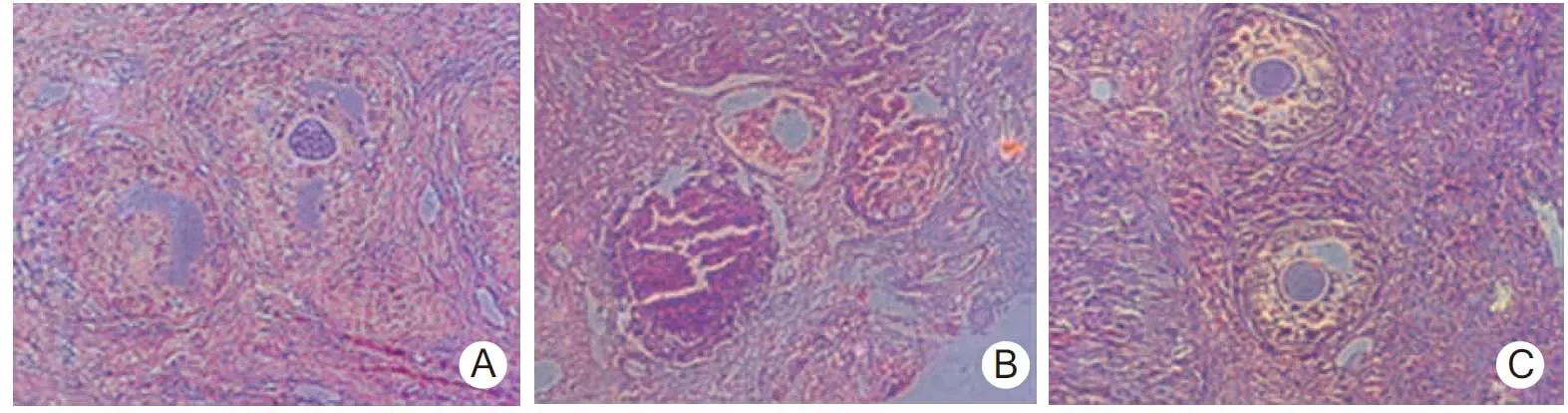

图1 3组大鼠卵泡情况(HE×200)

图2 3组卵巢组织卵泡凋亡情况

±s,%)
注:A组为对照组,B组为常规玻璃化冷冻组,C组为直接覆盖玻璃化冷冻组;与A组同级卵泡比较,aP<0.05;与B组同级卵泡比较,cP<0.05
目前,全世界已有100多个生殖中心得到伦理委员会的支持,开展了卵巢组织冷冻这项技术[10]。常用的卵巢组织冷冻方法有慢速程序化冷冻和玻璃化冷冻,程序化冷冻对卵巢组织基质和血管内皮均有损伤,但是也能保存卵泡[11]。与其相比,玻璃化冷冻技术能快速使组织及细胞形成“玻璃化”,避免冰晶形成,从而更好地保护各种细胞[12]。玻璃化冷冻方法在卵巢组织冷冻中的应用可以更好保存卵泡活力,卵巢组织基质和血管内皮损伤均小于程序化冷冻[13]。DCV在对卵泡形态的保存方面明显优于CV,而且副损伤小于CV,这与其他报道是一致的[14]。本研究结果显示,卵巢组织冻融后,次级卵泡和窦状卵泡损伤率较高,而原始卵泡和初级卵泡损伤轻微,提示在冷冻及复苏过程中体积越大的卵泡越不耐受冷冻,易发生副损伤。分析原因可能与较大的卵泡脱水不充分、代谢率偏高、含有较多颗粒细胞有关,而小的卵泡体积较小、未分化、代谢率低,周围缺乏透明带及颗粒细胞包裹,利于冷冻保护剂的渗透,因此小卵泡冷冻效果优于大卵泡[15]。
大部分的原始卵泡及初级卵泡通过细胞凋亡逐渐走向闭锁,并未发育为成熟卵泡,所以细胞凋亡是卵泡闭锁的主要途径[16]。女性的卵巢组织中99.9%的卵泡都以凋亡的形式闭锁[17]。本研究发现,新鲜大鼠卵巢组织中卵泡的凋亡率为(8.54±1.17)%,低于Depalo等[18]和Rimin等[19]的报道,分析原因可能为细胞凋亡是一个瞬间的事件,而本研究所采用的TUNEL方法可能只能检测出部分凋亡的细胞,或者卵泡在细胞凋亡之外还有其他的丢失途径;取卵巢组织时所处的月经周期不同也会影响细胞凋亡,本实验于大鼠动情期取标本,此期卵泡的凋亡率较黄体期少[20]。有学者研究发现,经冻融后的卵巢组织中卵泡的凋亡率高于新鲜卵巢组织,说明冻融过程可诱发卵巢组织中卵泡凋亡的发生[19]。而Demirci等[21]发现卵巢组织冻融过程并不增加卵泡的凋亡。在本研究中,经CV冷冻后卵泡的凋亡率较DCV高,说明改良的DCV可能是通过增加降温速率,减少了卵泡的损伤,提高了冷冻效率,更适合于卵巢组织的冷冻保存。
[参考文献]
[1]俞黎铭,金杭美.恶性肿瘤治疗中卵巢冷冻和移植[J].中国实用妇科与产科杂志,2013,29(5):350-353.
[2]Meirow D, Nugent D. The effects of radiotherapy and chemotherapy on female reproduction[J].Hum Reprod Update, 2001,7(6):535-543.
[3]von Wolff M, Germeyer A, Nawroth F. Fertility preservation for non-medical reasons: controversial, but increasingly common[J].Dtsch Arztebl Int, 2015,112(3):27-32.
[4]Donnez J, Dolmans M M, Demylle D,etal. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue[J].Lancet, 2004,364(9443):1405-1410.
[5]Donnez J, Dolmans M M, Pellicer A,etal. Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue: a review of 60 cases of reimplantation[J].Fertil Steril, 2013,99(6):1503-1513.
[6]Chen S U, Chien C L, Wu M Y,etal. Novel direct cover vitrification for cryopreservation of ovarian tissues increases follicle viability and pregnancy capability in mice[J].Hum Reprod, 2006,21(11):2794-2800.
[7]Gougeon A. Dynamics of follicular growth in the human: a model from preliminary results[J].Hum Reprod, 1986,1(2):81-87.
[8]Loren A W, Mangu P B, Beck L N,etal. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update[J].J Clin Oncol, 2013,31(19):2500-2510.
[9]Kim S S. Fertility preservation in female cancer patients: current developments and future directions[J].Fertil Steril, 2006,85(1):1-11.
[10]Resetkova N, Hayashi M, Kolp L A,etal. Fertility Preservation for Prepubertal Girls: Update and Current Challenges[J].Curr Obstet Gynecol Rep, 2013,2(4):218-225.
[11]Schmidt K L, Byskov A G, Nyboe Andersen A,etal. Density and distribution of primordial follicles in single pieces of cortex from 21 patients and in individual pieces of cortex from three entire human ovaries[J].Hum Reprod, 2003,18(6):1158-1164.
[12]Amorim C A, David A, Dolmans M M,etal. Impact of freezing and thawing of human ovarian tissue on follicular growth after long-term xenotransplantation[J].J Assist Reprod Genet, 2011,28(12):1157-1165.
[13]Silber S, Kagawa N, Kuwayama M,etal. Duration of fertility after fresh and frozen ovary transplantation[J].Fertil Steril, 2010,94(6):2191-2196.
[14]Zhou X H, Wu Y J, Shi J,etal. Cryopreservation of human ovarian tissue: comparison of novel direct cover vitrification and conventional vitrification[J].Cryobiology, 2010,60(2):101-105.
[15]Kim S S, Battaglia D E, Soules M R. The future of human ovarian cryopreservation and transplantation: fertility and beyond[J].Fertil Steril, 2001,75(6):1049-1056.
[16]Tilly J L, Kowalski K I, Johnson A L,etal. Involvement of apoptosis in ovarian follicular atresia and postovulatory regression[J].Endocrinology, 1991,129(5):2799-2801.
[17]Vaskivuo T E, Tapanainen J S. Apoptosis in the human ovary[J].Reprod Biomed Online, 2003,6(1):24-35.
[18]Depalo R, Nappi L, Loverro G,etal. Evidence of apoptosis in human primordial and primary follicles[J].Hum Reprod, 2003,18(12):2678-2682.
[19]Rimin E, Cohen T, Amsterdama A,etal. Apoptosis in cryopreserved ovarian tissue-a tool of evaluation cryopreservation utility[J].Fertil Steril, 2003,80(3):149.
[20]Xu M, Fazleabas A T, Shikanov A,etal. In vit ro oocyte maturation and preantral follicle culture from the luteal-phase baboon ovary produce mature oocytes[J].Biol Reprod, 2011,84(4):689-697.
[21]Demirci B, Salle B, Frappart L,etal. Morphological alterations and DNA fragmentation in oocytes from primordial and primary follicles after freezing-thawing of ovarian cortex in sheep[J].Fertil Steril, 2002,77(3):595-600.
(收稿时间:2015-02-11修回时间:2015-03-17)
论著·
Comparison of Effects of Two Kinds of Vitrification Methods in Freezing Ovarian Tissues in Rats
LI Dong-xiu, GENG Yang-liu, WU Xiao-hua, YU Xiao-hui, ZHANG Min, XU Qing-hua, XU Peng-yu (Center of Reproductive Medicine Center, Bethune International Peace Hospital of PLA, Shijiazhuang 050082, China)
[Abstract]ObjectiveTo compare the effects of direct cover vitrification (DCV) and conventional vitrification (CV) in freezing ovarian tissues in rats. MethodsA total of 30 mature female Wistar rats were randomly divided into group A, B and C (n=10 for each group), and bilateral ovarian tissues of all rats were cut off. Group A was the control group; group B and C were respectively freezed using CV or DCV method for 2 weeks. After thawed, in the three groups, the follicular appearances were observed, and follicular apoptosis rates were detected using TUNEL (terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling) method. ResultsThe appearances of each grade were normal in group A; the follicular appearances were irregular and oocyte karyopyknosis was found in group B; the bigger sinusoid ovarian follicles were damaged in group C. The normal rates of follicular appearances in all grades of group B and C were significantly lower than those in group A except for that of primordial follicles in group C (P<0.05); the normal ratios of follicular appearances in all grades of group B were significantly higher than those in group B (P<0.05). The follicular apoptosis rates in group B and C were significantly higher than that in group A, and the rate in group C was significantly lower than that in group B (P<0.01). ConclusionPrimordial follicles in the ovarian tissues can be better preserved by DCV than by CV.
[Key words]Ovary; Vitrification; Cryopreservation; Rats, Wistar
[DOI]10.3969/j.issn.2095-140X.2015.05.003
[文献标志码][中国图书资料分类号]R715;R-332A
[文章编号]2095-140X(2015)05-0009-04
[通讯作者]吴小华,E-mail:xiaohuawu65@sohu.com
[基金项目][作者单位]050082 石家庄,解放军白求恩国际和平医院妇产科生殖医学中心

