超声引导下射频消融术联合靶向治疗对晚期肝细胞癌患者免疫功能的影响
陈旭兰,付靖楠,李 颖,屈 波
超声引导下射频消融术联合靶向治疗对晚期肝细胞癌患者免疫功能的影响
陈旭兰,付靖楠*,李颖,屈波

*共同第一作者
[摘要]目的探讨超声引导下射频消融术(RFA)联合靶向治疗对晚期肝细胞癌患者免疫功能的影响。方法将2011年3月—2014年7月收治的晚期肝细胞癌90例随机分为观察组和对照组,每组45例。观察组入院后行超声引导下经皮腹腔穿刺RFA 1周后给予吉非替尼联合卡培他滨靶向治疗,对照组给予基础治疗1周行靶向治疗。治疗前、后均测定两组免疫细胞及体液免疫功能。结果观察组治疗后4周血清CD3、CD4、CD4/CD8、CD3+CD56+NK和血清IgG、IgM、IgA浓度均较治疗前和对照组升高,CD8较治疗前和对照组降低(P<0.05),对照组治疗后4周CD3、CD4、CD4/CD8、CD3+CD56+NK和血清IgG、IgM、IgA浓度较治疗前降低,CD8较治疗前升高(P<0.05)。结论晚期肝细胞癌患者行超声引导下RFA联合靶向治疗能很好地改善免疫功能。
[关键词]癌,肝细胞;超声引导;导管消融术;靶向治疗;免疫功能
超声是一种使用简单方便、无创、价格低廉、无放射性的影像学检查手段,广泛应用于临床辅助性诊断与治疗中。超声引导下行射频消融术(radiofrequency ablation, RFA)治疗中晚期肺癌、肝癌已在临床广泛开展,且取得了很好的治疗效果[1-4]。目前超声引导下经腹腔穿刺RFA具有创面小、并发症少等优点,临床用于治疗病灶体积较小、转移灶较少、复发性及失去手术切除机会的肝癌患者的治疗[5]。靶向治疗是近年来针对恶性肿瘤所采用的一种治疗手段,临床已取得较好效果,但仍不能很好地控制肿瘤的发展与转移[6],因此需要探寻一种新的治疗方案。近年来研究表明,RFA不但可以直接杀死肿瘤细胞、毁坏肿瘤组织、防止肿瘤细胞转移外,还可以提高机体对肿瘤的免疫功能[7],但是目前国内外尚无针对超声引导下治疗中晚期肝细胞癌的研究报道。2011年3月—2014年7月我院采用超声引导下经皮腹腔穿刺RFA联合药物靶向治疗晚期肝细胞癌45例,取得了较好疗效,现报告如下。
1资料与方法
1.1纳入和排除标准
1.1.1纳入标准:①经病理结合医技检查(典型的影像学表现以及甲胎蛋白≥500 ng/ml)诊断为肝细胞癌;②患者本人及家属同意后参与且经医院医学伦理委员会批准;③接受靶向治疗时间≥3个月;肝功能Child-pluge分级为A级;④至少有1个可以测量的肿瘤且直径≥1 cm;⑤主要器官无严重功能衰竭;⑥中性粒细胞≥1.5×109/L,血红蛋白≥90 g/L(14 d内无输血史),血小板≥80×109/L。
1.1.2排除标准:①KPS评分<70分;②合并严重心脑血管疾病、糖尿病、甲状腺功能亢进等代谢及内分泌系统疾病患者;③混合细胞性肝癌;④合并其他恶性肿瘤;⑤腹部CT检查结果提示腹腔内有大量积液;⑥治疗前1个月内有外伤史及大手术史;⑦出现中枢神经系统的广泛性转移;⑧影像学(CT/MRI)检查结果显示有重要血管及其周围神经的侵蚀且因血管侵蚀而出现出血;⑨病灶直径>6 cm;⑩既往有烟酒等不良嗜好。
1.2临床资料本组90例,男49例,女41例;年龄32~73岁;体重指数23~26 kg/m2。均经肝脏穿刺病理组织学证实为晚期(ⅢB~Ⅳ期)肝细胞癌,且经CT平扫显示病灶直径≤6 cm,肝内转移灶较少。按随机数字表法分为观察组和对照组,每组45例。两组性别、年龄、体重指数、病情等方面比较差异无统计学意义(P>0.05),具有可比性。见表1。
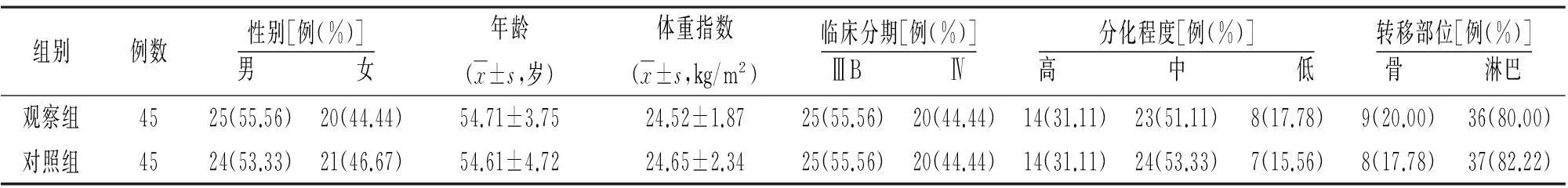
表1 两组晚期肝细胞癌患者一般资料
注:对照组给予靶向治疗,观察组给予射频消融联合靶向治疗
1.3方法
1.3.1药物及试剂:吉非替尼片(英国阿斯利康制药有限公司,规格:250 mg/片,批号:H301173);卡培他滨(瑞士罗氏制药有限公司,规格:500 mg/片,批号:H0292);淋巴细胞分离液为天津TBD生物技术公司产品;CD3、CD4、CD8细胞检测采用IgGrl-FITC/IgGr2a-PE、CD3-FITC/CD4-PE、CD3-FITC/CD8-PE、FacA Lysing Solution溶血素为美国BD公司产品,IgG、IgM、IgA体液免疫指标检测采用美国BD公司提供的TriTEST CD3-PE/CD4双色荧光试剂盒。
1.3.2仪器:LOGQ3型三维彩超仪为美国GE公司产品,探头频率为3.00~6.00 MHz;CT引导装置为SIEMENS SOMATOMSensation 16排螺旋CT;RFA-Ⅱ多极射频消融仪为北京博莱德光电技术开发有限公司提供(微电极展开后直径2.0~4.0 cm); AxSYM型全自动免疫发光分度仪为美国雅培公司产品;Calibur型流式细胞仪为美国BD公司产品;AWED-432A型超低温冰箱由日本三洋公司提供。
1.3.3治疗方法:观察组入院后即开始行RFA治疗,术前禁食水,肌内注射盐酸哌替啶25 mg、盐酸异丙嗪25 mg,平卧后行彩超检查,根据彩超显示的图像选取最佳穿刺点及穿刺角度(必要时配以CT),常规消毒后铺孔巾,用利多卡因在穿刺点处局部浸润麻醉,将RFA多导电极穿刺到肿瘤部位,根据肿瘤的体积打开电极,每次消融采用90~100℃,持续时间根据肿瘤大小决定,一般为10~15 min,根据肿瘤体积及数量决定射频消融的次数(直径≤15 mm,消融1次;直径>15 mm者,可以反复多次进针消融,但总次数应≤5次),退针时需要电凝止血,RFA 1周后给予靶向治疗。对照组给予基础治疗1周后行靶向治疗。
1.3.4靶向治疗方案:两组均于入院1周后开始口服靶向治疗药物,吉非替尼250 mg/d(治疗过程中剂量不做调整),连续服用12周,出现以下情况需要终止或暂停口服:①急性消化道出血;②严重肝功能衰竭;③高血压(Ⅲ级以上);④反复蛋白尿(>2 g/d)。卡培他滨按照0.7 g/m2,2/d,d1~14,3周为1个疗程,连续服用4个疗程,在治疗过程中出现以下情况需要降低剂量20%:①第1次出现血液毒性(Ⅲ级);②第2次出现非血液毒性(Ⅱ级)或者任何时候出现非血液毒性(Ⅲ级)。出现以下情况需要降低剂量40%:①第1次出现血液毒性(Ⅳ级);②第2次出现血液毒性(Ⅲ级);③任何时候出现非血液毒性(Ⅳ级);④第2次出现非血液毒性(Ⅲ级)或者第3次出现非血液毒性(Ⅱ级)。出现以下情况应终止服用:①第2次出现血液毒性(Ⅳ级);②第3次出现血液毒性(Ⅲ级);③第4次出现非血液毒性(Ⅱ级);④第3次出现非血液毒性或者第2次出现非血液毒性(Ⅳ级)。
1.4检测指标
1.4.1外周血细胞免疫指标检测:治疗前及治疗后4周抽取静脉血,用淋巴细胞分离液密度梯度离心法分离外周血中有核细胞,外周血中有核细胞染色标记30 min,溶血10 min,以3000 r/min离心10 min,弃去上清液,PBS液冲洗2次,随后上机检测,并采用Cellquest软件进行样本检测。
1.4.2体液免疫指标检测:治疗前及治疗后4周抽取静脉血5 ml,注入玻璃试管中,静置10 min,以3000 r/min离心10 min,分离血清在-70℃超低温冰箱内保存待测,用免疫散射比浊法检测免疫球蛋白(IgG、IgM、IgA),操作过程严格按照试剂盒说明进行。

2结果
2.1细胞免疫指标观察组治疗后4周血清CD3、CD4、CD4/CD8与CD3+CD56+NK较治疗前和对照组升高,CD8较治疗前和对照组降低(P<0.05),对照组治疗后4周CD3、CD4、CD4/CD8与CD3+CD56+NK较治疗前降低,CD8较治疗前升高(P<0.05),见表2。

±s)
注:对照组给予靶向治疗,观察组给予射频消融联合靶向治疗;与同组治疗前比较,aP<0.05;与对照组治疗后4周比较,cP<0.05
2.2体液免疫指标观察组治疗后4周血清IgG、IgM、IgA浓度较治疗前和对照组升高(P<0.05),对照组治疗后4周血清IgG、IgM、IgA浓度较治疗前降低(P<0.05),见表3。

±s,g/L)
注:对照组给予靶向治疗,观察组给予射频消融联合靶向治疗;与治疗前比较,aP<0.05;与对照组比较,cP<0.05
3讨论
肝细胞癌是全球常见的消化系统恶性肿瘤[8-10],在消化系统恶性肿瘤中发病率仅次于胃癌,2007年美国癌症协会公布的研究数据显示:全球新发肝癌711 000例,病死率居所有恶性肿瘤的第3位,新发病例中发展中国家占80%以上,我国占55%以上[11]。近年来针对晚期肝细胞癌的治疗仍局限于手术、放疗和化疗,但是这3种方法均不能很好地控制肿瘤细胞的转移,而晚期肝细胞癌一旦确诊后生存期为2~4个月,且这3种方法存在毒性作用应大、患者耐受性差等缺点[12]。
RFA治疗是利用频率在400~460 kHz范围内的电磁波作用于肿瘤组织内部而杀死肿瘤细胞的方法,早在1990年,就已经将RFA用于肝脏局部热损伤的动物实验模型[13-14]。2000年由美国学者Dupuy等[15]在国际首次报道,治疗时通过彩超或CT引导下的射频电极针经皮穿刺进入肿瘤组织内,电极针发出的射频电磁波可引起肿瘤细胞内的极性分子发生震荡,震动过程中分子间相互摩擦产生大量热能,使肿瘤组织内部温度为90~110℃,高温导致细胞内蛋白质的变性与DNA断裂,同时高热还能导致肿瘤周围肝组织血管发生凝固闭合,可以有效防止出血与肿瘤细胞转移。而周围正常肝组织血流丰富,热量很容易随着血液散发,使能量易于集聚,瘤体内部坏死彻底,进而避免周围正常组织的损伤[16-19]。
吉非替尼是一种表皮生长因子受体(epidermal growth factor receptor, EGFR)抑制剂[20],近年来使用最广泛,应用于肺癌、肝细胞癌等的治疗。在肝细胞癌的治疗中,吉非替尼能阻断细胞周期的G1/S期,抑制肿瘤细胞增生,但是针对31例原发性晚期肝细胞癌患者单独使用吉非替尼治疗的二期临床试验结果显示,症状无明显缓解,因此需要配合其他化疗药物使用,与其他化疗药物配合使用导致的毒性作用增多,耐受性较差,导致机体免疫力降低[21-22],而近年来研究表明,RFA治疗肝细胞癌能使患者的免疫功能得到很好的改善[7],Dromi等[23]研究表明,经RFA治疗后的小鼠,瘤体内可出现大量抗原提呈细胞的浸润,增强了抗肿瘤免疫力。机体抗肿瘤主要通过细胞和体液免疫两种方式进行,而细胞免疫是T淋巴细胞及CD3+CD56+NK细胞参与的一种重要免疫反应,而恶性肿瘤患者往往免疫功能受到严重的抑制,且经放化疗、手术创伤均能加重免疫抑制,表现为外周血中CD3、CD4、CD3+CD56+NK减少,这些均参与机体特异性细胞免疫反应,抑制淋巴细胞亚群CD8增多,CD4/CD8比例降低[24]。B细胞是机体内参与体液免疫的一种重要淋巴细胞,其水平高低与血清抗体水平密切相关,银杏叶提取物能很好地提高机体血清抗体浓度,IgG、IgM是人体内重要的免疫球蛋白,在体液免疫过程中发挥重要作用[25]。本研究结果显示,观察组治疗后4周血清CD3、CD4、CD3+CD56+NK、CD4/CD8与IgG、IgM、IgA浓度较治疗前升高,CD8较治疗前降低,与朱玲燕等[26]研究结果相同,而对照组治疗后4周血清CD3、CD4、CD3+CD56+NK、CD4/CD8与IgG、IgM、IgA浓度较治疗前降低,CD8较治疗前升高。提示靶向药物联合传统化疗药物能导致患者机体免疫力降低[12]。治疗后观察组血清CD3、CD4、CD4/CD8、IgG、IgM、IgA浓度明显高于对照组,CD8较对照组低。提示靶向治疗联合经超声引导下RFA能很好地纠正因靶向药物治疗导致的机体免疫力低下。
RFA穿刺治疗晚期肝细胞癌转移灶较少,治疗过程中的注意事项及临床经验为:①需要严格把握适用人群。本研究入选的病例均为彩超检查示瘤体血供丰富,CT平扫结果显示肿瘤转移灶较少,且单个瘤体直径≤6 cm,因为病灶太大,射频消融不彻底易导致周围血管闭合不完全,坏死的血管易导致大出血,目前的临床经验提示对于直径<3 cm、病灶数目<3个的肝细胞癌RFA治疗效果已经得到了充分肯定,直径较大的病灶需要反复穿刺,而反复穿刺又易导致肿瘤细胞的转移[27]。②肝脏血供丰富,含有大血管,结构复杂,因此必要时需要配合CT甚至MRI检查定位。李凯等[28]研究通过CT、MRI,甚至血管造影术对超声显示困难的肝细胞癌进行辅助性检查。③肝功能Child-pluge分级为B或C级的患者不建议行RFA治疗。因RFA前需要肝脏有较强的储备力。黄伍奎等[14]证实,RFA后5 d肝转氨酶水平升高,说明RFA对肝脏有一定破坏性,因此不建议肝功能较差者应用。④RFA治疗前后可以皮下注射白介素-2(IL-2)。有研究报道,RFA联合IL-2在小鼠模型实验中能很好地抑制肿瘤细胞生长[29]。
综上所述,RFA联合靶向治疗方案能很好地改善转移灶较少的中晚期肝细胞癌患者的免疫功能,缓解靶向治疗或传统化疗导致的免疫力降低,操作简单安全,但其联合免疫细胞静脉滴注对中晚期肝细胞癌患者免疫功能的影响还需在今后进一步探索。
[参考文献]
[1]刘丽莉,方勇,王凯峰,等.CT引导射频消融治疗膈顶部肝癌的临床研究[J].肿瘤,2014,25(1): 4-10.
[2]李凯,刘波,曾庆劲,等.实时虚拟导航系统在肝细胞肝癌患者射频消融治疗中的应用价值[J].中华肝脏外科手术学电子杂志,2012,1(1):19-23.
[3]张军,刘会春,周磊,等.原发性肝癌的射频治疗效果分析[J].肝胆外科杂志,2011,19(1):30-33.
[4]郭放,刘永叶,郑振东,等.超声引导下射频消融治疗原发性肝癌36例[J].解放军医药杂志,2014,26(4):68-70.
[5]Bruix J, Sherman M. Asherman Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update[J].Hepatology, 2011,53(3):1020-1022.
[6]Chakravarti A, Wang M, Robins H I,etal. RTOG 0211: a phase 1/2 study of radiation therapy with concurrent gefitinib for newly diagnosed glioblastoma patients[J].Int J Radiat Oncol Biol Phys, 2013,85(5):1206-1211.
[7]扈彩霞,郑加生,钱智玲,等.原发性肝癌患者射频消融前后外周血T淋巴细胞绝对值变化的临床意义[J].北京医学,2011,33(6):451-453.
[8]王康康,肖兴国.肝细胞癌中Survivin、Livin蛋白的表达及其临床意义[J].中国当代医药,2013,20(10):58-59.
[9]唐大平,林如景,王学健,等.索拉非尼治疗中晚期肝细胞癌疗效及血清甲胎蛋白水平变化意义分析[J].疑难病杂志,2014,13(5):451-455.
[10]王书长,黄万里,黄书立,等.肝动脉化疗栓塞结合射频消融治疗中晚期肝癌的临床疗效分析[J].中国医药科学,2015,5(4):7-9,37.
[11]Garcia M, Jemal A, Ward E M,etal. Global cancer facts & figures 2007. American Cancer Society[EB/OL].(2010-07-31)(2014-08-02).http://www.Cancer.org.
[12]Hsu C, Shen Y C, Cheng C C,etal. Geographic difference in survival outcome for advanced hepatocellular carcinoma: implications on future clinical trial design[J].Contemp Clin Trials, 2010,31(1):55-61.
[13]赵峰,鄂亚军.经导管动脉化疗栓塞联合射频消融治疗原发性肝癌临床观察[J].解放军医药杂志,2014,26(8):60-63.
[14]黄伍奎,由丽娜,帕哈尔丁·白克热,等.肝癌多点射频消融术后肝功能和并发症的研究[J].中国全科医学,2012,15(9):3121-3124.
[15]Dupuy D E, Zaqoria R J, Akerley W,etal. Percutaneous radiofrequency ablation of malignancies in the lung[J].AJR Am roentqenol, 2000,174(1):57-59.
[16] Mizukoshi E, Nakamoto Y, Arai K,etal. Enhancement of tumor-specific T-cell responses by transcatheter arterial embolization with dendritic cell infusion for hepatocellular carcinoma[J].Int J Cancer, 2010,126(9):2164-2174.
[17]曾江正,郝新宝,张建辉,等.冷循环射频消融治疗中晚期肝癌的近期疗效评价[J].海南医学院学报,2010,16(12):1618-1620.
[18]范瑞芳,柴福录,李荣梓,等.腹腔镜射频消融治疗原发性肝癌的研究[J].西北国防医学杂志,2009,30(3):171-173.
[19]范瑞芳,张超,肖毅,等.射频消融辅助肝切除治疗原发性肝癌的研究[J].西北国防医学杂志,2012,33(6):621-623.
[20]Mok T, Wu Y L, Zhang L,etal. A small step towards personalized medicine for non-small-cell lung cancer[J].Discov Med, 2009,8(43):227-231.
[21]O'Dwyer P, Giantonio B, Levy D,etal. Gefinatinib in advanced unreasectable hepatocellular carcinoma: results from the Eastern Cooperative Oncology Group Study E1203[J].J Clin Oncol, 2006,24(18s):4143.
[22]王晓明,赵超尘,岑钧华,等.吉非替尼联合卡培他滨治疗晚期肝细胞癌的疗效观察[J].中国现代医生,2012,50(10):60-61.
[23]Dromi S A, Walsh M P, Herby S,etal. Radiofrequency ablation induces antigen-presenting cell infiltration and amplification of weak tumor-induced immunity[J].Radiology, 2009,251(1):58-66.
[24]谢天鹏,赵雍凡,刘华英,等.早期肠内营养对食管癌术后全身炎性反应及细胞免疫功能的影响[J].四川医学,2005,26(1):18-20.
[25]李晓辉,李军民,冯秋霞,等.围手术期肠内营养支持对食管癌患者术后免疫功能的影响[J].中国医学创新,2011,8(8):57-59.
[26]朱玲燕,庞雄昊,周嘉,等.小肝癌患者外周免疫状态变化及手术、射频消融治疗的影响[J].山东医药,2012,52(42):1-3.
[27]Kobayashi M, Ikeda K, Kawamura Y,etal. Randomized controlled trial for the efficacy of hepatic arteria occlusion during radiofrequency ablation for small hepatocellular carcinoma-direct ablative effects and a long-term outcome[J].Liver Int, 2007,27(3):353-359.
[28]李凯,曾庆劲,郑荣琴,等.导航引导和导航超声造影辅助消融超声显示困难肝癌[J].中山大学学报:医学科学版,2012,33(4):549-552.
[29]Fagnoni F F, Zerbini A, Pelosi G,etal. Combination of radiofrequency ablation and immunotherapy [J].Front Biosci, 2008,13(2):369-381.
(收稿时间:2014-12-28修回时间:2015-02-28)
·论著·
Effect of Radiofrequency Ablation Combined with Targeted Therapy under Ultrasound Guide on Immune Function of Patients with Advance Hepatocellular Carcinoma
CHEN Xu-lan1a, FU Jing-nan2b, LI Ying2, QU Bo1c(a. Department of Special Inspection, b. Department of Enterochirurgia, c. Department of Surgical Oncology, 1. Affiliated Hospital of Logistics Academy of the Chinese People's Armed Police Force, Tianjin 300162, China; 2. Department of Special Inspection, General Hospital of Tianjin Armed Police Force, Tianjin 300162, China)
[Abstract]ObjectiveTo investigate the effect of radiofrequency ablation (RFA) combined with targeted therapy under ultrasound guide on immune function of patients with advanced hepatocellular carcinoma. MethodsA total of 90 patients with advanced hepatocellular carcinoma during March 2011 and July 2014 were randomly divided into observation group (n=45) and control group (n=45). The observation group was treated with RFA under ultrasound guided for one week, and then targeted therapy of Gefitinib combined with Capecitabine followed; while the control group was treated with targeted therapy following basic therapy. The immune function indications of cells and body fluids were detected in the two groups before and after the treatment. ResultsIn observation group, the concentrations of CD3, CD4, CD4/CD8, CD3+CD56+NK, IgG, IgM and IgA 4 weeks after the treatment were significantly higher, while the CD8 concentration was significantly lower than those before the treatment in the same group and after the treatment in the control group (P<0.05); in the control group, the concentrations of CD3, CD4, CD4/CD8, CD3+CD56+NK, IgG, IgM and IgA 4 weeks after the treatment were significantly lower, while the CD8 concentration was significantly higher than those before the treatment in the same group (P<0.05). ConclusionRadiofrequency ablation combined with targeted therapy under ultrasound guide may significantly improve the immune function of patients with advanced hepatocellular carcinoma.
[Key words]Carcinoma, hepatocellular; Ultrasonic guidance; Catheter ablation; Targeted therapy; Immune function
[DOI]10.3969/j.issn.2095-140X.2015.05.012
[文献标志码][中国图书资料分类号]R735.7A
[文章编号]2095-140X(2015)05-0041-05
[通讯作者]李颖,E-mail: tianjin2009001@163.com
[基金项目][作者单位]300162 天津,武警后勤学院附属医院特检科(陈旭兰),肛肠外科(付靖楠),肿瘤外科(屈波);300162 天津,武警天津市总队医院特检科(李颖)

