甲壳质抗特应性皮炎的实验研究
李秀梅 王国英 张 文 高美华 张 蓓 沈若武 丛蓓蓓
(青岛大学医学院免疫教研室,青岛 266071)
特应性皮炎(Atopic dermatitis,AD)是一种慢性、复发性、炎症性皮肤病,具有家族遗传倾向。AD患者血液中IgE 水平升高,嗜酸性粒细胞增多。临床上表现为皮肤干燥、红斑、丘疹、水疱、渗出,重者可累及全身,常并发感染[1]。
AD 发病率较高,儿童发病率为15%~30%,成人发病率为2%~10%。在过去的30 年里,AD的发病率增长了约3 倍,尤其是在工业化国家,AD的发病率增长更为明显[2]。迄今,临床上没有有效根治AD 的方法,主要应用激素治疗,但长期使用激素会引起较多的副作用。AD 的发病机制目前尚未完全明确,普遍观点认为与Th1/Th2 失衡有关,在AD 的发病过程中,Th2 免疫反应占主导地位,Th1免疫反应下降[3]。众所周知,Th1 和Th2 具有相互抑制作用,因此,如何提高患者Th1 免疫功能从而抑制其Th2 免疫功能,成为寻找预防及治疗AD 新方法的突破点。
甲壳质(Chitin),又称聚乙酰氨基葡萄糖,是一种生物高分子聚合物,广泛存在于无脊椎动物的外壳和菌类的细胞壁中,来源广泛,产量仅次于纤维素,是自然界第二大有机物质。目前,在医用材料上的应用研究非常多[4-7],发现其具有良好的生物相容性、无生物毒性。近期有报道1~10 μmol/L 的甲壳质颗粒具有诱导机体Th1 型免疫反应、抑制Th2型反应的作用[8],在过敏性哮喘及过敏性肠炎的动物模型中,甲壳质具有减轻过敏体征、改善局部病变的作用[9]。过敏性哮喘、过敏性肠炎及AD 同属特应性疾病,甲壳质这种抗过敏作用是否对AD 同样有效,目前国内外尚未见报道。本实验利用小鼠AD 动物模型探讨甲壳质对AD 的形成与发展的影响,为甲壳质用于治疗特应性皮炎提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级6~8 周龄BALB/c 雌鼠,体重(20±2)g,共28 只,购自山东大学实验动物中心。所有动物适应性饲养1 周后进入实验。
1.1.2 试剂及仪器 卵清蛋白(Ovalbumin,A5503,V 级)购自美国Sigma 公司,甲壳质(Chitin)、刀豆蛋白A(ConA)、红细胞裂解液(R1010)、ELISA 试剂盒购自上海索莱宝公司,氢氧化铝[Al(OH)3]购自天津市瑞金特化学品有限公司,胎牛血清购自北京全式金生物技术有限公司(Lot#60416),RPMI1640 购自上海拜力生物科技有限公司HyClone 公司(SH30809.01B)。Olympus BX50 PM-CBAD 显微照相装置,Hitachi 低温离心机,雷杜PT-6100 酶标仪。
1.2 方法
1.2.1 动物模型的建立 小鼠随机分为3 组:对照组(8 只)、模型组(10 只)、甲壳质组(10 只)。三组动物在第0、5 天分别进行腹腔注射,模型组腹腔注射卵清蛋白(OVA)液0.2 ml[含20 μg OVA 和2 mg Al(OH)3],甲壳质组注射OVA 与甲壳质的混合液0.2 ml(含20 μg OVA 和25 μg 甲壳质),正常对照组注射等量生理盐水。从第12 天开始,每天给小鼠进行灌胃直至实验结束,正常对照组和模型组每日灌胃0.2 ml 生理盐水,甲壳质组每日灌胃0.2 ml 甲壳质悬液(3 mg/d)。从第15 天开始,小鼠背部皮肤外用OVA 进行皮肤激发,方法参考文献[10],简述如下:用电动剃须刀将小鼠背部皮肤剃光,将浸有100 μl 0.1%OVA 溶液的1 cm2大小的四层纱布敷在模型组及甲壳质组小鼠背部,外用胶带贴紧,对照组小鼠用浸有生理盐水的纱布外敷。1 周后将纱布取下,中间休息2 周,于第36 天重复皮肤激发1 周,第43 天处死动物(图1),心脏取血,分离血清用于抗体测定。背部激发部位皮肤取材,置于10%福尔马林液中固定。取脾脏进行脾细胞培养。
1.2.2 甲壳质颗粒的制备 将购得的甲壳质粉末放入研钵中研磨,过1250 目不锈钢网筛,得到≤10 μm 的甲壳质小颗粒。将得到的甲壳质小颗粒以10 mg/ml 悬于生理盐水中,5 600 r/min 离心10 min,弃上清,得到1~10 μm 的甲壳质颗粒[11,12]。
1.2.3 皮肤组织的标本制备及病理学观察 小鼠背部取材的皮肤组织用10%福尔马林溶液固定,经酒精梯度脱水、石蜡包埋、连续切片,用苏木精-伊红(HE)染色及甲苯胺蓝染色,在光学显微镜下观察各组小鼠炎症处皮肤的病理变化。比较各组小鼠皮肤表皮层与真皮层的厚度变化,在高倍镜下计数浸润的炎性细胞、嗜酸性粒细胞及肥大细胞的数量和形态变化。
1.2.4 脾细胞培养 无菌条件下取小鼠脾脏,分别将各组小鼠的脾脏混合[13],置于200 目不锈钢滤网,用注射器内芯轻轻碾碎研磨,RPMI1640 培养液冲洗滤过,收集脾细胞悬液[14]。1 000 r/min,离心5 min,弃上清。加RPMI1640 吹打,分散细胞。加入3 倍于RPMI1640 液体量的红细胞裂解液,静置5 min。1 000 r/min,离心5 min,弃上清。用灭菌的PBS 缓冲液冲洗细胞两次,1 000 r/min,离心5 min,弃上清。再次加PBS 缓冲液,取10 μl 进行细胞计数。调整细胞浓度为5~10 ml,1 000 r/min,离心3 min,弃上清。最后加入含10%小牛血清的RPMI1640 培养液(血清5 ml,双抗500 μl,加RPMI1640 定容至50 ml),置于37℃恒温培养箱进行培养。24 h 后加入药物刺激,各组小鼠脾细胞分三个处理组,ConA 刺激组[5 μg/(ml·well)],OVA刺激组[50 μg/(ml·well)],chitin 刺激组[100 μg/(ml·well)],每个处理组设置3 个平行孔进行培养。孵育72 h,1 000 r/min,5 min 离心,收集细胞上清液,置-20℃冰箱保存用于细胞因子检测。

图1 AD 动物模型的建立Fig.1 Establishment of AD murine model
1.2.5 酶联免疫吸附实验 采用ELISA 法检测血清总IgE、总IgG2a、OVA-特异性IgE 水平及脾细胞培养上清液中IL-4、IL-12、IFN-γ 细胞因子的水平。操作步骤按试剂盒说明书进行,在450 nm 波长测定吸光度(OD)值,计算蛋白质浓度。
1.3 统计学方法 采用SPSS17.0 统计分析软件进行数据处理。本实验所有结果均以±s 表示,实验组之间用t 检验进行统计学分析,P<0.05 有统计学意义。
2 结果
2.1 甲壳质减轻AD 小鼠背部皮肤的炎症病理变化 经过腹腔注射OVA 及背部皮肤外用OVA 激发实验,模型组小鼠背部皮肤肉眼观察可见明显红斑、肥厚及脱屑,正常对照组小鼠皮肤未见明显异常,而甲壳质组小鼠背部皮肤增厚较轻。显微镜下观察,对照组小鼠的皮肤结构规则,皮肤厚度正常,真皮层无明显炎症细胞浸润。模型组小鼠表皮及真皮均明显不规则增厚,真皮层纤维组织增多且有大量的炎症细胞浸润。甲壳质组表皮与真皮的增厚程度、炎症细胞的浸润程度均介于对照组与模型组之间(图2)。与模型组比较,甲壳质组小鼠真皮中的炎细胞浸润总数明显减少(图3A),差异显著(P<0.05);嗜酸性粒细胞数量明显减少(图3B)。甲苯胺蓝染色显示,模型组小鼠皮肤全层内肥大细胞数量明显增多,与对照组比较有显著统计学差异(P<0.001),较多肥大细胞胞膜不完整,有脱颗粒现象。甲壳质组小鼠皮肤全层浸润的肥大细胞数量比模型组减少,差异显著(P<0.01)(图4)。

图2 小鼠背部皮肤组织病理学变化(HE 染色,10×10)Fig.2 Pathological changes of mice back skin (HE staining,10×10)
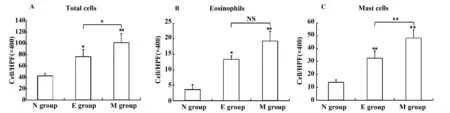
图3 小鼠背部皮肤炎细胞浸润数量Fig.3 Skin infiltration of inflammatory cells

图4 小鼠皮肤组织中肥大细胞的分布(甲苯胺蓝染色,10×10)Fig.4 Distribution of mast cells in mice skin (O-toluidine blue staining,10×10)

图5 小鼠血清中抗体水平Fig.5 Serum levels of antibodies in mice

图6 OVA 刺激脾细胞后培养液中IL-4、IL-12 和IFN-γ 的水平Fig.6 Cytokine levels produced by cultured spleen cells challenged with OVA

图7 甲壳素刺激脾细胞后培养液中IL-12 和IFN-γ 的水平Fig.7 Levels of IL-12 and IFN-γ produced by cultured normal mice splenocyte challenged with chitin
2.2 甲壳质降低了AD 小鼠血清中IgE 水平,提高了IgG2a 水平 为了观察AD 小鼠Th1 型和Th2 型抗体水平的变化,动物模型建成后,取小鼠心脏血液检测血清中IgE 和IgG2a 水平。反复腹腔注射及皮肤外用OVA 刺激后,模型组小鼠血清中总IgE 和OVA 特异性IgE 水平明显升高,与对照组比较有显著性统计学意义(P<0.001)(图5A、B),甲壳质组小鼠血清中总IgE 和OVA 特异性IgE 水平与模型组相比均明显下降,差异有统计学意义(P <0.05,P<0.001)(图5A、B)。另外,甲壳质组小鼠血清总IgG2a 水平明显高于模型组,差异具有统计学意义(P<0.001)(图5C)。
2.3 甲壳质提高脾细胞IFN-γ 水平,降低IL-4 水平 为了检测长期应用甲壳质灌胃能否诱导AD 小鼠产生Th1 型细胞因子,抑制Th2 型细胞因子的产生,在动物模型建成后,取各组小鼠的脾细胞进行体外培养,并在培养液中加OVA 进行刺激,收集培养液上清,用ELISA 法测定IL-4、IL-12 及IFN-γ 蛋白水平。与模型组相比,甲壳质组脾细胞产生的IL-4明显降低(P<0.05),差异有统计学意义。相反,甲壳质组脾细胞产生的IL-12 及IFN-γ 均比模型组高,其中IFN-γ 水平的差异具有统计学意义(P <0.05)(图6)。
在正常对照组小鼠的脾细胞培养体系中分别加入甲壳质和ConA 进行体外刺激,结果显示甲壳质体外刺激组,与ConA 刺激组相比,IL-12 的水平有所增高,但无统计学意义,而IFN-γ 显著增高(P <0.001)(图7)。
3 讨论
特应性皮炎(Atopic dermatitis,AD)因其逐渐上升的高发病率、临床特效疗法的缺乏及部分患者最终发展成过敏性哮喘、过敏性肠炎已引起全球临床医生及科研工作者的重视。AD 患者免疫系统Th1/Th2 失衡,以Th2 型免疫反应为主[3]。众所周知,Th1 与Th2 型免疫反应相互抑制,因此,诱导AD 患者的Th1 型反应从而起到抑制AD 患者Th2 型免疫反应,达到预防及治疗AD 的目的成为此研究领域的一个热门方向,其中,寻找合适的Th1 诱导剂是该领域的关键。本研究利用OVA 诱导的小鼠AD模型,探讨了甲壳质对AD 的调节作用,研究结果证实甲壳质能够诱发AD 小鼠产生Th1 型细胞因子,抑制AD 的Th2 型免疫反应,减轻AD 皮肤炎症,为开发甲壳质的临床应用提供了科学依据。
本实验在Spergel 试验方法的基础上[10],改进了建立AD 动物模型的方法,先行小鼠腹腔注射OVA 致敏小鼠,后在小鼠背部外用OVA 激发小鼠的皮肤过敏反应。动物模型组在OVA 皮肤激发两周后,出现皮肤增厚,真皮内大量炎细胞浸润,包括较多的嗜酸性粒细胞及肥大细胞浸润,血清IgE 显著增高,其组织病理学及血清学改变均符合AD 动物模型的特点[1]。
在利用OVA 进行动物模型建立的同时,给予小鼠甲壳质腹腔注射及长达四周时间的甲壳质灌胃(甲壳质组),发现甲壳质能够减轻AD 小鼠背部皮肤的炎症,改善皮肤的病理组织变化,特别是减少真皮内浸润的嗜酸性粒细胞及肥大细胞的数量,降低血清中IgE 的水平,说明甲壳质具有调节改善AD的作用。
为了进一步探讨甲壳质改善AD 的作用机制,本研究进行了小鼠脾细胞的体外培养,在培养系统中加入甲壳质,结果显示甲壳质能够刺激正常小鼠脾细胞产生IL-12 及INF-γ,这与Strong 等[9]报道的实验结果相符,说明甲壳质在体外能够诱导正常小鼠脾细胞产生Th1 细胞因子。若用OVA 刺激培养的脾细胞,发现甲壳质组小鼠的脾细胞产生的IL-12和IFN-γ 水平明显高于模型组,说明甲壳质在体内能够诱导AD 小鼠脾细胞产生Th1 型细胞因子,这种作用被甲壳质组小鼠产生较高水平的IgG2a 进一步证实。根据Th1 与Th2 型免疫反应相互抑制的原理,甲壳质诱导的Th1 型细胞因子能够抑制OVA 诱导的Th2 型免疫反应,从而降低AD 小鼠的血清IgE水平,减轻局部皮肤的炎症反应。
不同直径大小的甲壳质颗粒在机体中的作用不同,有报道直径>100 μm 的甲壳质颗粒不起作用,直径在40~70 μm 的甲壳质颗粒引起炎症反应,而直径在1~10 μm 的甲壳质颗粒能够调节呼吸系统的炎症反应[8,15]。本研究结果证实了1~10 μm 的甲壳质颗粒对过敏性炎症反应有调节作用。甲壳质在AD 动物模型中的调节作用与以往报道的甲壳质在哮喘动物模型、肠炎动物模型中的作用相似[13,16]。
总之,本实验结果提示甲壳质通过诱导小鼠产生Th1 型细胞因子抑制AD 的Th2 型免疫反应,从而起到缓解AD 皮肤炎症的作用。本实验结果为今后甲壳质应用于临床预防治疗过敏性疾病提供了科学依据。
[1]Wang G,Savinko T,Wolff H,et al.Repeated epicutaneous exposures to ovalbumin progressively induce atopic dermatitis-like skin lesions in mice[J].Clin Exp Allergy,2007,37:151-161.
[2]Boguniewicz M,Leung DYM.Recent insights into atopic dermatitis and implications for management of infectious complications[J].J Allergy Clin Immunol,2011,125(1):4-13.
[3]Carla A,DaSilva,Pierre Pochard,et al.Chitin particles are multifaceted immune adjuvants[J].Am J Respir Crit Care Med,2010,182 (12):1482-1491.
[4]Ding F,Deng H,Du Y,et al.Emerging chitin and chitosan nanofibrous materials for biomedical applications[J].Nanoscale,2014,6(16):9477-9493.
[5]Hatanaka D,Yamamoto K,Kadokawa J.Preparation of chitin nanofiber-reinforced carboxymethyl cellulose films[J].Int J Biol Macromol,2014,69:35-38.
[6]Naseri N,Algan C,Jacobs V,et al.Electrospun chitosan-based nanocomposite mats reinforced with chitin nanocrystals for wound dressing[J].Carbohydr Polym,2014,109:7-15.
[7]Rojas J,Ciro Y,Correa L.Functionality of chitin as a direct compression excipient:an acetaminophen comparative study[J].Carbohydr Polym,2014,103:134-139.
[8]Chun Geun Lee,Carla A Da Silva,Jae-Young Lee,et al.Chitin regulation of immune responses:an old molecule with new roles[J].Curret Opini Immunol,2008,20:684-689.
[9]Strong P,Clark H,Reid K.Intranasal application of chitin microparticles down-regulates symptoms of allergic hypersensitivity to Dermatophagoides pteronyssinus and Aspergillus fumigatus in murine models of allergy[J].Clin Exp Allergy,2002,32 (12):1794-1800.
[10]Spergel JM,Mizoguchi E,Brewer JP,et al.Epicutaneous sensitization with protein antigen induces localized allergic dermatitis and hyperresponsiveness to methacholine after single exposure to aerosolized antigen in mice[J].J Clin Invest,1998,101(8):1614-1622.
[11]Alvarez FJ.The Effect of chitin size,shape,source and purification method on immune recognition[J].Molecules,2014,19:4433-4451.
[12]Yoshimi Shibata,L.Ann Foster,W.JAMES METZGER,et al.Alveolar macrophage priming by intravenous administration of chitin particles,polymers of N-Acetyl-D-Glucosamine,in mice[J].Infect Immunity,1997,65(5):1734-1741.
[13]Yoshimi Shibata,Foster LA,Bradfield JF,et al.Oral administration of chitin down-regulates serum IgE levels and lung eosinophilia in the allergic mouse[J].J Immunol,2000,164:1314-1321.
[14]Min-Jung Bae,Hee Soon Shin,En-Kyoung Kim,et al.Oral administration of chitin and chitosan prevents peanut-induced anaphylaxis in a murine food allergy model[J].Intern J Biological Macromolecules,2013,61:164-168.
[15]Lee CG,Da Silva CA,Dela Cruz CS,et al.Role of chitin and chitinase/chitinase-like proteins in inflammation,tissue remodeling,and injury[J].Annu Rev Physiol,2011,73:479-501.
[16]Katsuya Nagatani,Sen Wang,Victoria Llado,et al.Chitin-microparticles for the control of intestinal inflammation[J].Inflamm Bowel Dis,2012,18(9):1698-1710.