益气养阴方对大鼠肺纤维化的干预作用及对Smad2、Smad7 蛋白的影响①
冯 佳 向 阳 夏 燕 蔡 杰 陈安平 杨年安 龚书识 刘冬梅 袁 林
(湖北民族学院风湿性疾病发生与干预湖北省重点实验室,恩施 445000)
肺纤维化(Pulmonary fibrosis,PF)是由多种原因引起的严重肺间质慢性疾病。主要病理特点表现为早期的弥漫性肺泡炎、间质性肺炎、中性粒细胞等炎性细胞浸润,导致后期的大量成纤维细胞病理性增生和细胞外基质过度沉积,可引起呼吸衰竭,死亡率高达50%~70%[1]。肺纤维化的治疗以糖皮质激素、免疫抑制剂为主,但其疗效不显著,而且长期大剂量服用副作用大。近年来中医药在防治肺纤维化方面做了大量研究,并取得一定的成果,显示了良好的前景[2]。益气养阴方是本院临床上治疗肺纤维化的经验方,临床实践证明其能够较好地改善患者的症状,提高患者的生活质量。本课题组前期已证实益气养阴方能够降低肺间质纤维化大鼠肺组织中TGF-β1 的含量,达到延缓肺纤维化的作用[3]。本实验通过观察益气养阴方对博来霉素所致大鼠肺纤维化的干预作用及对Smad2、Smad7 表达水平的影响,进一步探讨其治疗肺纤维化的作用机制,为益气养阴方的临床应用提供理论依据。
1 材料与方法
1.1.1 动物 健康清洁级雄性SD 大鼠60 只,体重为(230±10)g,购自湖北省动物实验中心,合格证号:SCXK(鄂)2008-0005。
1.1.2 主要试剂 益气养阴方(板党、北沙参、麦冬、五味子、黄芪、石斛、远志、川牛膝、竹节参、金银花等)由湖北民族学院附属民大医院药剂科提供,制备成含生药1 g/ml 的溶剂;博来霉素购自浙江海正药业股份有限公司;醋酸泼尼松片由浙江仙琚制药股份有限公司生产;兔IgG-SABC 免疫组化染色试剂盒、大鼠Smad2 和Smad7 免疫组化一抗、DAB显色试剂盒均购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 实验分组及造模 健康雄性SD 大鼠随机分为正常组、模型组、中药组、激素组、中药+激素组5 组,每组12 只。除正常组外,余组大鼠以10%水合氯醛按3.5 ml/kg 腹腔麻醉,取仰卧位固定,颈部常规消毒,切开颈部皮肤,逐层钝性分离暴露气管,用注射器于环状软骨间刺入气管内,缓慢注入博来霉素(5 mg/kg),注射完毕后立即将大鼠直立并旋转,使药物在肺内均匀分布。正常组大鼠按上述方法经气管注入等量生理盐水。从造模后第2 天开始给药,给药剂量根据成人与动物体重剂量换算而成。中药组给予益气养阴方1 ml/100 g 灌胃;激素组给予35%醋酸泼尼松溶液按1 ml/100 g 体重灌胃;中药+激素组给予中药加激素混合溶液按1 ml/100 g灌胃;正常组和模型组予等量生理盐水灌胃。均每日1 次,连续给药28 d。于实验第28 天处死所有大鼠。完整分离出肺组织,取左肺下叶于10%中性甲醛中固定,常规脱水、石蜡包埋、切片,行HE 染色及免疫组化检测。
1.2.2 肺组织病理学检查 显微镜下观察HE 切片,参照Hubner 等[4]方法确定肺纤维化程度。0级:正常肺;1 级:单个肺泡呈轻微纤维样变厚(肺泡壁厚度小于正常3 倍);2 级:明显肺泡纤维化,伴有小纤维灶形成(肺泡壁厚度大于正常3 倍);3 级:连续的肺泡纤维化区域(肺泡壁厚度大于正常3 倍);4 级:单个的纤维灶(面积小于10%);5 级:纤维灶融合(面积大于10%,且小于50%);6 级:大量连续纤维灶(面积大于50%);7 级:肺结构严重破坏,出现肺大疱;8 级:出现纤维性闭塞,肺组织全部纤维化。参照Szapiel 等[5]方法确定肺泡炎程度.0 级:无明显肺泡炎改变;1 级:轻度肺泡炎,肺泡间隔有少量炎性细胞浸润,病变范围小于全肺20%;2 级:中度肺泡炎,肺泡结构紊乱,肺泡间隔明显增宽,病变范围占全肺的20%~50%;3 级:重度肺泡炎,肺泡融合,大量炎性细胞浸润,胶原纤维沉积,病变范围大于全肺50%。将等级资料转化为计量资料,1级计1 分,每组10 个样本分别评分,求平均值。
1.2.3 肺组织中Smad2、Smad7 表达的检测 石蜡组织切片常规脱蜡水化,3%双氧水灭活内源性酶,然后进行热修复抗原,滴加5%BSA 封闭液封闭,弃血清,分别滴加按1 ∶100 稀释的Smad2 及Smad7 一抗(兔IgG)4℃过夜,滴加生物素化羊抗兔二抗,再滴加SABC 试剂,DAB 显色后,苏木素复染,脱水、透明、中性树胶封片,显微镜下观察。阴性对照用PBS代替一抗。胞浆呈清晰棕黄色为阳性,每张切片随机选取5 个视野,观察阳性表达的定位并用Image-Pro Plus6.0 图像分析系统测定目标区域的平均光密度值(OD 值),作为Smad2、Smad7 蛋白的表达强度。
1.3 统计学分析 数据使用SPSS16.0 统计软件处理,以±s 表示,采用单因素方差分析(ANOVA)进行组间两两比较,LSD 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 益气养阴方对肺纤维化大鼠肺组织病理形态的影响
2.1.1 外观形态观察 正常组大鼠肺外观未见明显异常,表面光滑、色泽粉嫩、质地柔软、富有弹性。模型组大鼠肺颜色暗淡,有散在出血点,表面凹凸不平,局部可见大小不等灰白色结节,部分区域呈苍白色,质地较硬,肺组织弹性差,切面呈弥漫性实变。激素组大鼠肺表面有小片状凹凸不平,呈暗红色,程度较模型组轻,表面光滑,弹性较好;中药组大鼠肺外观与正常组大鼠相近,部分呈暗红色,质地均匀,弹性良好,无实变表现。中药+激素组大鼠肺硬度稍增加,未见明显实变,表面欠光滑,局部有散在小结节,但总体好于激素组。
2.1.2 HE 染色组织病理学观察 光镜下正常组大鼠肺组织结构清晰,肺泡壁完整,肺泡间隔无水肿,无炎性细胞浸润;模型组肺组织结构紊乱,大部分肺泡萎陷、破坏,肺泡间隔增宽并伴有炎性细胞浸润,大量胶原纤维沉积,毛细血管腔明显增厚,部分闭塞;激素组肺泡大小不等,少量肺泡萎陷,间隔有胶原沉积,程度较模型组轻;中药组、中药+激素组大鼠肺泡结构、肺泡间隔厚度及炎细胞浸润较模型组明显减轻,成纤维细胞及胶原沉积减少,其中以中药组大鼠肺组织纤维化程度减轻更为明显所示,见图1。
2.1.3 各组大鼠肺泡炎及肺纤维化程度分级结果模型组大鼠肺泡炎和肺纤维化程度评分明显高于正常组(P<0.01),说明肺组织损伤严重,肺纤维化造模成功;激素组肺组织病理评分较模型组有所减少(P<0.05);中药组、中药+激素组大鼠肺泡炎及肺纤维化程度与模型组相比减轻(P <0.01 或P <0.05),以中药组肺损伤减轻更为明显,见表1。
2.2 益气养阴方对肺纤维化大鼠肺组织Smad2 和Smad7 蛋白表达的影响 正常组Smad2 蛋白未见明显表达;模型组肺泡上皮细胞及成纤维细胞胞浆中Smad2 蛋白高表达,且表达量明显高于正常组(P<0.01);与模型组相比,激素组、中药组、中药+激素组Smad2 阳性表达均减少(P<0.05 或P<0.01),以中药组表达量最低(P<0.01);中药组分别与激素组、中药+激素组相比,Smad2 蛋白表达均具有显著差异(P<0.01);中药+激素组Smad2 蛋白表达较激素组有所减少,但差异无统计学意义(P>0.05)。正常组Smad7 蛋白在肺泡上皮细胞、支气管上皮细胞及间质细胞胞浆中大量表达;模型组Smad7 蛋白较正常组明显减少(P<0.01);与模型组相比,激素组、中药组、中药+激素组Smad7 蛋白表达增强(P <0.05 或P<0.01),以中药组表达量最高(P<0.01);中药组分别与激素组、中药+激素组相比,Smad7 蛋白表达具有统计学差异(P<0.01 或P<0.05),见表2 及图2、3。
表1 各组大鼠肺泡炎及肺纤维化程度分级(±s)Tab.1 Extent of alveolitis and pulmonary fibrosis in rats of different groups(±s)

表1 各组大鼠肺泡炎及肺纤维化程度分级(±s)Tab.1 Extent of alveolitis and pulmonary fibrosis in rats of different groups(±s)
Note:Compared with model group,1)P<0.05,2)P<0.01.
表2 各组大鼠Smad2 和Smad7 蛋白表达平均光密度值(±s)Tab.2 Average optical density of Smad2 and Smad7 protein in rats of different groups(±s)

表2 各组大鼠Smad2 和Smad7 蛋白表达平均光密度值(±s)Tab.2 Average optical density of Smad2 and Smad7 protein in rats of different groups(±s)
Note:Compared with model group,1)P<0.05,2)P<0.01;compared with YQYY group,3)P<0.05,4)P<0.01;compared with hormone group,5)P>0.05.
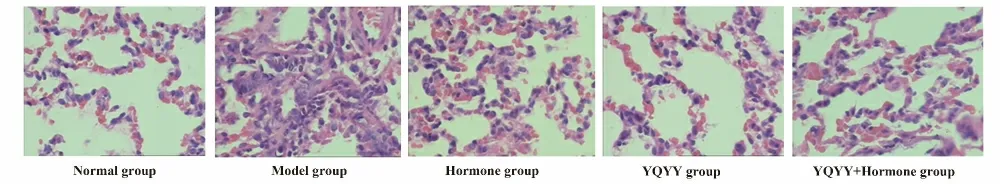
图1 各组大鼠肺组织(HE 染色,×400)Fig.1 Lung tissue of rats in each group (HE staining,×400)

图2 各组大鼠Smad2 蛋白表达(免疫组化染色,×200)Fig.2 Protein expression of Smad2 in each group (immunohistochemical staining,×200)

图3 各组大鼠Smad7 免疫组化染色(免疫组化染色,×200)Fig.3 Protein expression of Smad7 in each group (immunohistochemical staining,×200)
3 讨论
肺纤维化是一种慢性弥漫性肺间质炎症性疾病,以成纤维细胞增生和细胞外基质沉积为其主要病理特征,导致肺组织结构的异常重塑,最终呼吸衰竭而死亡[6]。
自Thrall 等[7]发现向大鼠气管内注入小剂量博来霉素可致大鼠肺间质纤维化,并且其病理过程与人类肺纤维化相似,气管内灌注博来霉素已成为建立肺纤维化动物模型的经典方法。本实验在造模28 天后发现,模型组大鼠肺组织表面凹凸不平,部分区域呈苍白色,质地较硬,并且光镜下观察肺组织结构紊乱,大部分肺泡萎陷、破坏,肺泡间隔增宽并伴有炎性细胞浸润,大量胶原纤维沉积,而且模型组大鼠肺泡炎和肺纤维化程度评分明显高于正常组,说明肺组织损伤严重,提示肺纤维化造模成功。肉眼观察中药组与正常组大鼠肺组织相近,镜下可见肺组织结构大体完整,肺泡炎及肺纤维化程度显著低于模型组。激素组、中药+激素组大鼠肺泡炎及肺纤维化程度与模型组相比有所减轻,但效果不及中药组,表明经益气养阴方治疗后的大鼠肺组织损伤有明显改善,提示该方具有减轻或抑制大鼠肺纤维化的作用。
肺纤维化的发病机制至今仍不明确,涉及多信号通路调控及多因子相互作用。转化生长因子-β(TGF-β)是促进纤维化的主要细胞因子,被公认为与肺纤维化的发生和形成关系最为密切[8]。TGF-β1 促进肺成纤维细胞过度增殖、分化,继而促进胶原蛋白等细胞外基质在肺间质和肺泡间过度积聚,导致肺纤维化的发生与发展[9]。课题组前期证实肺纤维化大鼠肺组织内TGF-β1 含量显著增多,益气养阴方能够降低TGF-β1,减少肺组织成纤维细胞生成,达到缓解肺纤维化的目的。TGF-β/Smad信号通路是参与肺纤维化上皮细胞间质转化的重要转导途径。Smad 是细胞内参与信号转导的蛋白,是TGF-β的下游底物,在肺纤维化信号通路中发挥重要作用[10]。Smad 蛋白分为受体活化型或通路限制性Smad(RSmads)、共同通路型Smad(Co-Smad)和抑制性Smad(ISmads)3 个亚家族,包括9 种Smad 蛋白。Smad2 属于RSmads,其磷酸化激活是Smad 信号通路激活的重要标志之一,磷酸化的Smad2 与Smad4 结合形成复合体,激活胞核内的核转录因子,启动一系列反应,促进纤维化的形成[11]。Smad7 属于I-Smad,是TGF-β 信号转导途径的主要抑制性调控蛋白。研究发现阻断Smad7 内源性表达可抑制肺上皮细胞的发育,增加肺组织羟脯氨酸含量,促进肺组织纤维化程度,提示Smad7 蛋白表达情况与肺纤维化关系密切[12]。采取药物干预Smad 信号转导过程及其关键信号分子表达己成为近年来研究抗肺纤维化的一个热点。本实验通过免疫组织化学染色法检测大鼠肺组织Smad2、Smad7 蛋白表达,发现激素、中药、中药+激素组均能减少Smad2 蛋白表达,以中药组表达量最低;与模型组相比,激素组、中药组、中药+激素组Smad7 蛋白表达增强,以中药组表达量最高。使用激素治疗的目的主要是抑制炎症,但在肺纤维化中后期,肺成纤维细胞过度增殖,肺组织结构异常重塑,激素治疗效果不佳,而且长期使用副作用大,这与本实验的结果也是一致的。说明益气养阴方能有效抑制TGF-β 下游信号转导和调节分子Smad2 的表达,同时促进发挥抑制性调控效应的Smad7表达增加,证实益气养阴方通过影响TGF-β/Smad 信号通路来干预治疗大鼠肺纤维化。
综上,益气养阴方对博来霉素所致大鼠肺纤维化具有干预治疗作用,其机制与抑制炎症反应、减少胶原蛋白的形成和沉积及干预TGF-β/Smad 信号通路有关。
[1]Rachel G,Scheraga,Victor J,et al.Wnt/β-Catenin and transforming growth factor-β signaling in pulmonary fibrosis[J].Ame J Res Cri Care Med,2014,190(2):129-131.
[2]杨 光,宫晓燕,张海洋,等.中药复方抗肺纤维化机制研究[J].吉林中医药,2014,34(4):430-432.
[3]蔡 杰,赵小丹,龚书识,等.中药在实验性肺间质纤维化中的研究进展[J].湖北民族学院学报,2013,30(4):67-69.
[4]Hubner RH,Gitter W,Mokhtari EI,et al.Standardized quantification of pulmonary fibrosis in histological samples[J].Biotechniques,2008,44(4):507-517.
[5]Szapiel SV,Elson NA,Fulmer JD,et al.Bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-899.
[6]刘 青,何振华,张秀峰.PTEN 基因调控信号通路与肺纤维化研究进展[J].现代医药卫生,2014,30(5):690-693.
[7]Thrall RS,Barton RW,D'Amato DA,et al.Differential cellular analysis of bronchoalveolar lavage fluid obtained at various stages during the development of bleomycin-induced pulmonary in the rat[J].Am Rev Respir Dis,1982,126:488-492.
[8]赵 娜,夏光涛,张源潮.成纤维细胞在特发性肺纤维化发病机制及治疗中的研究进展[J].世界临床药物,2013,34(7):439-442.
[9]Park SH.Fine tuning and cross-talking of TGF-beta singal by inhibitory smads[J].J Biochem Mol Biol,2005,38(1):9-16.
[10]Park S,Ahn JY,Lim MJ,et al.IM-412 inhibits transforming growth factor beta-induced fibroblast differentiation in human lung fibroblast cells[J].Biochem Biophys Res Commun,2010,399(2):268-273.
[11]曾仁凤,何振华,张秀峰.上皮细胞间质转化与肺纤维化的研究进展[J].当代医学,2014,20(2):12-13.
[12]徐慧蓉,马小共,王献华.肺纤维化相关细胞因子研究进展[J].现代预防医学,2011,38(10):1953-1964.