少量人外周血体外培养鉴定单核细胞来源树突状细胞方法初探①
陈静思 王 华 罗晓燕 (重庆医科大学附属儿童医院皮肤科,儿童发育疾病研究教育部重点实验室,儿科学重庆市重点实验室,重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆 400014)
树突状细胞(Dendritic cells,DC)是已知的抗原递呈功能最强的细胞,能活化初始T 细胞诱发适应性免疫应答。单核细胞来源的树突状细胞(Monocyte-derived dendritic cells,MoDC)是单核细胞在炎症刺激环境下分化而来的非传统DC,能通过激活T 细胞发挥效应抵抗炎症反应,还可诱导自身免疫反应及免疫耐受,近年来在变态反应性疾病、自身免疫疾病及肿瘤疫苗等研究领域备受关注。传统的从外周血中获得树突状细胞的方法需血量较大,因而其研究受到血量限制,本实验通过改良的密度梯度离心法能从少量人外周血中稳定分离单核细胞并体外诱导培养为成熟MoDC,使研究MoDC 更为高效、便捷。
1 材料与方法
1.1 主要试剂与仪器 Dextran-T500 购自美国Pharmacia 公司;Nycoprep 分离液购自挪威Axisshield 公司;牛血清白蛋白BSA(全组分)购自美国Sigma 公司;胎牛血清、RPMI1640 培养基购自美国Gibco 公司;重组人粒-巨噬细胞集落刺激因子(rhGM-CSF)、重组人白细胞介素4(rhIL-4)、肿瘤坏死因子α(TNF-α)购自美国peprotech 公司;小鼠抗人PE-CD11c、PECy5-CD1a 及同型对照单抗购自美国BD 公司;小鼠抗人FITC-MHCⅡ、CD80、CD83、CD86、CD14 及同型对照单抗购自北京四正柏公司;台盼蓝染液购自北京鼎国昌盛生物技术有限责任公司;丝裂霉素C 购自美国Sigma 公司;CCK-8 试剂盒购自日本同仁化学研究所。8% dextran 液由8g dextran-T500 溶于100 ml 生理盐水配制而成;Washmono 液由5 g BSA 溶于500 ml 含1.7 ml 0.5 mol/L EDTA 液的生理盐水配制而成。Countstar 自动细胞计数仪购自上海睿钰生物科技有限公司;倒置相差显微镜购自日本Olympus 公司;扫描电镜购自日本日立公司;FACSCalibur 流式细胞仪购自美国BD 公司;酶标仪购自美国BioTek 公司。
1.2 实验方法
1.2.1 改良密度梯度离心法分离人外周血单核细胞 取得6 名健康志愿者知情同意后,取EDTA 抗凝外周血10 ml,用改良的密度梯度离心法分离单核细胞,具体步骤如下:①在10 ml EDTA 抗凝外周血中加入2 ml 8%dextran 液沉降红细胞45 min。②取上层血浆缓慢加入装有Nycoprep 液的离心管中(血浆∶Nycoprep=2 ∶1),20℃1 750 r/min 离心20 min。③离心后可见中间白膜层细胞,小心吸出白膜层细胞放入新离心管中,加入10 ml Wash-mono 液,20℃800 r/min 离心15 min。④离心后可见细胞沉淀,弃上清,加入10 ml Wash-mono 液重悬混匀,20℃800 r/min 离心10 min 清洗2 遍。⑤取20 μl 细胞悬液加入20 μl 0.4%台盼蓝染色3 min 后用Countstar自动细胞计数仪计数并测活性率;流式检测CD14表达率。
1.2.2 MoDC 的体外诱导培养 用含10%胎牛血清、100 U/ml 青霉素、100 U/ml 链霉素、50 ng/ml(500 U/ml)rhGM-CSF 和50 ng/ml(500 U/ml)rhIL-4 的RPMI1640 培养基重悬细胞,调整密度为1×106ml-1接种于24 孔板中(1 ml/孔),放入5%CO237℃孵箱培养2 h 后轻轻吸去上清再直接加入新培养基。第2 天半量换液,第4 天收集细胞,取一半细胞检测表型及刺激淋巴细胞增殖能力;剩余一半细胞全量换液并加入10 ng/ml TNF-α 继续培养3 d 刺激细胞成熟。用倒置显微镜观察细胞形态;取培养7 d MoDC 行扫描电镜,具体步骤如下:①将预先用多聚赖氨酸包被的玻片放于24 孔板一孔中,将分离的单核细胞接种于孔中培养。同前述第2 天半量换液,第4 天加入TNF-α 继续培养3 d 刺激细胞成熟。②培养7 d 后将玻片缓慢取出,并收集培养基1 000 r/min 离心5 min,用PBS 液清洗2遍,留少量PBS 液重悬细胞后滴加在玻片上,将玻片在室温静置1 h,使细胞自然沉降附着在玻片上。③用生理盐水轻轻洗涤玻片2 遍;用2.5%戊二醛在4℃固定玻片1 h,PBS 液洗2 遍,每次30 min 以上;再用1%锇酸固定1 h,PBS 液洗2 遍后经30%、50%、70%、80%、90%、100% 乙醇梯度脱水各5 min。④再行酸异戊酯置换,CO2临界点干燥,真空喷镀,最后在扫描电镜下观察并照相。
1.2.3 流式检测MoDC 表型 分别取培养4 d MoDC 和7 d MoDC,PBS 液清洗2 遍后加入1.2 ml PBS 液重悬混匀,取流式试管编号,1 号加入PE 及PECy5 同型对照单抗各20 μl,2~6 号都分别加入PE-CD11c+及PECy5-CD1a+单抗各20 μl 后,2 号再加入FITC 同型对照单抗10 μl,3 号再加入FITCMHCⅡ+单抗10 μl,4 号再加入FITC-CD80+单抗10 μl,5 号再加入FITC-CD83 单抗10 μl,6 号再加入FITC-CD86 单抗10 μl。分别取200 μl 细胞悬液加入流式试管中涡旋后避光静置半小时,PBS 液清洗3 遍后上流式细胞仪检测。
1.2.4 CCK-8 检测MoDC 刺激同种异体淋巴细胞增殖能力
1.2.4.1 分离人外周血淋巴细胞 重庆市血液中心提供手工采集血小板后剩余人外周血60 ml,用ficoll 密度梯度离心法分离淋巴细胞,具体步骤如下:①加入等体积PBS 液稀释。②将稀释血缓慢加入装有Nycoprep 液的离心管中(稀释血:Nycoprep=2 ∶1),20℃2 150 r/min 离心30 min。③小心吸出白膜层细胞放入新离心管中,加入10 ml PBS 液,20℃1 200 r/min 离心10 min。④离心后可见细胞沉淀,弃上清,加入10 ml PBS 液重悬混匀,20℃1 000 r/min 离心5 min 清洗2 遍。⑤用含10%胎牛血清、100 U/ml 青霉素、100 U/ml 链霉素的RPMI1640 培养基重悬细胞接种于75 ml 培养瓶放入5% CO237℃孵箱培养2 h 使单核细胞贴壁。⑥2 h 后取出细胞,直接吸出不贴壁的淋巴细胞放入新培养瓶中继续培养待用。⑦流式检测淋巴细胞百分比并行瑞氏姬姆萨染色鉴定淋巴细胞。
1.2.4.2 CCK-8 检测增殖指数 ①分别取培养4 d MoDC 和7 d MoDC 调整细胞密度为106ml-1,用10 μg/ml 丝裂霉素C 37℃处理4 h 后RPMI1640 培养基清洗2 遍作为刺激细胞。②取淋巴细胞调整细胞密度为106ml-1,在圆底96 孔板中每孔加入5×104个细胞作为反应细胞,再将经丝裂霉素C 处理后的培养4 d MoDC 和7 d MoDC 与淋巴细胞按1 ∶1、1 ∶10、1 ∶50、1 ∶100 比例(终体积为200 μl)共培养5 d,不同比例做3 个复孔,还设立只有淋巴细胞的空白对照孔。③共培养5 d 后每孔加入20 μl CCK-8 液继续孵育4 h 后用酶标仪检测(450 nm)OD 值并计算增殖指数 (Proliferation index,PI),PI=共培养孔OD 值-空白对照孔OD 值/共培养孔OD 值。
1.3 统计学处理 用Flowjo 软件分析流式数据,用SPSS17.0 统计分析软件对数据进行统计分析,符合正态分布的计量资料均使用±s 表示,采用两独立样本t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 MoDC 形态 分离得到单核细胞(1.09±0.21)×107个,活性率为97.98%±0.74%。流式检测表达CD14 的细胞占80%以上(图1)。倒置相差显微镜观察细胞小呈圆形,形态单一,贴壁生长(图2);培养第2 天即可见少量细胞聚集成团,疏松贴壁生长;培养第4 天集落细胞增多,体积增大,悬浮生长;培养第6 天大多数细胞呈集落悬浮生长,形状不规则(图3)。取培养7 d MoDC 做扫描电镜观察:细胞直径14 μm 左右,类圆形,可见表面有典型的毛刺生长(图4)。
2.2 MoDC 表型 培养4 d 的未成熟MoDC 表达CD11c 为88.44%±6.02%,CD11c+CD1a+双阳性为39.53%±14.18%;而经TNF-α 刺激培养7 d 的成熟MoDC 表 达CD11c 为93.58%± 4.93%,CD11c+CD1a+双阳性为76.91%±10.95%(图5)。培养7天成熟CD11c+CD1a+双阳性MoDC 表面MHC Ⅱ、CD80、CD83、CD86 平均荧光强度(Mean fluorescent intensity,MFI)均较培养4 d 未成熟MoDC 升高,MHCⅡMFI 升高约3 倍;CD80、CD83、CD86 MFI 升高约5 倍,具有显著差异(表1)。无论是培养7 d成熟MoDC 还是4 d 未成熟MoDC MHC Ⅱ表达均较协同刺激分子高,协同刺激分子中CD86 表达量最高,CD83 最低。
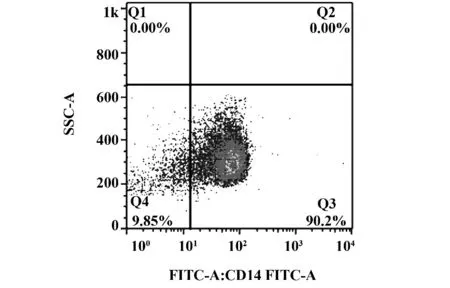
图1 1 例健康志愿者单核细胞流式散点图(Q3:CD14+)Fig.1 Flow cytometry scatter plot of monocytes from a healthy volunteer(Q3:CD14+)

图2 倒置相差显微镜观察分离的人外周血单核细胞(×100)Fig.2 Monocytes from human peripheral blood observed by invert optical microscope (×100)
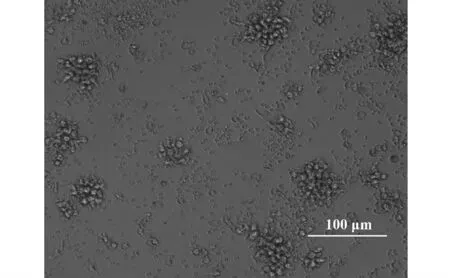
图3 倒置相差显微镜观察培养第6 天的单核细胞来源的树突状细胞(×100)Fig.3 MoDC cultured on 6th day observed by invert optical microscope (×100)

图4 扫描电镜下观察培养第7 天的单核细胞来源的树突状细胞(×2 000)Fig.4 MoDC cultured on 7th day observed by scanning electron microscope (×2 000)
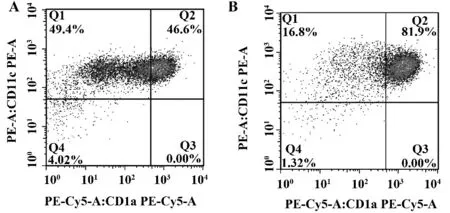
图5 1 例健康志愿者MoDC 流式散点图(Q1+Q2:CD11c+/Q2:CD11c+CD1a+)Fig.5 Flow cytometry scatter plot of MoDC from a healthy volunteer(Q1+Q2:CD11c+/Q2:CD11c+CD1a+)
图7 瑞氏姬姆萨染色的淋巴细胞Fig.7 Lymphocytes were observed in Wright Giemsa staining
表1 未成熟MoDC 与成熟MoDC MHCⅡ、CD80、CD83、CD86 平均荧光强度(±s)Tab.1 Mean fluorescent intensity of MHCⅡ,CD80,CD83,CD86 on immature MoDC and mature MoDC(±s)
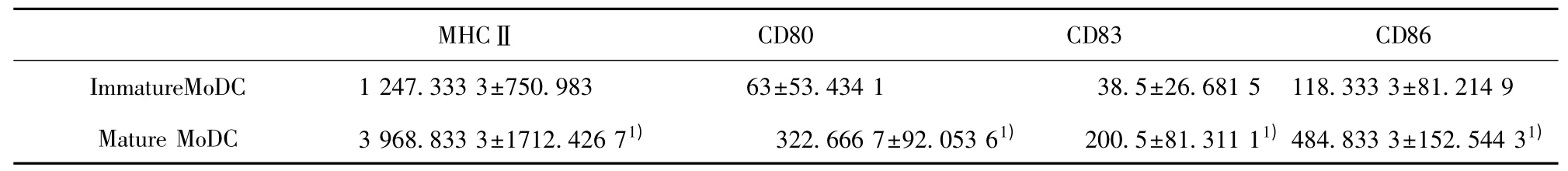
表1 未成熟MoDC 与成熟MoDC MHCⅡ、CD80、CD83、CD86 平均荧光强度(±s)Tab.1 Mean fluorescent intensity of MHCⅡ,CD80,CD83,CD86 on immature MoDC and mature MoDC(±s)
Note:1)P<0.05.
2.3 MoDC 刺激同种异体淋巴细胞增殖能力 用临床上流式鉴定淋巴细胞的条件(CD45阳性及SSC值小)圈定淋巴细胞得到细胞百分比在80%以上(图6);用瑞氏姬姆萨染色后镜下鉴定为淋巴细胞(图7)。
刺激同种异体淋巴细胞增殖实验中,仅接种淋巴细胞的空白对照孔OD 值在未成熟MoDC 组与成熟MoDC 组间无差异(0.423 4±0.046 6 vs 0.450 4±0.081 5,P>0.05),而未成熟MoDC 刺激同种异体淋巴细胞增殖指数在不同比例均较培养7 d 成熟MoDC 低,具有统计学意义(表2)。
表2 未成熟MoDC 与成熟MoDC 刺激淋巴细胞增殖指数(±s)Tab.2 Proliferation index of lymphocyte stimulated by immature MoDC and mature MoDC(±s)

表2 未成熟MoDC 与成熟MoDC 刺激淋巴细胞增殖指数(±s)Tab.2 Proliferation index of lymphocyte stimulated by immature MoDC and mature MoDC(±s)
Note:1)P<0.05.
3 讨论
树突状细胞是已知的抗原递呈功能最强的细胞,是连接固有免疫和适应性免疫的桥梁,在诱导适应性免疫应答和免疫耐受中发挥重要作用。半世纪前,Ralph Steinman 等首次在小鼠脾脏中发现DC,随后研究发现人体内DC 起源于骨髓CD34+造血干细胞,其中,CD34+髓系造血干细胞在骨髓内分化为单核细胞和DC 前体细胞,两者进入血液后迁移至淋巴器官和外周组织,DC 前体细胞进一步分化为朗格汉斯细胞和组织间隙DC,由此分化而来的DC 为髓样树突状细胞(mDC);而CD34+淋巴系造血干细胞则分化为浆细胞样树突状细胞(pDC)。人体内DC 还常被分为传统DC 和非传统DC 两类,传统DC是正常生理状态下具有典型形态和功能的DC,包括迁移的DC 和淋巴样的DC;非传统DC 通常不存在于正常生理情况下,而在炎症刺激应答情况下显著增多,包括pDC 和MoDC[1,2]。
正常生理情况下,人体内大多数DC 处于未成熟状态,高表达抗原捕获相关的表面受体,例如:甘露糖受体和免疫球蛋白受体,有很强的抗原捕获能力;低表达MHCⅡ分子及黏附分子、协同刺激分子(CD80、CD83、CD86),从而刺激淋巴细胞活化能力较低。而在炎症刺激应答情况下,未成熟DC 表达甘露糖受体和免疫球蛋白受体下降,MHCⅡ、CD40、CD80、CD83、CD86 等表达显著升高而成为成熟DC,并向储存初始T 细胞的外周淋巴器官迁移,通过分泌细胞因子及上调的分子刺激初始T 细胞活化增殖并分化为Th1、Th2、Th17 型效应细胞发挥适应性免疫应答。不仅如此,成熟DC 还可以直接活化B细胞和NK 细胞[1-4]。
MoDC 是单核细胞在炎症刺激环境下分化而来的非传统DC,分布于皮肤、肺、肾脏、肠道等外周组织。本实验从正常人少量外周血分离单核细胞[5,6],经rhGM-CSF、rhIL-4 联合诱导培养4 d 获得未成熟MoDC 后加入TNF-α,TNF-α 能提高DC 表面GM-CSF 受体的数量,促进CD86 和CD40 表达,阻断粒细胞分化途径,促进DC 分化、成熟。CD11c是mDC 的特应性表面标记,CD11c+CD1a+则是MoDC 的典型标记。培养4 d 未成熟MoDC 中已有约88.44% 表达CD11c,而只有约39.53% 双表达CD11c+CD1a+,且MHCⅡ分子及协同刺激分子表达量都较低,说明培养4 d 后绝大多数单核细胞已经分化为mDC,但只有少数细胞分化为特异性的MoDC,且处于未成熟状态;而经TNF-α 刺激培养7 d 的MoDC 中 有 高 达93.58% 表 达 CD11c,约76.91%双表达CD11c+CD1a+,较前明显增多,MHCⅡ分子及协同刺激分子表达量显著升高,说明随着培养时间延长,绝大多数单核细胞能分化为特异性MoDC,且TNF-α 能有效诱导MoDC 成熟。成熟MoDC 较其他类型DC 更高表达CD11c、MHCⅡ分子及协同刺激分子,MoDC 与同种异体淋巴细胞按不同比例共培养时[7],成熟MoDC 刺激淋巴细胞增殖能力强于未成熟MoDC,说明其具有更强的抗原递呈及交叉递呈能力,能有效激活淋巴细胞产生免疫应答。
MoDC 诱导适应性免疫能有效保护机体抵抗外来细菌、病毒和真菌等病原体感染。同时,MoDC 在多种变态反应性疾病例如:特应性皮炎、支气管哮喘、结膜炎等的发生发展中起作用。近年来,其在抗肿瘤免疫和调节自身免疫性疾病免疫应答方面更是备受关注[9-14]。大多数恶性肿瘤表达有免疫原性的抗原,但通过阻断DC 成熟抑制其功能使机体不能产生有效地免疫应答。研究发现,免疫治疗成功的关键并不在于患者体内现存DC 的活化,而是患者体内肿瘤引流淋巴结中MoDC 的数量,说明MoDC是DC 抗肿瘤免疫的最关键物质。通过向患者体内淋巴结注射体外培养载有肿瘤相关抗原肽或溶解产物的MoDC 可有效激活患者的抗肿瘤免疫[9-13]。在自身免疫反应疾病中,DC 诱导自体反应的CD4+和CD8+T 细胞分化而不是正常情况下产生免疫抑制作用的调节T 细胞或者使自体反应的T 细胞无效能。目前研究发现将编码具有免疫抑制作用细胞因子(例如:IL-10、IL-4、TNF-α)的基因转染入MoDC或者应用协同刺激分子CD83、CD86和CD80的抗体阻断协同刺激分子与自体反应的T 细胞上CD28受体结合,抑制MoDC 成熟及其刺激T 细胞分化为效应T 细胞能力降低免疫反应可调节自身免疫疾病的异常免疫应答[14]。
人体内DC 数量少,仅占外周血细胞的1%以下,体外培养MoDC 这一方法使得研究MoDC 在疾病发病及治疗中的作用成为可能[6-8]。然而,传统体外培养MoDC 方法耗血量大,使得MoDC 在儿童变态反应性、自身免疫性、肿瘤等疾病的研究中受限。本实验方法可以解决儿童取血量受限而通过传统方法培养MoDC 量少的难题,为儿童变态反应性、自身免疫性、肿瘤等疾病中MoDC 的研究奠定基础。
[1]Kushwah R,Hu J.Complexity of dendritic cell subsets and their function in the host immune system[J].Immunology,2011,133(4):409-419.
[2]Collin M,McGovern N,Haniffa M.Human dendritic cell subsets[J].Immunology,2013,140(1):22-30.
[3]Sallusto F,Lanzavecchia A.Effcient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha[J].J Exp Med,1994,179:1109-1118.
[4]Novak N,Bieber T,Katoh N.Engagement of Fc epsilon RI on human monocytes induces the production of IL-10 and prevents their differentiation in dendritic cells[J].Immunology,2001,167(2):797-804.
[5]Auray G,Facci MR,van Kessel J,et al.Porcine neonatal blood dendritic cells,but not monocytes,are more responsive to TLRs stimulation than their adult counterparts[J].PLoS One,2013,8(5):e59629.
[6]León B,López-Bravo M,Ardavín C.Monocyte-derived dendritic cells[J].Semin Immunol,2005,17(4):313-318.
[7]Randolph GJ,Jakubzick C,Qu C.Antigen presentation by monocytes and monocyte-derived cells[J].Curr Opin Immunol,2008,20(1):52-60.
[8]León B,Ardavín C.Monocyte-derived dendritic cells in innate and adaptive immunity[J].Immunol Cell Biol,2008,86 (4):320-324.
[9]Mbongue J,Nicholas D,Langridge W.The role of dendritic cells in tissue-specific autoimmunity [J].J Immunol Res,2014,2014:857143.
[10]Wimmers F,Schreibelt G,Sköld AE,et al.Paradigm shift in dendritic cell-based immunotherapy:from in vitro generated monocyte-derived DCs to naturally circulating DC subsets[J].Front Immunol,2014,5:165.
[11]Palucka K,Banchereau J.Human dendritic cell subsets in vaccination[J].Curr Opin Immunol,2013,25(3):396-402.
[12]Cohn L,Delamarre L.Dendritic cell-targeted vaccines[J].Front Immunol,2014,5:255.
[13]Anguille S,Smits EL,Lion E,et al.Clinical use of dendritic cells for cancer therapy[J].Lancet Oncol,2014,15(7):e257-e267.
[14]Kuhn S,Ronchese F.Monocyte-derived dendritic cells:emerging players in the antitumor immune response[J].Oncoimmunology,2013,2(11):e26443.