小鼠小肠干细胞谱系追踪方法的建立及其在放射损伤中的应用
徐铁柱,崔宇,杨超,王丽梅,李中堂,王俊可,赵致维,善亚君,柳晓兰,从玉文
小鼠小肠干细胞谱系追踪方法的建立及其在放射损伤中的应用
徐铁柱,崔宇,杨超,王丽梅,李中堂,王俊可,赵致维,善亚君,柳晓兰,从玉文
目的 利用Lgr5-EGFP-CreERT2/ROSA26-stop-EYFP小鼠建立谱系追踪方法,用于观察Lgr5+小肠干细胞在小肠组织更新中的作用,并研究辐射对小肠干细胞组织重建的影响。方法 通过基因型分析鉴定Lgr5-EGFP-CreERT2/ ROSA26-stop-EYFP小鼠。他莫西芬诱导小鼠体内的荧光蛋白表达,激光共聚焦显微镜观察诱导后小肠干细胞的分化。采用60Coγ射线(15Gy)照射Lgr5-EGFP-CreERT2/ROSA26-stop-EYFP小鼠,观察辐射对小肠干细胞组织重建的影响。结果 提取鼠尾DNA通过PCR方法鉴定Lgr5基因(174bp),获得双阳性小鼠。他莫西芬(100mg/kg)单次诱导后,激光共聚焦观察到Lgr5+小肠干细胞在诱导后5d开始分裂,7d已到达绒毛顶端,14d少量绒毛全部带有荧光,45d更多的小肠绒毛中存在荧光细胞,而且更加稠密。但在15Gy照射后小鼠小肠绒毛脱落严重,隐窝处没有荧光出现。结论 成功建立了小肠干细胞谱系追踪模型,并初步观察了辐射对小肠干细胞损伤的影响。
小肠干细胞;谱系追踪;辐射损伤
在哺乳动物体内,小肠组织是自我更新速度最快的组织之一。整个小肠黏膜大概每3~5d更新一次,主要依赖于小肠干细胞的增殖与分化[1]。成体干细胞具有高度自我更新及多向分化能力[2]。以往对小肠干细胞的认识手段仅局限于使用多元同位素成像质谱分析法来研究DNA标记保留细胞[3]以及使用Musashi-1[4]和Prominin1[5]来研究隐窝柱状上皮细胞。由于缺乏相应的技术手段直接证明干细胞的特性以及有效的干细胞分析方法,干细胞表面标志的研究一直进展缓慢[6]。直到谱系追踪方法的出现,小肠干细胞表面标志的研究才有突破性的进展。
谱系追踪系统可以示踪来源于同一细胞的所有子代细胞,是在成体哺乳类组织中研究干细胞特性的一种重要工具,通常使用Cre-LoxP系统,需要两种品系小鼠:一种是具有组织或细胞特异性的Cre重组酶小鼠,另一种是带有loxP-STOP-loxP(锚定STOP)序列的报告基因小鼠。通过他莫西芬诱导可在两种品系杂交后的双阳性子代小鼠特定细胞内表达Cre重组酶,以此剪切STOP序列,从而使报告基因得以表达,获得遗传基因改变的细胞,进而达到示踪的目的[7]。谱系追踪系统已被公认为研究干细胞群体的一种重要手段[8]。国外有研究利用谱系追踪相继证实Ascl2、Olfm4、Bmi-1、Hopx等为小肠干细胞的标志基因[9-11]。在这些标记基因中,Lgr5被认为是最重要的。从功能上分析,Lgr5编码G蛋白偶联受体,在Wnt信号通路中起着重要的作用。从数量上看,Lgr5+干细胞增殖活跃,具有自我更新的潜能,在所有隐窝的底部均大量存在,以维持小肠上皮的稳态[12-13]。本研究引进Lgr5-EGFPCreERT2小鼠和ROSA26-stop-EYFP报告基因小鼠,建立小鼠小肠干细胞谱系追踪方法,并应用该方法观察大剂量照射对小肠干细胞损伤的影响。
1 材料与方法
1.1 主要试剂及仪器 他莫西芬购于Sigma公司;甲醛溶液购自天津市福晨化学试剂有限公司;2xPCR Master Mix购于北京博迈德生物科技有限公司。震荡切片机(MA752,美国Campden Instruments公司);激光共聚焦显微镜(FV1000公司);PCR扩增仪购于北京友华生物科技有限公司。
1.2 实验动物 B6.129P2-Lgr5tm1(cre/ERT2)Cle/J小鼠购于美国Jackson实验室,品系编号为J008875,属基因敲入小鼠,纯合子致死。ROSA26-stop-EYFP报告基因小鼠购于南京大学模型动物中心,属基因敲入小鼠,EYFP前面有一个LoxP锚定的STOP序列,纯合子可存活。Lgr5-EGFP-CreERT2/ROSA26-stop-EYFP杂交小鼠注射抗雌激素,如4-羟基他莫西芬来激活Cre,可剪切EYFP序列前的STOP序列,从而使EYFP基因得以表达。小鼠饲养于军事医学科学院实验动物中心SPF级动物房。
1.3 双阳性小鼠基因型鉴定 在小鼠4周龄时,提取杂交小鼠鼠尾DNA,通过凝胶电泳检测小鼠基因型。Lgr5基因PCR引物序列如下(扩增目的片段长174bp)。Common 8060:5'-CTGCTCTCTGCTCCCA GTCT-3';Wild Type 8061:5'-ATACCCCATCCCTT TTGAGC-3';Mutant 9402:5'-GAACTTCAGGGTC AGCTTGC-3'。PCR条件:预变性94℃ 3min;94℃变性30s,66℃复性1min,72℃延伸30s,35个循环;72℃延伸5min。
1.460Co γ线照射 选取经PCR鉴定Lgr5基因为杂合子的小鼠3只,6~8周龄,体重20~22g。将小鼠置于铅屏后面接受剂量率约为55cGy/min(总剂量15Gy)的全身屏蔽照射。照射后1h,每只小鼠按100mg/kg腹腔注射他莫西芬进行诱导。照射后4.5h取空肠组织,制作震荡切片。
1.5 他莫西芬诱导 选取5只Lgr5基因为杂合子的小鼠,6~8周龄,体重20~22g。按每只小鼠100mg/ kg腹腔注射他莫西芬诱导。诱导后3、5、7、14、45d各处死1只小鼠,取空肠组织,制作震荡切片。
1.6 震荡切片机切片 安乐处死小鼠后,取3段1cm空肠组织,纵向剖开平铺于滤纸上,置于4%多聚甲醛中30min后取出,1×PBS溶液里浸泡5min。将空肠组织平铺在包埋盒中,60℃下用4%的琼脂糖固定,待凝固后,取出切成1cm2大小,并将3个琼脂糖块立起并列放在包埋盒中,60℃下用4%的琼脂糖固定。用胶水将组织块固定到震荡切片机托盘上,在切片槽内倒入适量PBS溶液,浸没刀片,将切片厚度设置为180μm,然后根据琼脂糖的硬度及小肠组织包埋的位置调整刀片适宜的前进速度和震荡幅度,将切好的片子从PBS溶液中捞出,置于含有预冷PBS溶液的培养皿里,4℃保存备用于激光共聚焦显微镜观察。
1.7 激光共聚焦显微镜观察诱导后小肠干细胞的分化情况 采用FV1000激光共聚焦显微镜观察,通过扫描程序对整张切片进行扫描,以FV10-ASW2.1软件进行图像提取和分析。根据文献报道[6],在荧光显微镜下观察Lgr5-EGFP-CreERT2小鼠小肠干细胞Lgr5+细胞带有绿色荧光,分布在隐窝底部0-+4位。
2 结 果
2.1 双阳性小鼠基因型鉴定 Lgr5目的基因条带大小为174bp的小鼠即为所需的杂交小鼠(图1)。
2.2 激光共聚焦显微镜观察小肠隐窝底部Lgr5+干细胞 应用激光共聚焦显微镜可以清晰地看到在小肠隐窝底部有绿色荧光产生,呈间隔分布,集中在0-+4位之间,嵌合在潘氏细胞之间。Lgr5+的隐窝基底柱状干细胞(CBC)细胞呈楔形,朝向肠腔。纵观小肠绒毛,荧光的产生呈镶嵌式分布,并不是每个绒毛底部都有荧光产生(图2)。

图1 Lgr5基因凝胶电泳鉴定结果Fig.1 Gel electrophoresis appraisal result of Lgr5 gene

图2 隐窝底部Lgr5+干细胞Fig.2 Lgr5+stem cells exist in the bottom of the crypt
2.3 小肠干细胞谱系追踪模型的建立 在激光共聚焦显微镜下观察诱导后不同时间点小肠干细胞的变化,发现诱导后3d隐窝底部已经开始出现荧光,并有向上移动的趋势;诱导后5d荧光细胞已经移动到隐窝的快速增殖细胞(TA)部;诱导后7d可看到有少量从隐窝分裂分化的细胞已经移动到绒毛顶端;诱导后14d有更多的荧光细胞到达小肠绒毛顶端,少量绒毛从隐窝基底到绒毛顶尖则全部带有荧光;诱导后45d可见整个小肠绒毛中荧光细胞更多、更密实。提示分化的细胞系来源于Lgr5+干细胞,小鼠小肠干细胞谱系追踪模型成功建立(图3)。
2.4 15Gy照射对小鼠小肠干细胞组织更新的影响在照射后4.5d(108h)用激光共聚焦显微镜观察小鼠小肠干细胞的变化,发现15Gy照射后的小鼠小肠绒毛严重脱落,隐窝基底部也没有荧光出现,而未经照射的正常小鼠在诱导后4.5d隐窝处荧光已经开始沿着隐窝-绒毛中轴线向上移动。说明15Gy照射可导致隐窝处小肠干细胞死亡,在照后4.5d也没有恢复(图4)。

图3 谱系追踪系统的建立Fig.3 The establishment of the lineage tracking system
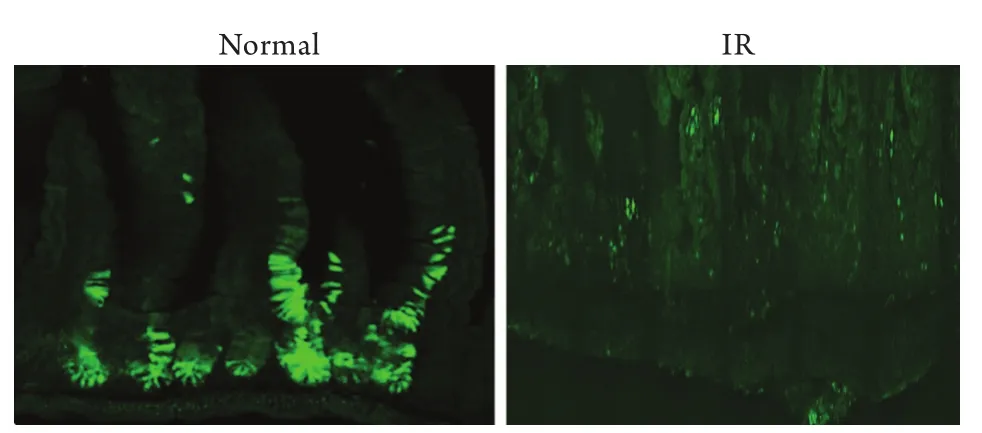
图4 15Gy照射对小肠组织重建的影响Fig.4 Effects of 15Gy irradiation (IR) on small intestinal tissue reconstruction
3 讨 论
小肠隐窝内的快速增殖细胞会分化为成熟的小肠绒毛上皮细胞。小肠隐窝由两种不同的细胞系(吸收系和分泌系)和四种不同类型的成熟细胞(肠上皮吸收细胞、杯状细胞、肠分泌细胞、潘氏细胞)组成。20世纪末期,Bach等[14]用带有同位素3H的胸腺嘧啶和BrdU等DNA掺入法以及Ki67等增殖性的标志抗体来研究隐窝部位的增殖,初步证实增殖细胞在隐窝的下部2/3部位,并将之称为快速增殖细胞即TA细胞。
由于小肠干细胞比TA细胞有着更长的细胞周期,基于这种假说,Booth等[15]用同位素3H的胸腺嘧啶和BrdU在辐射后进行脉冲标记来区分这两种细胞。这种标记会在一段时间后大量聚集在TA细胞中,在向绒毛部位移动后,标记会被隐藏,或者在大量的细胞分裂后标记被稀释。在这个模型中,他们认为缓慢循环、标记长期保留的细胞(LRC)不仅是长寿细胞而且也可以代表小肠干细胞,但未对小肠干细胞的功能进行证实。
不同类型的干细胞表面标志如Musashi-1[4]、BMPR1α、phospho-PTEN、DCAMKL1、Eph受体和整合素都曾被提出来作为研究小肠干细胞表面标志的基因,但这些受体只是为研究小肠干细胞提供了一个更好的工具,而是否是小肠干细胞表面标志还需要功能上的进一步检测[16-19]。
2007年Barker等[8]利用可诱导的Cre基因敲入小鼠和Rosa26-lacZ报告基因小鼠建立了谱系追踪的方法,证实了Lgr5基因为小肠和结肠干细胞的表面标志。随后相继报道Bmi1和Hopx、Mtert、Lrig1基因分别是+4位小肠干细胞的特征标志,Bmi1阳性细胞主要分布于小肠上1/3处,而Hopx阳性细胞分布在全部小肠,应用体内谱系示踪以及体外培养均证实这些细胞为小肠隐窝多功能干细胞,在损伤修复中起着重要作用[9-11]。
小肠是目前干细胞生物学研究最主要的模型之一,而小肠干细胞的表面标志基因也是目前研究的重点方向。小鼠小肠干细胞谱系追踪系统可以直观地展现小肠的更新情况,更加真实地反映体内组织重建的状况,是目前国际干细胞研究领域一种前沿的研究手段。本研究采用的Rosa26-stop-EYFP报告基因小鼠较其他报告基因小鼠如Rosa26-lacZ操作更加简单,只需制作震荡切片;观察更加直接,不需要其他额外的染色手段,可以更加真实直接的反映组织和细胞原有的状况。利用震荡切片可以切出厚度150~200μm的最佳组织,能最大程度地保留荧光蛋白的活性以及细胞的完整性,从而在各种组织中具备高分辨率的三维立体结构[20]。不足的是切片中荧光保存时间较短,4℃下只能保存一周左右。
本研究观察了大剂量照射下小肠组织的更新情况。照射后4.5d,小肠绒毛严重脱落,几乎没有荧光出现,但隐窝数目表明此时隐窝有增殖现象,说明大剂量照射可使增殖活跃的Lgr5+干细胞凋亡,隐窝的增殖细胞可能是由+4位小肠干细胞转化而来。Lgr5+的小肠干细胞的作用主要在于维护肠黏膜稳态重建,而Bmi1等标记的静态小肠干细胞则主要参与放射等损伤后的肠黏膜重建[21]。
[1]Barker N, Bartfeld S, Clevers H. Tissue-resident adult stem cell populations of rapidly self-renewing organs[J]. Cell Stem Cell, 2010, 7(6): 656-670.
[2]Gu X, Zhang JF, Guo Q, et al. Cultivation,identification and directional differentiation potency of human amniotic fluidderived multipotential stem cells[J]. Med J Chin PLA, 2011, 36(1): 24-26,30. [顾潇, 张建芳, 郭倩, 等. 羊水来源多潜能干细胞的培养鉴定及其定向分化能力研究[J]. 解放军医学杂志, 2011, 36(1): 24-26, 30.]
[3]Steinhauser ML, Bailey AP, Senyo SE, et al. Multi-isotope imaging mass spectrometry quantifies stem cell division and metabolism[J]. Nature, 2012, 481(7382): 516-519.
[4]He XC, Yin T, Grindley JC, et al. PTEN-deficientintestinal stem cells initiate intestinal polyposis[J]. Nat Genet, 2007, 39(2): 189-198.
[5]Zhu L, Gibson P, Currle DS, et al. Prominin 1 marks intestinal stem cells that are susceptible to neoplastic dtransformation[J]. Nature, 2009, 457(7229): 603-607.
[6]Yue DL, Han JL, Guan FX, et al. Advances in cancer stem cells and their clinical significance[J]. J Zhengzhou Univ (Med Sci), 2013, 48(1): 1-8. [岳冬丽, 韩交玲, 关方霞, 等. 肿瘤干细胞的研究进展及临床意义[J]. 郑州大学学报(医学版), 2013, 48(1): 1-8.]
[7]Kretzschmar K, Watt FM. Lineage tracing[J]. Cell, 2012, 148(1-2): 33-45.
[8]Barker N, van Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by markergene Lgr5[J]. Nature, 2007, 449(7165): 1003-1007.
[9]Takeda N, Jain R, LeBoeuf MR, et al. Interconversion between intestinal stem cell populations in distinctniches[J]. Science, 2011, 334(6061): 1420-1424.
[10]van der Flier LG, van Gijn ME, Hatzis P, et al. Transcription factor achaete scute-like 2 controls intestinal stem cell fate[J]. Cell, 2009, 136(5): 903-912.
[11]Sangiorgi E, Capecchi MR. Bmi1 is expressed in vivo in intestinal stem cells[J]. Nat Genet, 2008, 40(7): 915-920.
[12]Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature, 2009, 459(7244): 262-265.
[13]Itzkovitz S, Lyubimova A, Blat IC, et al. Single-molecule transcript counting of stem-cell markers in the mouse intestine[J]. Nat Cell Biol, 2011, 14(1): 106-114.
[14]Bach SP, Renehan AG, Potten CS. Stem cells: the intestinal stem cell as a paradigm[J]. Carcinogenesis, 2000, 21(3): 469-476.
[15]Booth C, Potten CS. Gut instincts: thoughts on intestinal epithelial stem cells[J]. J Clin Invest, 2000, 105(11): 1493-1499.
[16]He XC, Zhang J, Tong WG, et al. BMP signaling inhibits intestinal stem cell self-renewal through suppression of Wntbetacatenin signaling[J]. Nat Genet, 2004, 36(10): 1117-1121.
[17]He XC, Yin T, Grindley JC, et al. PTEN-deficient intestinal stem cells initiate intestinal polyposis[J]. Nat Genet, 2007, 39(2): 189-198.
[18]Dekaney CM, Rodriguez JM, Graul MC. Isolation and characterization of a putative intestinal stem cell fraction from mouse jejunum[J]. Gastroenterology, 2005, 129(5): 1567-1580.
[19]Dodelet VC, Pasquale EB. Eph receptors and ephrin ligands: embryogenesis to tumorigenesis[J]. Oncogene, 2000, 19(49): 5614-5619.
[20]Snippert HJ, Schepers AG, Delconte G, et al. Slide preparation for single-cell-resolution imaging of fluorescent proteins in their three-dimensional near-native environment[J]. Nat Protoc, 2011, 6(8): 1221-1228.
[21]Metcalfe C, Kljavin NM, Ybarra R, et al. Lgr5+stem cells are indispensable for radiation-induced intestinal regeneration[J]. Cell Stem Cell, 2014, 14(2): 149-159.
Establishment of lineage tracing method of mice small intestinal stem cell and application in radiation injury
XU Tie-zhu1, CUI Yu2, Yang Chao2, WANG Li-mei2, LI Zhong-tang2, WANG Jun-ke2, ZHAO Zhi-wei2, SHAN Ya-jun2, LIU Xiao-lan2, CONG Yu-wen2*1Graduate School, Guangxi Medical University, Nanning 530000, China
2Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China
*
, E-mail: congyw01@163.com
This work was supported by the National Drug Discovery of Major Projects (2013ZX09J13102-02C) and the National Natural Science Foundation of China (81272997)
ObjectiveTo establish a lineage tracing method with Lgr5-EGFP-CreERT2/ROSA26-stop-EYFP mouse for observing the role of Lgr5+intestinal stem cells in the renovation of small intestine tissue, and investigate the effects of radiation on the reconstruction of small intestinal stem cell tissue.MethodsLgr5-EGFP-CreERT2/ROSA26-stop-EYFP mice were identified by genotype analysis. Tamoxifen was used to induce the expression of fluorescent protein in mice. The differentiation of intestinal stem cells induced by Tamoxifen was observed by laser confocal microscopy. Lgr5-EGFP-CreERT2/ROSA26-stop-EYFP mice were irradiated with60Co γ-rays, and the effects of irradiation on the reconstruction of small intestinal stem cell tissue were examined.ResultsDouble positive mice were obtained by identification of Lgr5 gene (174bp) in DNA extraction from the mice tail with PCR method. In mice treated with single injection of Tamoxifen (100mg/kg), it was observed by laser confocal scanning microscopy that the Lgr5+intestinal stem cells started dividing at the 5th day after inducement, reached the top of the villi at the 7th day, fluorescence appeared in a few of whole intestinal villi at the 14th day, and spread over more intestinal villi with dense fluorescence at the 45th day. However, in mice exposed to 15Gy irradiation, the intestinal villi fell off seriously without fluorescence in crypts.ConclusionThe lineage tracing model of intestinal stem cell has been successfully established and then used to evaluate the irradiation injuries to intestinal stem cells.
intestinal stem cells; lineage tracing; radiation injuries
R818.04
A
0577-7402(2015)05-0349-05
10.11855/j.issn.0577-7402.2015.05.03
2015-01-11;
2015-03-19)
(责任编辑:李恩江)
国家重大新药创制专项课题(2013ZX09J13102-02C);国家自然科学基金面上项目(81272997)
徐铁柱,硕士研究生。主要从事辐射防护药物的研究工作
530000 南宁 广西医科大学研究生院(徐铁柱);100850 北京 军事医学科学院放射与辐射医学研究所(崔宇、杨超、王丽梅、李中堂、王俊可、赵致维、善亚君、柳晓兰、从玉文)
从玉文,E-mail:congyw01@163.com

