体外法研究四种反刍动物饲料添加剂对瘤胃发酵的影响
牛俊丽, 李吉楠, 刘 辉, 潘 龙, 王 建
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京海淀 100193)
饲用微生物又称益生菌或者竞争性细菌培养物,是一种能够提高动物生产性能、无毒无残留的新型饲料添加剂,已成为抗生素的理想替代品。邓露芳等(2009)认为饲用微生物作为一种微生物饲料添加物,可通过改善宿主体内和周边的微生物区系,而提高饲料营养价值和动物对饲料的利用率,降低宿主发病率、死亡率。饲用微生物不仅能改变瘤胃发酵模式,还能提高动物的生产性能。有研究报道,在反刍动物日粮中添加饲用微生物能够提高瘤胃和整个消化道干物质(DM)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和粗蛋白质(CP)的消化率,提高干物质采食量,提高奶牛的产奶量,改善奶品质,提高饲料转化率,且具有减缓热应激,改善奶牛体况的作用(黄帅等,2010;栾广春等,2008)。本试验旨在通过体外产气法和体外批次培养法研究不同添加水平的枯草芽孢杆菌、活性酵母粉、瘤胃发酵增强剂和米曲霉对体外发酵产气量及动力学参数、体外营养物质降解率、瘤胃发酵模式和瘤胃氮代谢的影响。
1 材料与方法
1.1 供体动物饲养和瘤胃液的采集 北京中地种畜有限公司试验基地选取3头健康且装有永久性瘤胃瘘管的泌乳期荷斯坦奶牛作为瘤胃液供体牛。奶牛每天饲喂 3 次(7∶00、13∶00 和 19∶00),自由饮水。于晨饲前1 h通过瘤胃瘘管采集3头奶牛瘤胃内容物,混合后装于保温瓶带回,用4层纱布过滤(过滤同时通入CO2),整个操作于39℃水浴中进行,操作尽量在最短时间内完成。
1.2 添加剂和试验日粮 四种反刍动物饲料添加剂分别为:枯草芽孢杆菌(BS),主要成分为特强产酶菌株、产酸菌株、肠道抗感染菌株,以及有益菌代谢产物,活菌数大于5×108cfu/g;活性酵母粉(PRO)一种粉料型高浓缩活性酵母,活性酵母数大于 1.5×1010cfu/g;瘤胃发酵增强剂(FIB),是一种米曲霉培养物、黑曲霉培养物和乳酸马科斯克鲁维酵母混合发酵产物;米曲霉(AO)为米曲霉和黑曲霉混合菌株,总孢子数量大于1.5×1010个/g。
试验所用饲料与供体动物饲喂的饲料一致,饲料原料粉碎并过2 mm筛,按照配方制成颗粒料,风干后备用。基础日粮组成和营养水平如表1所示。

表1 基础日粮组成和营养水平(干物质基础)
1.3 试验设计 试验一:体外产气试验,采用完全随机设计,3个添加水平的4种反刍动物饲料添加剂随机分为12个组,同时设不添加添加剂的空白对照组,每组4个重复。四种添加剂的添加水平均为 0、1、2、4 g/kg 日粮底物。 试验期为 72 h,重复发酵2期。
试验二:体外批次培养试验,每种饲料添加剂均采用4×4二因子设计,因子一为4种不同添加剂量,分别为 0、1、2、4 g/kg 日粮底物,因子二为不同发酵时间 6、12、24、36 h。 试验期为 36 h,重复发酵2期。
1.4 体外发酵 试验一体外产气装置采用AGRS-Ⅲ微生物发酵微量产气自动记录仪(AGRS)(沈英等,2007)。准确称取约0.5 g饲料样品于150 mL厌氧发酵瓶中,每个瓶中分别加入相应种类和剂量的添加剂。接种时迅速向每个瓶中加入50 mL预热的液体培养基和25 mL经4层纱布过滤的新鲜瘤胃液,液体培养基采用Menke和Steingass(1988)的方法配制,并向瓶中持续通入CO25 s后,立即盖上瓶塞,并将每个发酵瓶与产气装置的每个传感器相连接,于39℃下连续培养72 h。
试验二体外发酵装置采用ANKOM Daisy II体外模拟发酵培养箱,选择10~40 μm尼龙布,采用热封的方法制成3 cm×6 cm的尼龙袋,105℃烘至恒重,并记录每个尼龙袋重量,向每个已知重量的尼龙袋中准确称取约0.5 g饲料。尼龙绳封口后放置于DaisyⅡIncubator培养箱消化罐中,每个罐放置26个袋子,平均放在消化罐的分隔板两侧,于 39 ℃下分别培养 6、12、24、36 h。
1.5 样品采集与制备 试验一在发酵72 h的过程实时记录产气量,72 h产气结束后,将发酵瓶放在冰水中终止发酵。
试验二在发酵 6、12、24、36 h 后分别从每个罐中取出4、6、8、8个尼龙袋和15 mL发酵液体,取样时间尽量短,取完后及时向罐中充CO2数十秒,把罐依次放入培养箱中继续培养。从每个罐中取出的尼龙袋用来测定可消化干物质(DMD)、NDF、ADF和 CP,收集的发酵液用于氨态氮(NH3-N)和挥发性脂肪酸(VFA)的测定。
1.6 指标测定及方法
1.6.1 发酵产气指标的测定及产气动力学模型分析 通过AGRS-Ⅲ型64通路微生物发酵微量产气全自动记录装置与软件系统记录产气量。参照Groot等(1996)指数模型对不同日粮累积产气量数据进行非线性拟合。
GPt(mL/g DM)=A/[1+(C/t)B];
式中:GPt为t时间点记录到的累积产气量,mL/g;A为发酵时间无限延长时的理论最大产气量;B为所形成的产气曲线的平滑度;C为达到理论产气量最大值A一半时所需要的时间,h。
最大产气速率 (RmaxG,mL/h)=[A×CB×B×TRmaxS(-B-1)]/[1+CB×TRmaxS(-B)]2;
达到最大产气速率所需要的时间(TRmaxG,h)=C×[(B-1)/(B-1)](1/B);
底物的最大降解率(RmaxS)=[B×TRmaxS(B-1)]/(CB+TRmaxSB);
达到底物最大降解率时所需要的时间(TR-maxS,h)=C×(B-1)(1/B)。
1.6.2 发酵液pH的测定 发酵结束后立即用pH计测定发酵液的pH。
1.6.3 发酵液中菌体蛋白(MCP)浓度的测定 发酵液中的MCP采用Makkar和Becker(1999)的嘌呤法,使用酵母RNA做标准曲线。
1.6.4 发酵液中NH3-N浓度的测定 发酵液中NH3-N浓度利用靛酚比色法测定(王加启,2011)。
1.6.5 发酵液中VFA浓度的测定 VFA浓度采用气相色谱法测定(丁洪涛等,2012)。色谱条件如下:以氮气作为载气,色谱柱:DB-FFAP(15 m×0.32 mm×0.25 μm)。柱温:70℃,3℃/min至125℃,再以30℃/min至180℃,保持5 min。进样口温度:250℃。检测器温度:280℃。恒压:25 kPa。分流比为 1∶20。进样量为 2 μL。
1.6.6 营养物质体外降解率的测定 IVDMD(DNDF、DADF、DCP)%= [样 品 中 DM (NDF、ADF、CP)量(g) - 降解后残渣中 DM(NDF、ADF、CP)量(g)]/样品中 DM(NDF、ADF、CP)量(g)×100;
式中:IVDMD为体外干物质降解率;DNDF为中性洗涤纤维降解率;DADF为酸性洗涤纤维降解率;DCP为粗蛋白质降解率。
本试验中DM和CP参照AOAC(2000)的方法进行测定;NDF和 ADF采用 Van Soest等(1991)的方法测定。
1.7 数据处理 对数据使用Excel 2013进行初步整理后,采用SAS 9.2软件中的GLM模型进行统计分析,显著水平为P<0.05。
2 结果与分析
2.1 不同添加剂的不同添加水平对瘤胃发酵产气参数的影响 由表2可知,随着枯草芽孢杆菌添加剂量的增加,其GP72(P=0.0787)和A (P=0.0874)有线性增加的趋势,TRmaxG呈三次方显著增加(P<0.05),TRmaxS有三次方变化的趋势(P=0.0585), 参数 C、RmaxG、RmaxS 未受枯草芽孢杆菌添加剂量的影响(P>0.05);随着活性酵母粉添加剂量的增加,GP72有二次方增加的趋势(P=0.0566),A 呈二次方显著增加 (P<0.05),但参数 B、C、RmaxG、TRmaxG、RmaxS、TRmaxS 未受活性酵母粉添加剂量的影响(P>0.05);随着米曲霉添加剂量的增加,GP72和A呈线性增加 (P<0.05),B 有线性增加的趋势(P=0.0945),且 4 g/kg剂量组的GP72和A分别比对照组提高了16%和19%,而参数 C、RmaxG、TRmaxG、RmaxS、TRmaxS未受米曲霉添加剂量的影响(P>0.05);随着瘤胃发酵增强剂添加剂量的增加,GP72和A呈线性增加(P<0.05),且 4 g/kg剂量组的 GP72和 A分别比对照组提高了28%和30%,RmaxS有三次方变化趋势 (P=0.0612), 但参数 B、C、RmaxG、TR-maxG、TRmaxS未受瘤胃发酵增强剂添加剂量的影响(P>0.05)。
2.2 不同添加剂的不同添加水平对体外营养物质降解率的影响 由表3可知,1、2、4 g/kg剂量组的枯草芽孢杆菌的IVDMD均显著高于对照组(P<0.05),但并未影响 DNDF、DADF 和 DCP;活性酵母粉1、2、4 g/kg剂量组的IVDMD显著高于对照组(P<0.05),随着活性酵母粉添加剂量的增加,DNDF呈三次方变化的趋势(P=0.0919),与对照组相比,1、4 g/kg DM添加剂量组的DADF显著升高 (P<0.05),1、2 g/kg DM 添加剂量组的DCP差异不显著,4 g/kg DM添加剂量组的DCP显著降低 (P<0.05);随着米曲霉添加剂量的增加,DNDF变化显著,DADF呈三次方显著变化(P=0.0124),DCP 有线性降低的趋势(P=0.0697),1 g/kg DM剂量组的DNDF和DADF均显著高于其他剂量组(P<0.05);瘤胃发酵增强剂各剂量组的IVDMD均显著高于对照组(P<0.05),随着其添加剂量的增加,DNDF有线性降低的趋势 (P=0.0905),DADF呈二次方显著变化,1 g/kg DM组的DADF显著低于其他处理组 (P<0.05),DCP未受瘤胃发酵增强剂的影响(P>0.05)。
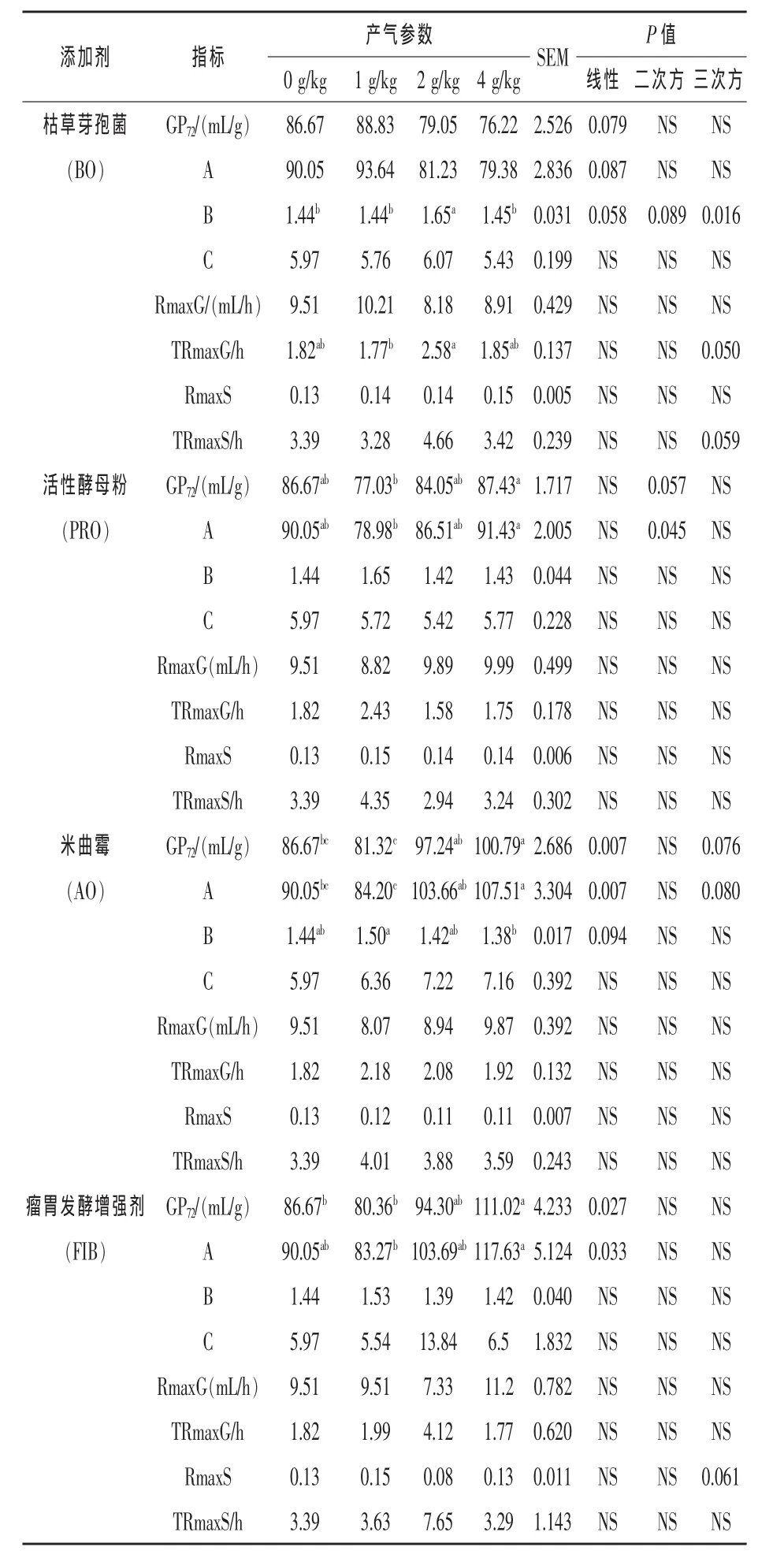
表2 不同剂量的枯草芽孢杆菌、活性酵母粉、米曲霉和瘤胃发酵增强剂对瘤胃发酵72 h产气参数的影响
2.3 不同添加剂的不同添加水平对氨态氮的影响 由表4可以看出,与对照组相比,枯草芽孢杆菌各剂量组的NH3-N浓度差异不显著;活性酵母粉1、4 g/kg剂量组NH3-N显著低于对照组(P<0.05),分别比对照组降低 13%、4%;米曲霉2、4 g/kg剂量组 NH3-N显著低于对照组 (P<0.05),均比对照组降低8%,而1 g/kg剂量组和对照组差异不显著;瘤胃发酵增强剂1、2 g/kg剂量组NH3-N显著低于对照组(P<0.05),而与4 g/kg剂量组差异不显著,1、2 g/kg剂量组分别比对照组降低8%、11%。
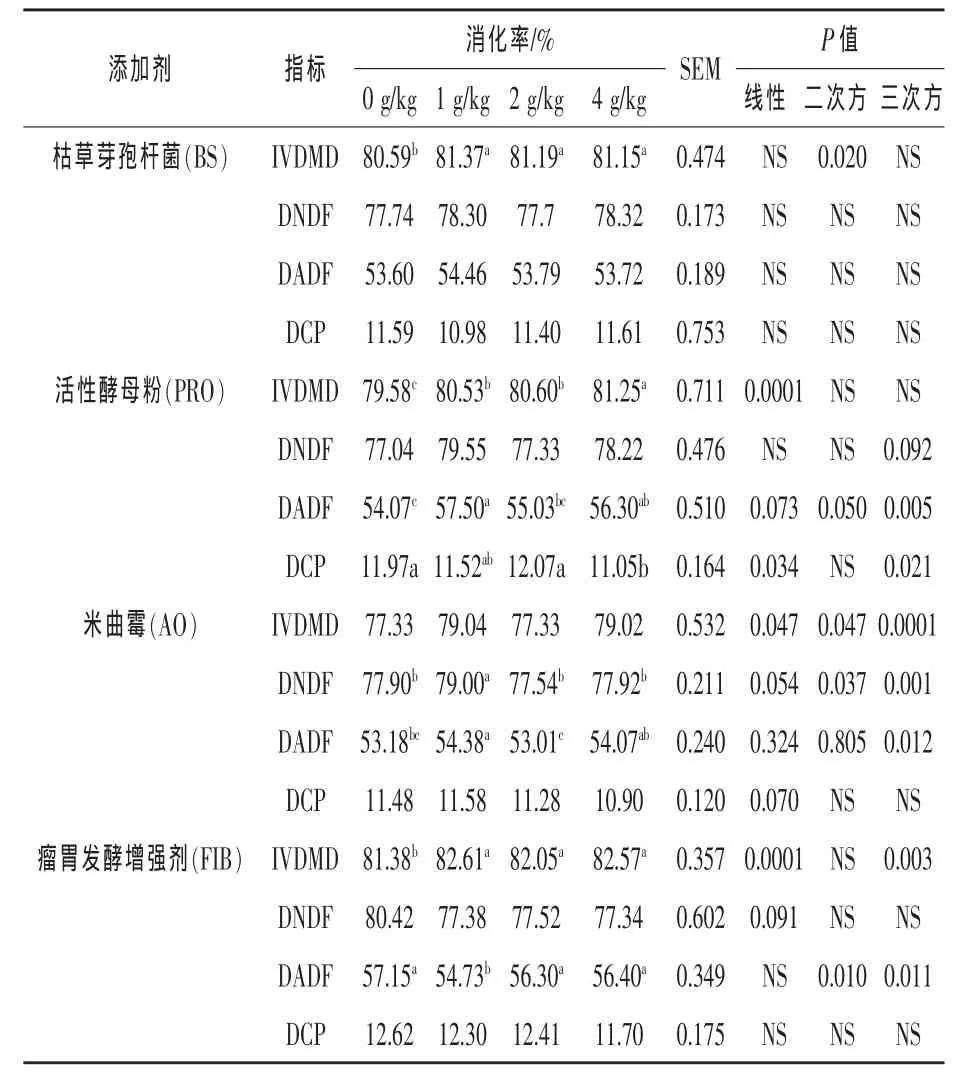
表3 不同剂量的枯草芽孢杆菌、活性酵母粉、米曲霉和瘤胃发酵增强剂对体外批次培养36 h营养物质降解率的影响

表4 不同剂量的枯草芽孢杆菌、活性酵母粉、米曲霉、瘤胃发酵增强剂对体外批次培养36 h氨态氮的影响
2.4 不同添加剂的不同添加水平对瘤胃液中挥发性脂肪酸的影响 从表5可以看出,体外批次发酵24 h后,乙酸、丙酸、异丁酸、丁酸、异戊酸以及乙酸/丙酸均未受枯草芽孢杆菌添加剂量的影响,随着枯草芽孢杆菌添加剂量的增加,戊酸浓度线性降低(P<0.05),其中 4 g/kg DM添加剂量组的戊酸浓度显著低于0、1 g/kg DM剂量组(P<0.05),总VFA有线性降低的趋势 (P=0.0807);VFA的各组分浓度、总VFA浓度以及乙酸/丙酸未受活性酵母粉添加剂量和米曲霉添加剂量的影响;瘤胃发酵增强剂并未影响乙酸、丁酸、总VFA以及乙酸/丙酸,随着瘤胃发酵增强剂添加剂量的增加,丙酸(P=0.0870)、异丁酸(P=0.0934)、异戊酸(P=0.0766)、戊酸(P=0.0841)呈二次方增加趋势,其中1.0 g/kg DM剂量组的丙酸、异戊酸、戊酸浓度均显著高于对照组(P<0.05)。
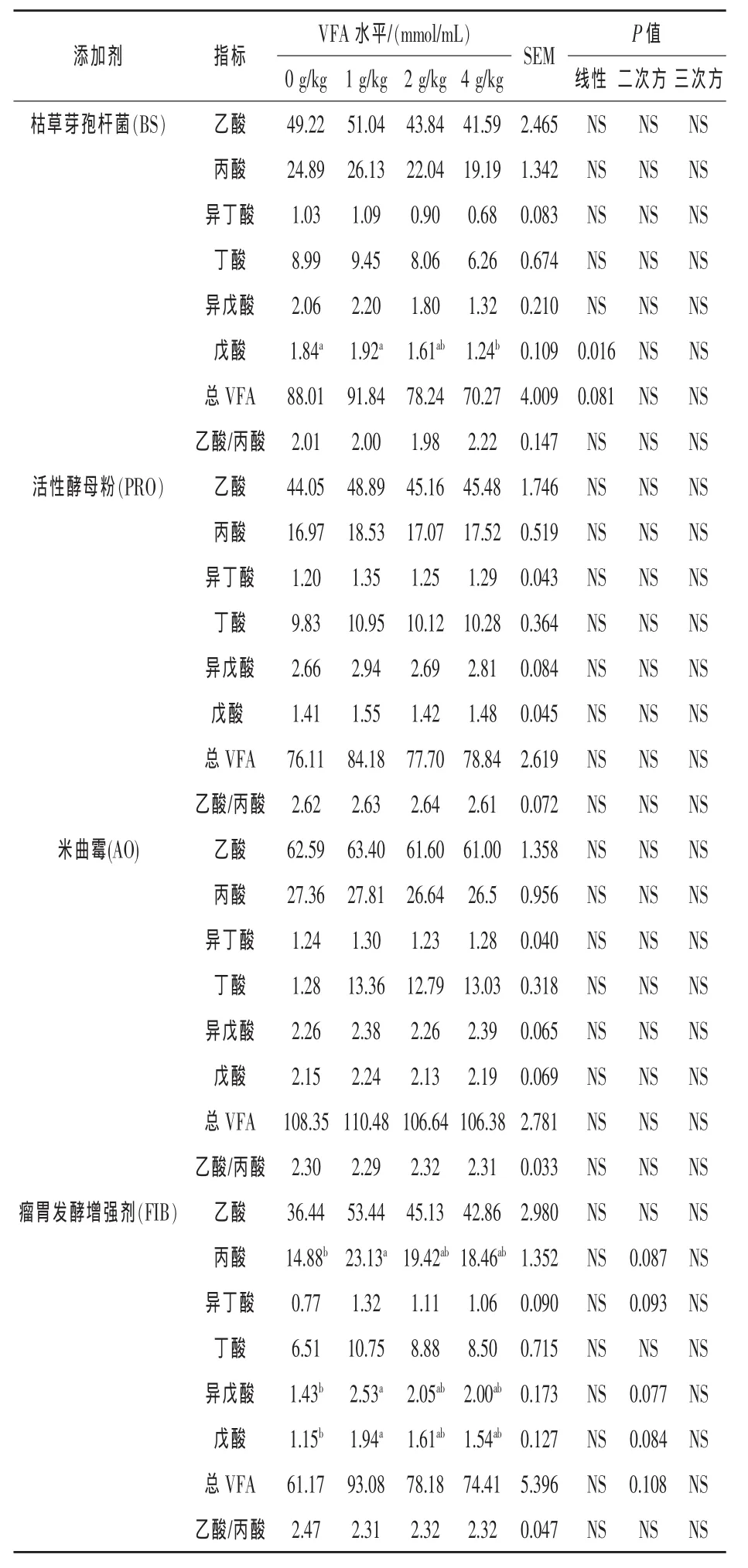
表5 不同剂量的枯草芽孢杆菌、活性酵母粉、米曲霉、瘤胃发酵增强剂对体外批次培养24 h瘤胃液中VFA的影响
3 讨论
3.1 四种饲料添加剂对体外产气量的影响 体外产气量可以反映出瘤胃中微生物的降解活性和饲料降解率(Menke 和 Steingass,1988),能有效预测体内干物质的代谢能及降解率,相关系数达0.98(Menke 等,1979)。 孙华(2012)分别以羊草、苜蓿、玉米青贮作为饲料底物,添加米曲霉培养物通过体外产气试验发酵24 h后发现,添加米曲霉培养物处理组的产气量、潜在产气量和有机物消化率显著提高。邓露芳等(2008a)通过添加纳豆枯草芽孢杆菌的体外产气试验证明,与对照组相比,添加纳豆枯草芽孢杆菌处理组的产气量提高11.89%(P<0.05)。本试验研究表明,枯草芽孢杆菌对72h总产气量影响不显著,4 g/kg剂量的活性酵母粉、米曲菌和瘤胃发酵增强剂均提高了72 h总产气量。
3.2 四种饲料添加剂对体外营养物质降解率的影响 干物质降解率是反映饲料被动物所利用程度的重要指标,降解率越高,饲料的可利用程度就越高(赵祥等,2005),其在一定程度上反映了饲料营养成分在动物体内的降解情况。Gomez-Alarcon等(1990)研究表明,米曲霉提高了纤维在瘤胃中的降解率。黄帅等(2010)研究表明,日粮中添加0.04%DM和0.08%DM的米曲霉显著提高了日粮的IVDMD、DCP、DNDF 和DADF。米曲霉培养物具有高纤维素酶活性(Di Francia等,2008),纤维素酶可以增加真菌假根的渗透,促进植物组分与真菌的接触,从而促进纤维成分的消化(Chang等,1999)。此外,米曲霉培养物能够增加纤维分解菌的数量,进而促进纤维物质的降解(Gomez-Alarcon等,1990)。就纤维的降解性而言,真菌型的添加剂比细菌型的添加剂效果更佳。本试验结果表明,枯草芽孢杆菌、活性酵母粉和瘤胃发酵增强剂均显著提高了体外培养36 h的IVDMD,枯草芽孢杆菌对DNDF、DADF和DCP影响不显著,1 g/kg剂量组的米曲菌显著提高了DNDF和 DADF;1、4 g/kg的活性酵母粉显著增加了DADF,1 g/kg的瘤胃发酵增强剂显著降低了DADF。
3.3 四种饲料添加剂对瘤胃体外培养发酵液中NH3-N的影响 瘤胃NH3-N是一个动态平衡过程,能够综合反映瘤胃内特定饲粮组成条件下蛋白质降解及微生物对NH3-N利用情况。一方面饲料被瘤胃微生物分解产生NH3-N;另一方面瘤胃中的微生物利用降解产生的NH3-N与酮酸合成微生物蛋白质(刘彩娟等,2011)。NH3-N是维持微生物生长和蛋白质合成的重要氮源。孙华(2012)研究表明,米曲霉培养物显著降低了精粗料分别为玉米和玉米青贮日粮的瘤胃NH3-N浓度,这与本试验研究结果一致。本试验结果表明,1、4 g/kg 的活性酵母粉,2、4 g/kg 的米曲霉,1、2 g/kg的瘤胃发酵增强剂可显著降低NH3-N的浓度。瘤胃中NH3-N浓度在6~30 mg/dL最适合瘤胃微生物发酵(姜旭明等,2009;Ghorbani等,2002),本试验NH3-N浓度均在此范围内,说明其能满足瘤胃微生物的生长需要。
3.4 四种饲料添加剂对瘤胃体外培养挥发性脂肪酸的影响 瘤胃液VFA是反刍动物碳水化合物在瘤胃中降解的产物,其含量和组成是反映瘤胃消化代谢能力的重要指标。乙酸是反刍动物乳腺合成乳脂中脂肪酸的重要底物(冯仰廉,2004),丙酸是糖异生的主要前体物质。Higginbotham等(2004)研究表明,米曲霉培养物的添加并未影响瘤胃液中的VFA,与本试验中添加米曲霉培养物的研究结果一致。与邓露芳等 (2008b)、Peng等(2012)、Sun 等(2013)的研究结果不同。 本试验结果表明,添加枯草芽孢杆菌并未影响瘤胃液中乙酸、丙酸的水平,但随着添加剂量的增加,戊酸和总VFA的水平有线性降低的趋势,这可能是不同枯草芽孢杆菌菌种间的差异造成的。本试验结果表明,活性酵母粉对瘤胃液中VFA的生成无显著影响;添加1 g/kg的瘤胃发酵增强剂时,丙酸、异戊酸、戊酸浓度显著增加。
4 结论
4.1 添加4 g/kg的活性酵母粉、米曲霉和瘤胃发酵增强剂显著提高了体外产气量,在不改变瘤胃发酵类型且未对瘤胃发酵产生负面影响的情况下,添加四种反刍动物饲料添加剂均不同程度提高了饲料营养物质降解率。
4.2 除枯草芽孢杆菌对NH3-N浓度无显著影响外,活性酵母粉、米曲菌和瘤胃发酵增强剂均不同程度降低了NH3-N浓度。
4.3 活性酵母粉和米曲菌并未对瘤胃VFA产生显著影响,1 g/kg剂量组的枯草芽孢杆菌显著增加了戊酸浓度,1 g/kg的瘤胃发酵增强剂显著增加了丙酸、异戊酸和戊酸浓度。
[1]丁洪涛,夏冬华,秦珊珊,等.枯草芽孢杆菌对奶牛体外瘤胃发酵的影响[J].饲料研究,2012,1:57 ~ 59.
[2]邓露芳,王加启,卜登攀,等.饲用微生物评价研究进展[J].中国农学通报,2009,25(23):7 ~ 12.
[3]邓露芳,王加启,姜艳美,等.产气法评价纳豆芽孢杆菌对瘤胃液体外发酵的影响[J].西北农林科技大学学报:自然科学版,2008a,36(9):33 ~ 39.
[4]邓露芳,王加启,姜艳美,等.纳豆芽孢杆菌对瘤胃微生物发酵的影响[J].畜牧兽医学报,2008b,39(8):1062 ~ 1068.
[5]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.241~336.
[6]黄帅,苗树君,张静芝,等.米曲霉对奶牛瘤胃降解率及日粮表观消化率的影响[J].中国牛业科学,2010,36(6):23 ~ 26.
[7]姜旭明,齐智利,齐德生,等.不同蛋白质来源的日粮对瘤胃发酵特性及蛋白质消化的影响[J].草业科学,2009,26(1):74 ~ 80.
[8]刘彩娟,孙满吉,孙金艳,等.饲粮中添加复合益生菌对奶牛瘤胃发酵及纤维素酶活的影响[J].动物营养学报,2011,23(5):821 ~ 827.
[9]栾广春,王加启,卜登攀,等.纳豆芽孢杆菌对泌乳期奶牛产奶量、牛奶品质的影响[J].东北农业大学学报,2008,9:58 ~ 61.
[10]孙华.米曲霉培养物与蛋氨酸羟基类似物对奶牛瘤胃发酵和泌乳性能的影响:[博士学位论文][D].温州:浙江大学,2012.
[11]沈英,宋正河,杨红建,等.基于虚拟仪器技术的饲料体外发酵产气自动记录系统的研制[J].农业工程学报,2007,22(12):159 ~ 163.
[12]王加启.反刍动物试验研究方法[M].北京:现代教育出版社,2011.
[13]赵祥,董宽虎,王永新,等.不同精粗比全混合饲料在绵羊瘤胃内的降解动态[J].草业学报,2005,14(3):9 ~ 11.
[14]Association of Official Analytical Chemists (AOAC).2000.Official methods of analysis,17th ed, Arlington,VA.
[15]Chang J S,Harper E M,Calza R E.Fermentation extract effects on the morphology and metabolism of the rumen fungus Neocallimastix frontalis EB188[J].Journal of applied microbiology,1999,86(3):389 ~ 398.
[16]Di Francia A,Masucci F,De Rosa G,et al.Effects of Aspergillus oryzae extract and a Saccharomyces cerevisiae fermentation product on intake,body weight gain and digestibility in buffalo calves[J].Animal Feed Science and Technology,2008,140(1):67 ~ 77.
[17]Ghorbani G R,Morgavi D P,Beauchemin K A,et al.Effects of bacterial direct-fed microbials on ruminalfermentation,blood variables,and the microbial populations of feedlot cattle[J].Journal of animal science,2002,80(7):1977 ~ 1985.
[18]Gomez-Alarcon R A,Dudas C,Huber J T.Influence of cultures of Aspergillus oryzae on rumen and total tract digestibility of dietary components[J].J Dairy Sci,1990,73:703 ~ 710.
[19]Groot J C,Cone J W,Williams B A,et al.Multiphasic analysis of gas production kinetics for in vitro fermentation of ruminant feeds[J].Animal Feed Science and Technology,1996,64(1):77 ~ 89.
[20]Higginbotham G E, Santos J E,Juchem S O,et al.Effect of feedingAspergillusoryzae extract on milk production and rumen parameters[J].Livestock production science.2004,86(1): 55 ~ 59.
[21]Makkar H P S,Becker K.Purine quantification in digesta from ruminants by spectrophotometric and HPLC methods[J].British Journal of Nutrition,1999,81(2):107 ~ 112.
[22]Menke K H,Steingass H.Estimation of the energetic feed value obtained from chemical analysis and gas production using rumen fluid[J].Animal Research,1988,28:7 ~ 55.
[23]Menke K H,Raab L,Salewski A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J].The Journal of Agricultural Science,1979,93(1):217 ~ 222.
[24]Peng H,Wang J Q,Kang H Y,et al.Effect of feeding Bacillus subtilis natto fermentation product on milk production and composition,blood metabolites and rumen fermentation in early lactation dairy cows[J].J Anim Physiol Anim Nutr,2012,96(3):506 ~ 12.
[25]Sun P,Wang J Q,Deng L F.Effects of Bacillus subtilis natto on milk production,rumen fermentation and ruminal microbiome of dairy cows[J].Animal,2013,7(2):216 ~ 222.
[26]Van Soest P J,Robertson J B,Lewis B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].Journal of dairy science,1991,74(10):3583 ~ 3597.

