小鼠原发性胆汁性肝硬化与调节T细胞的相关性
潘 盈,刘 斌,张奉春
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,北京 100730)
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是一种慢性进展性疾病,主要表现为以肝内小胆管进行性、非化脓性炎症为特征的慢性胆汁淤积,肝内胆管受损,胆汁分泌减少,肝内毒物蓄积,肝细胞受损害,进一步可发展至肝纤维化与肝硬化甚至肝功能衰竭。目前病因不明,90%~95%的患者血清中出现抗线粒体抗体(antimitochondrial antibodies,AMA),同时受损胆管T淋巴细胞大量浸润,提示自身免疫在其发病机制中起重要作用。近年来研究表明,调节T细胞(regulatory T cell,Treg)及其重要的调节因子转化生长因子β1(transforming growth factor-β1,TGF-β1)与自身免疫性疾病的发病有关。本研究通过建立聚肌胞苷酸诱导产生PBC小鼠模型,通过酶联免疫吸附分析(enzyme-linked immunosorbent assay,ELISA)、免疫组化及免疫印迹法测定PBC小鼠模型中Treg细胞及其相关蛋白表达、TGF-β1含量,探索Treg细胞及TGF-β1与PBC发病的关系。
对象与方法
对象
6~8周雌性C57BL/6J小鼠购自中国医学科学院医学动物研究所,室温22 ℃,55%湿度,12 h昼/夜交替条件下,给以充足的标准实验饲料和水饲养。依据实验室操作指南,所有动物均受到良好待遇,本研究经北京协和医学院北京协和医院动物伦理委员会通过。聚肌胞苷酸(poly I∶C)购自Invivogen公司(San Diego,USA)。溶于无菌生理盐水中,浓度为1 mg/ml,-20 ℃冰箱保存。雌性C57BL/6J小鼠poly I∶C 5 mg/kg腹腔注射,每周2次,连续24周。对照组雌性C57BL/6小鼠依据poly I∶C注射实验设计给予生理盐水腹腔注射。Poly I∶C或生理盐水给药后,不同时间(第8、16、24周)颈脱位法处死C57BL/6J小鼠(处理前禁食1 d)。采集小鼠血清、肝脏和脾脏,肝脏10%甲醛固定或快速冷冻进行组织学评价,脾脏用于淋巴细胞提取分离。小鼠血清及肝脏组织标本储存-80 ℃冰箱备用。
测定TGF-β1:对存放于-80 ℃冰箱的第8、16、24周正常小鼠及PBC小鼠的冰冻血清(每组各有6个样本)分别采用ELISA法测定TGF-β1含量(OD值),比较各组小鼠OD值。
检测指标
PBC小鼠模型需通过生化方法检测肝脏生化指标,包括天门冬酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine transaminase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、总胆红素(total bilirubin,TB),并通过间接免疫荧光及ELISA法检测抗线粒体抗体/抗线粒体M2亚型抗体(antimitochondrial antibodies/antimitochondrial M2 antibodies,AMA/M2),并对肝脏组织行常规病理染色。
PBC小鼠模型血清、肝脏组织进行常规病理检测,并分别对CD4、CD8、CK7进行免疫组化染色。对第8、16、24周正常小鼠及PBC小鼠血清采用ELISA法测定TGF-β1含量,制备肝脏组织匀浆免疫组化法及免疫印迹法测定FOXP3表达。
FOXP3表达测定:(1)免疫组化法:选取常温放置的第8、16、24周正常小鼠和第8、16、24周PBC小鼠的石蜡包埋的肝脏标本,每组选取2~3只小鼠,将石蜡包埋的组织标本切片,主要观察汇管区、淋巴细胞和着色的FOXP3+细胞。第8、16、24周正常小鼠肝脏石蜡切片未见阳性细胞,第8、16、24周PBC小鼠肝脏石蜡切片可见少量阳性细胞。选取10个汇管区,在400倍镜下对淋巴细胞及阳性细胞进行计数(图1)。(2)免疫印迹法:选取存放于-80 ℃冰箱的8、16、24周正常小鼠和8、16、24周PBC小鼠的冻存肝脏标本,每组选取1只小鼠,采用免疫印迹法检测FOXP3表达。
统计学分析
所有资料应用SPSS 15.0进行数据统计及分析,两组间比较采用t检验。P<0.05为差异存在统计学意义。
结 果
PBC小鼠模型鉴定
肝脏生化指标:第8、16、24周PBC小鼠AST均高于正常对照组小鼠,差异有统计学意义(P<0.05),第16周PBC小鼠ALT高于对照组小鼠,差异有统计学意义(P<0.05),第16、24周PBC小鼠ALP及TB均高于对照组小鼠,差异有统计学意义(P<0.05)。其余指标PBC小鼠与同期正常对照组小鼠比较,差异无统计学意义(表1)。
AMA/M2:间接免疫荧光及ELISA法检测对照组小鼠均为阴性,间接免疫荧光检测PBC小鼠,第8周时50%小鼠AMA/M2阳性,第16周时66.7%小鼠AMA/M2阳性,第24周时100%小鼠AMA/M2阳性。ELISA检测PBC小鼠血清,第8周时50%小鼠AMA/M2阳性,第16周时83.3%小鼠AMA/M2阳性,第24周时100%小鼠AMA/M2阳性。
肝脏病理:对照组小鼠肝脏组织无明显异常(图1A~C)。PBC模型小鼠第8周可见小胆管周围淋巴细胞浸润,部分切片可见单核细胞,胆管上皮细胞变性坏死,基底膜不完整(图1D),第16周可见汇管区扩大,肝细胞肿胀明显,淋巴细胞浸润,少数切片可见小叶间胆管增生(图1E),第24周可见肝脏细胞坏死增多,周围淋巴细胞浸润,小胆管增生明显,没有观察到明显的纤维间隔形成(图1F)。根据PBC患者的分期,PBC小鼠模型主要分期在1期和2期。
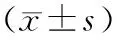
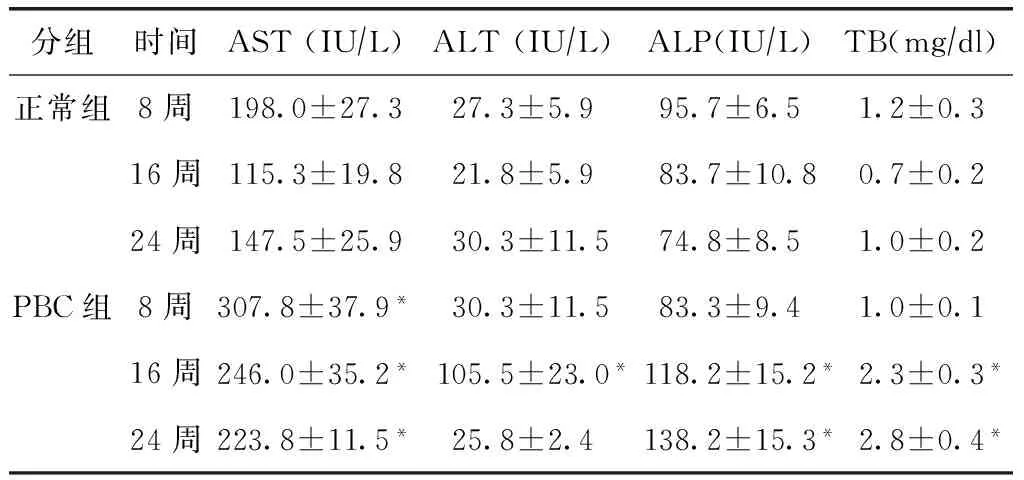
分组时间AST(IU∕L)ALT(IU∕L)ALP(IU∕L)TB(mg∕dl)正常组8周198.0±27.327.3±5.995.7±6.51.2±0.316周115.3±19.821.8±5.983.7±10.80.7±0.224周147.5±25.930.3±11.574.8±8.51.0±0.2PBC组8周307.8±37.9*30.3±11.583.3±9.41.0±0.116周246.0±35.2*105.5±23.0*118.2±15.2*2.3±0.3*24周223.8±11.5*25.8±2.4138.2±15.3*2.8±0.4*
与正常组同时间点比较,*P<0.05
TGF-β1含量
第16周PBC小鼠与24周PBC小鼠之间TGF-β1含量存在显著差异(P=0.041),其余各组小鼠之间均无显著差异(表2、3)。
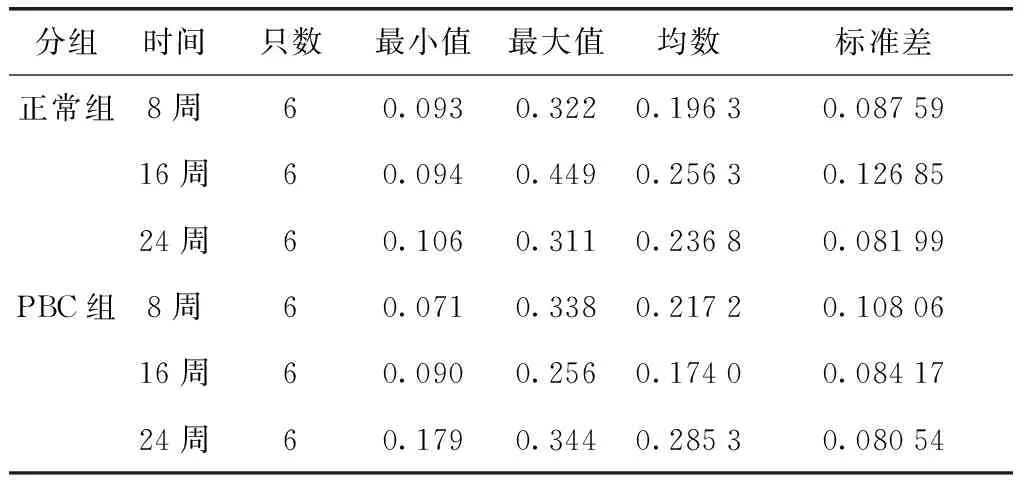
表2 各组小鼠TGF-β1含量(OD值)Table 2 Content of TGF-β1 in each group of mice (OD value)
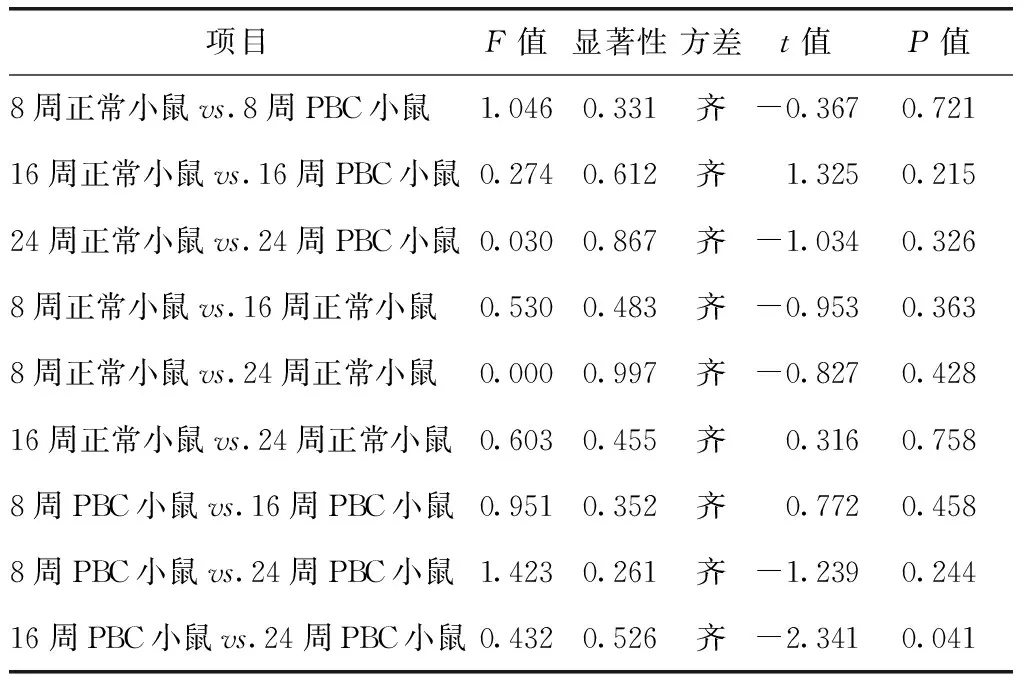
表3 各组小鼠TGF-β1含量统计检验结果Table 3 Statistical results of content of TGF-β1 between each group of mice
FOXP3表达
免疫组化法:各组正常小鼠汇管区淋巴细胞数目均很少,在0~5个之间,阳性细胞数均为0。各组PBC小鼠阳性细胞数在0~4个之间(表4)。第8、16、24周PBC小鼠及其对照小鼠的汇管区淋巴细胞数存在显著差异(P=0.004,0.000,0.000);另外,第16、24周PBC小鼠之间的汇管区淋巴细胞数存在显著差异(P=0.006)。第16、24周PBC小鼠与同时期对照小鼠汇管区染色成阳性的细胞数存在显著差异(P=0.032,0.032)。余各组汇管区淋巴细胞数及阳性细胞数均无显著差异。
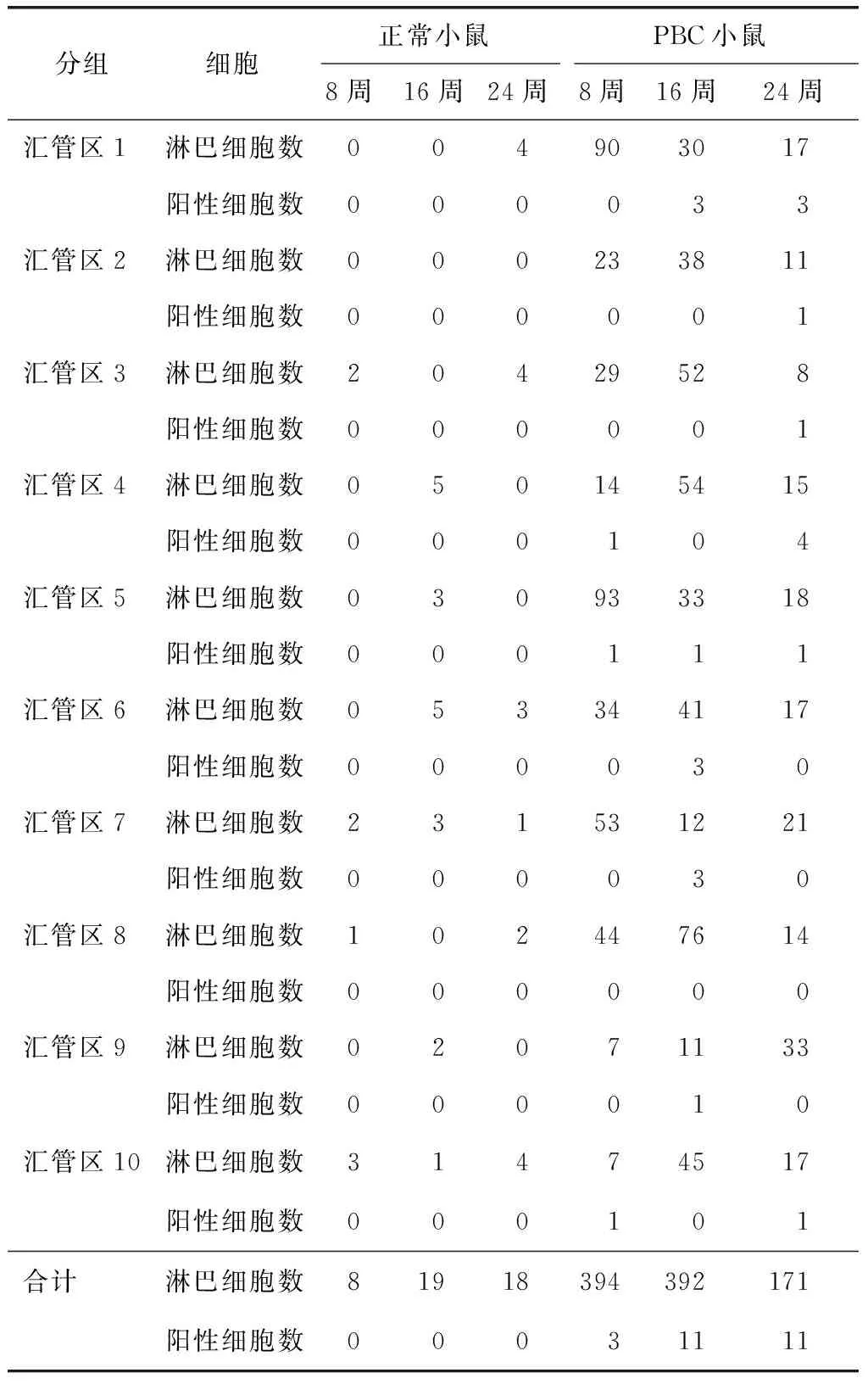
表4 两组小鼠汇管区淋巴细胞及阳性细胞计数Table 4 The number of lymphocytes and FOXP3+ Treg ceclsin portal areas of each group of mice (个)
免疫印迹法:选取存放于-80 ℃冰箱的8、16、24周正常小鼠和8、16、24周PBC小鼠的冻存肝脏标本,每组选取1只小鼠,采用免疫印迹法检测FOXP3表达(图2)。
每块胶上6个条带,从左往右依次为8、16、24周正常小鼠(图中表示为N8、N16、N24)和8、16、24周PBC小鼠(图中表示为P8、P16、P24)。使用的内参鼠源β-actin相对分子质量为43 000,待测FOXP3相对分子质量为47 000,理论上应该在50~53 000的位置观察到。内参β-actin可以在图中清晰地看到,各条带没有明显差异,表明各条带加样量接近,但此时FOXP3并没有在相应位置出现条带。
讨 论
PBC是一种特异性自身免疫慢性肝病,主要特点表现为慢性肝内小胆管缺失,伴胆汁淤积和进行性肝纤维化[1]。本文采用6~8周雌性C57BL/6J小鼠腹腔注射poly I∶C的方法,建立PBC小鼠模型。本动物模型在肝脏生化、自身抗体AMA、肝脏病理改变和免疫组化等方面与人类PBC早期变化极为相似。
Papiernik等[2]证实,天然CD4+CD25+Treg细胞产生于胸腺,然后迁移到外周发挥作用,CD4+CD25+胸腺细胞与外周的CD4+CD25+Treg细胞一样,表现出对经由T细胞受体(T cell receptor,TCR)的抗原刺激呈低反应性,并且显示抑制其他细胞增殖的能力。CD4+CD25+Treg细胞除了在胸腺产生以外,还可以在未成熟的树突状细胞中经IL-10、IFN-α、TGF-β或者低剂量抗原诱导下由外周CD4+CD25-T细胞转变而来,该类细胞被称为诱导的CD4+CD25+Treg细胞[3]。诱导产生的Treg细胞的抑制功能主要通过产生抑制性细胞因子IL-10和TGF-β得以实现。FOXP3为Treg细胞内特异标记物。FOXP3也是CD4+CD25+Treg细胞发育及获得功能的重要转录因子。近年来研究表明,Treg及其重要的调节因子TGF-β1与自身免疫性疾病的发病有关。FOXP3转录因子突变的Scury小鼠模型出现了AMA抗体、肝脏汇管区淋巴细胞浸润、胆管损伤等类似PBC的改变,小鼠模型血清中TNF-α、INF-γ、IL- 6、IL-12、IL-23及肝脏组织中编码上述细胞因子的mRNA均增高[4]。说明CD4+CD25+Treg细胞在PBC发病中发挥着重要的作用。
天然Treg发挥功能需要TGF-β信号。TGF-β是一类分泌型同源二聚体蛋白,调节细胞的增殖、分化、移行、调亡等过程。在适当刺激下,天然Treg细胞可分泌TGF-β,而且在细胞膜表面高表达TGF-β1[5]。Treg活化后其高表达的膜型TGF-β才是介导抑制功能的主要分子,可能与效应细胞表面的TGF-β受体结合发挥功能[6]。分泌型TGF-β可能主要促进Treg的扩增[7],对Treg的功能影响不大。另外,CD4+CD25+Treg细胞通过自分泌和(或)旁分泌受体-配体作用机制,分泌的TGF-β与其自身细胞表面的TβRⅡ结合,从而在正常情况下处于失能状态,T细胞受体刺激也不能诱导其IL-2表达,但可引起效应T细胞表面TβRⅡ上调。因此CD4+CD25+Treg细胞分泌的TGF-β可与活化的效应T细胞结合,从而传递细胞接触-依赖性抑制信号[8]。
根据肝脏病理观察,PBC小鼠模型主要分期在1期和2期。第8、16、24周PBC小鼠胆管周围均有明显的淋巴细胞浸润。而24周PBC小鼠淋巴细胞数比16周明显减少,同时ELISA测得24周PBC小鼠TGF-β1含量显著高于16周PBC小鼠,结果相吻合。在肝脏纤维化中,TGF-β起重要作用,目前认为导致细胞外基质蛋白沉积增加的最主要细胞族是肝星形细胞(hepatic stellate cells,HSC),HSC通过旁分泌、自分泌途径增加TGF-β生成,TGF-β又参与HSC活化,导致细胞外基质蛋白生成增多,降解减少,发生肝纤维化[9]。提示从这一时段开始,PBC小鼠模型从以炎症为主向以纤维化为主转变。
本实验采用FOXP3作为Treg的标记物,阳性细胞的数目反映了Treg细胞的数目。PBC小鼠肝脏中出现Treg细胞,且16周和24周PBC小鼠与正常对照组存在统计学差异,后期肝脏Treg细胞数目多于正常,推测与炎性部位Treg细胞的免疫抑制功能有关。同时期外周TGF-β1增多,TGF-β1可能对Treg细胞的增生起促进作用。
同组实验人员曾使用流式细胞仪对各组小鼠新鲜肝脏标本进行检测,PBC小鼠模型肝脏中CD4+CD25+FOXP3+T淋巴细胞比例较正常对照组明显升高,显著有统计学意义(P<0.05)。研究发现,PBC患者外周血CD4+CD25+Treg细胞的数目低于正常人[10]。在自身免疫性疾病中,显示自身免疫性疾病受累器官或靶器官中FOXP3+Treg细胞比例增加[11]。推测PBC患者Treg细胞分布可能因Treg细胞从外周血聚集或迁移至炎性部位所致。
同组实验人员在小鼠模型肝脏检测TGF-β1含量,发现8、16、24周PBC小鼠模型组均高于同时期正常对照组,差异具有统计学意义(P均<0.05)。TGF-β对Treg细胞功能的发挥有重要作用,并且Treg本身可以分泌TGF-β,二者存在复杂的相互作用。
目前,对于血清TGF-β来源的研究不是很清楚。有报道显示,用ELISA方法检测类风湿关节炎患者血浆TGF-β1水平,发现高于正常人。但在某些自身免疫性疾病中,TGF-β1水平并不增高[12]。本实验ELISA法测得各组PBC小鼠模型血清TGF-β1与正常组差异无显著意义。
免疫印迹法在各组中均没有测出FOXP3,因流式细胞仪可测得肝脏中存在Treg细胞,分析主要原因可能为肝脏组织中含有Treg细胞数目太少。如果使用RT-PCR法,有可能测出其含量。
(本文图1、2见插页Ⅱ)
[1]Hirschfield GM,Gershwin ME.The immunobiology and pathophysiology of primary biliary cirrhosis[J].Annu Rev Pathol,2013,8:303-330.
[2]Papiernik M,de Moraes ML,Pontoux C,et al.Regulatory CD4 T cells:expression of IL-2R alpha chain,resistance to clonal deletion and IL-2 dependency[J].Int Immunol,1998,10:371-378.
[3]Sakaguchi S.The origin of FOXP3-expressing CD4+regulatory T cells:thymus or periphery[J].J Clin Invest,2003,112:1310-1312.
[4]Zhang W,Sharma R,Ju S,et al.Deficiency in regulatory T cells results in development of antimitochondrial antibodies and autoimmune cholangitis[J].Hepatology,2009,49:545-552.
[5]Nakamura K,Kitani A,Strober W.Cell contact-dependent immunosuppression by CD4+CD25+regulatory T cells is mediated by cell surface-bound transforming growth factor-β1[J].J Exp Med,2001,194:629- 644.
[6]Annunziato F,Cosmi L,Liotta F,et al.Phenotype,localization,and mechanism of suppression of CD4+CD25+human thymocytes[J].J Exp Med,2002,196:379-387.
[7]Ghiringhelli F,Punig PE,Roux S,et al.Tumor cells convert immature myeloid dendritic cells into TGF-β-secreting cells inducing CD4+CD25+regulatory T cell proliferation[J].J Exp Med,2005,202:919-929.
[8]Viglietta V,Baecher-Allan C,Weiner HL,et al.Loss of functional suppression by CD4+CD25+regulatory T cells in patients with multiple sclerosis[J].J Exp Med,2004,199:971-979.
[9]Ramadori G,Armbrust T.Cytokines in the liver[J].Eur J Gastroenterol Hepatol,2001,13:777-784.
[10] Liu B,Shi XH,Zhang FC,et al.Antimitochondrial antibody-negative primary biliary cirrhosis:a subset of primary biliary cirrhosis[J].Liver Int,2008,28:233-239.
[11] Sasaki M,Ikeda H,Sawada S,et al.Naturally-occurring regulatory T cells are increased in inflamed portal tracts with cholangiopathy in primary biliary cirrhosis[J].J Clin Pathol,2007,60:1102-1107.
[12] Eksioglu-Demiralp E,Direskeneli H,Akoglu T.Levels of serum Transforming growth factor beta1 do not increase in Behcet’ disease,in contrast to Rheumatoid arthritis[J].J Rheum,1999,26:1010-1011.

