托珠单抗对全身型幼年特发性关节炎CD4、CD8+T/CD19+ B细胞及免疫球蛋白表达的调控
李洪伟,曾华松
(广州市妇女儿童医疗中心过敏免疫风湿病科, 广州 528000)
ChinJAllergyClinImmunol,2016,10(4):357- 364
全身型幼年特发性关节炎是一组具有全身症状(弛张高热、皮疹、肝脾淋巴结肿大等)以及多种炎症指标(C反应蛋白、铁蛋白等)升高的慢性关节炎症,可并发巨噬细胞活化综合征导致死亡[1]。全身型幼年特发性关节炎的传统治疗包括口服糖皮质激素、甲氨蝶呤、硫酸羟氯喹等,但疗效较差,大剂量激素使用可以控制病情进展,但激素不良反应在治疗后期却不断显现[2]。
目前认为,全身型幼年特发性关节炎的发病主要由于细胞免疫功能紊乱,引起多种炎症因子[肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)- 6、IL- 1β等]的异常分泌[3]。而大量研究数据表明,IL- 6及其受体在全身型幼年特发性关节炎发病中起着重要的作用[4]。托珠单抗[5]是一种重组人源化抗人IL- 6受体单克隆抗体,由中国仓鼠卵巢(Cricetulus griseus,hamster,Chinese,CHO)细胞通过DNA重组技术制得。通过特异性的阻断IL- 6受体,降低Janus激酶(Janus kinase,JAK)/信号传导与转录激活因子(signal transducer and activator of transcription,STAT)3激活,可下调辅助性T 细胞17(T helper cell 17, Th17)细胞的生成,有利于缓解关节症状以及下调炎症因子(TNF-α、IL- 17等)的表达,从而控制病情进展。目前欧洲等发达国家已经有关于托珠单抗治疗全身型幼年特发性关节炎的大样本的临床研究[6- 8],而中国的研究主要关注成人类风湿关节炎[9],儿童方面资料十分匮乏,大部分地区的医院缺乏这类药物的使用数据。本项目旨在从免疫学角度,研究托珠单抗联合缓解病情抗风湿药(disease-modifying anti-rheumatic drugs,DMARDs)如何调控机体的细胞、体液免疫功能,从而降低炎症指标,缓解病情,为中国广大儿科医师提供一些指导建议。
对象和方法
研究对象
复发和排除标准:病程中再次发热或发热时间≥4 d(体温>37.5 ℃),C反应蛋白、红细胞沉降率、铁蛋白升高,无明显感染或感染控制后可认为复发。需排除有复发性的细菌性、支原体、病毒性、真菌性、分枝杆菌性或其他感染的病史或入选本研究时有活动性感染,骨髓细胞学检测血液性疾病,影像学发现肿瘤,TNF-α抑制剂治疗失败者或曾经接受过细胞消除疗法的患者。
研究方案获得本单位伦理委员会批准,受试对象均签署了书面知情同意书。
方法及观察指标
托珠单抗组给予甲氨蝶呤+糖皮质激素+托珠单抗,托珠单抗按体质量>30 kg、8 mg/kg,<30 kg、12 mg/kg,每两周一次返院注射,而对照组则给予甲氨蝶呤+糖皮质激素+安慰剂(维生素C),两组均观察症状缓解情况。
观察指标:对比治疗12周前后红细胞沉降率、C反应蛋白、白细胞、谷草转氨酶、谷丙转氨酶、铁蛋白、血脂、免疫球蛋白IgG、IgA、IgM、IgE和CD3+、CD4+、CD8+T、CD19+B、CD16+56-自然杀伤(natural killer,NK)细胞的变化。
统计学处理
结 果
受试者的基线资料
强大的整机设计开发能力体现在对数控机床进行模块化设计和研发上,使得公司有效缩短了涉及和试制周期,提高了产品更新换代的速度,能更好地把握市场机遇。一流的数控技术开发能力则给了公司通过合理、综合运用多种技术的手段去不断提升产品的系统性、自动化程度、加工精度、响应速度及智能化程度。先进的核心精密部件制造技术则是指公司自主加工工作移动结构、砂轮架主轴等核心部件时,选用质优材料,使用高精度机床配合合理的工艺进行精密加工或超精密加工。
托珠单抗组及对照组基本资料比较差异无统计学意义(P>0.05),可以进行对照试验,期间未有患者脱落(表1)。
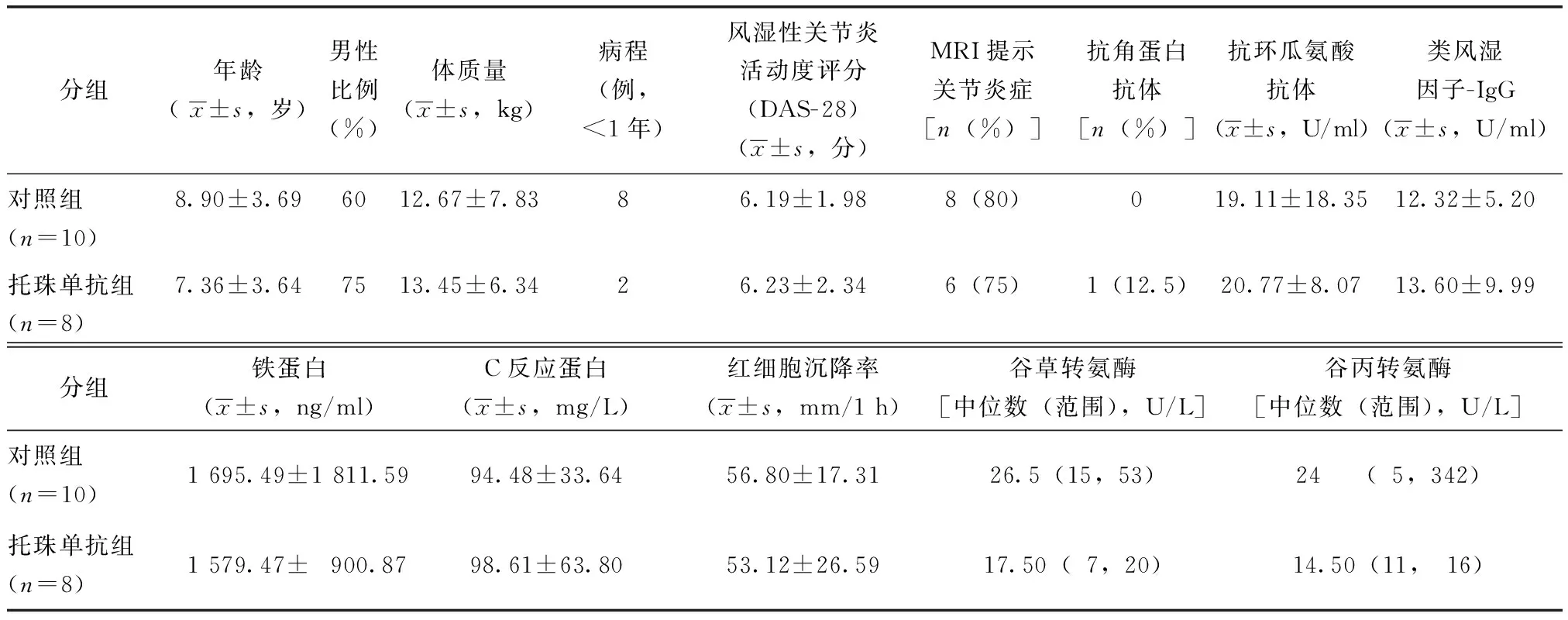
表1 两组患儿基线资料Table 1 Baseline data between two groups
疗效分析
托珠单抗对美国风湿病学会(American College of Rheumatology,ACR)评分影响:托珠单抗组12周治疗后,达到ACR20、ACR50、ACR70比例均大于对照组(表2)。
托珠单抗对炎症指标影响:见图1。托珠单抗组炎症指标C反应蛋白、铁蛋白、红细胞沉降率下降较对照组明显(图1A~C),并且从第2次用药后,炎症指标均可降至正常或低值,下降速度较对照组快,差异有统计学意义(P<0.05)。同时,12周治疗中,托珠单抗组每两周减激素4 mg至最低剂量隔天维持,期间未发现病情复发。对照组12周内,激素减量出现复发共6例,感染诱发2例。治疗12周内,托珠单抗组血红蛋白上升幅度明显高于对照组(图1E);托珠单抗组血小板浓度随着治疗时间呈上升趋趋势,其中2例甚至高出正常2~3倍,对照组则变化不大(图1F)。1例全身型幼年特发性关节炎继发巨噬细胞活化综合征使用阿达木单抗+激素+缓解病情抗风湿药后,红细胞沉降率、C反应蛋白在初始降低后,一直呈现上升趋势,而使用托珠单抗+激素+缓解病情抗风湿药后,则逐渐降至正常,激素逐渐减量无出现反跳(图2)Kruskal-Wallis检验示P<0.05,差异有统计学意义;白细胞计数Kruskal-Wallis检验P>0.05,差异无统计学意义。
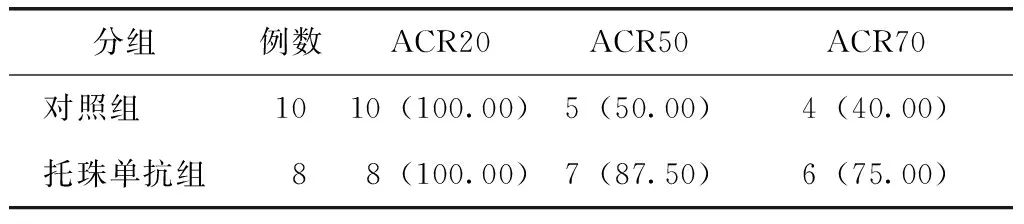
表2 两组全身型幼年特发性关节炎患儿治疗12周后达到ACR20、ACR50、ACR70比例Table 2 The proportion of ACR30, ACR50, ACR70 was higher in the Tocilizumab group than the control group after 12 weeks treatment [例(%)]
ACR:美国风湿病学会
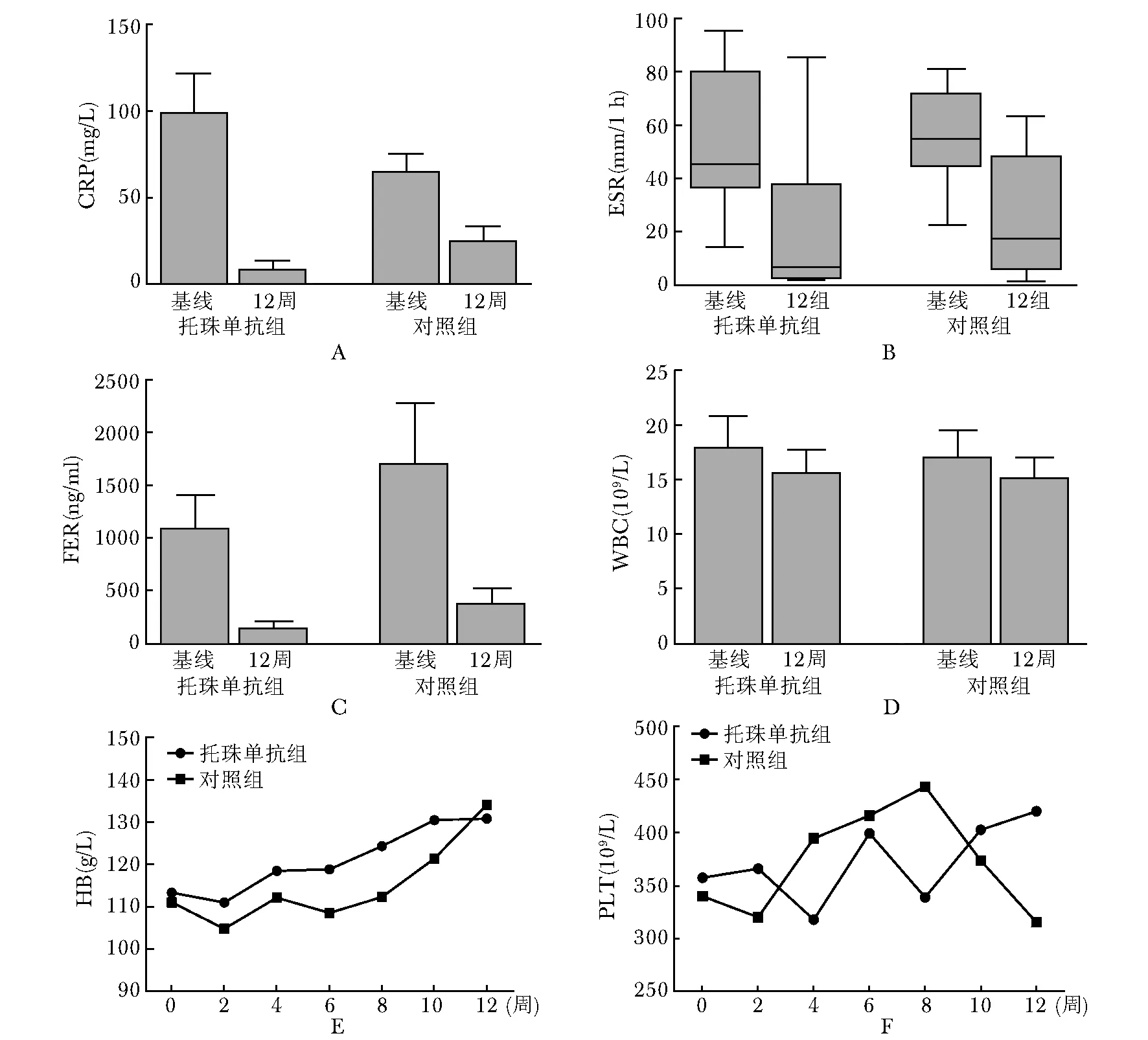
图1两组全身型幼年特发性关节炎患儿治疗12周前后炎症指标变化情况
Fig1Change of inflammation index between two groups of systemic juvenile idiopathic arthritis before and after 12 weeks of treatment
A:C反应蛋白(CRP);B:红细胞沉降率(ESR);C:铁蛋白(FER);D:白细胞(WBC);E:血红蛋白(HB);F:血小板(PLT)
托珠单抗对免疫指标影响:托珠单抗组治疗12周后IgG、IgM、IgA、IgE及CD19+B细胞较对照组下降明显(表3),并低于基线水平(P<0.05);CD3+、CD8+比例较基线上升,CD4+T、CD19+B降低,K-W检验差异有统计学意义(P<0.05),对照组则无明显改变(P>0.05)。CD16+56-NK细胞两组均无明显变化(P<0.05)。
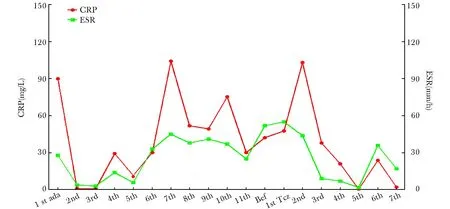
图2托珠单抗治疗1例全身型幼年特发性关节炎并发巨噬细胞活化综合征
Fig2A case of systemic juvenile idiopathic arthritis with macrophage activation syndrome (MAS) treated with tocilizumab
CRP:C反应蛋白; ESR:红细胞沉降率; Ada:阿达木单抗; TCZ:托珠单抗
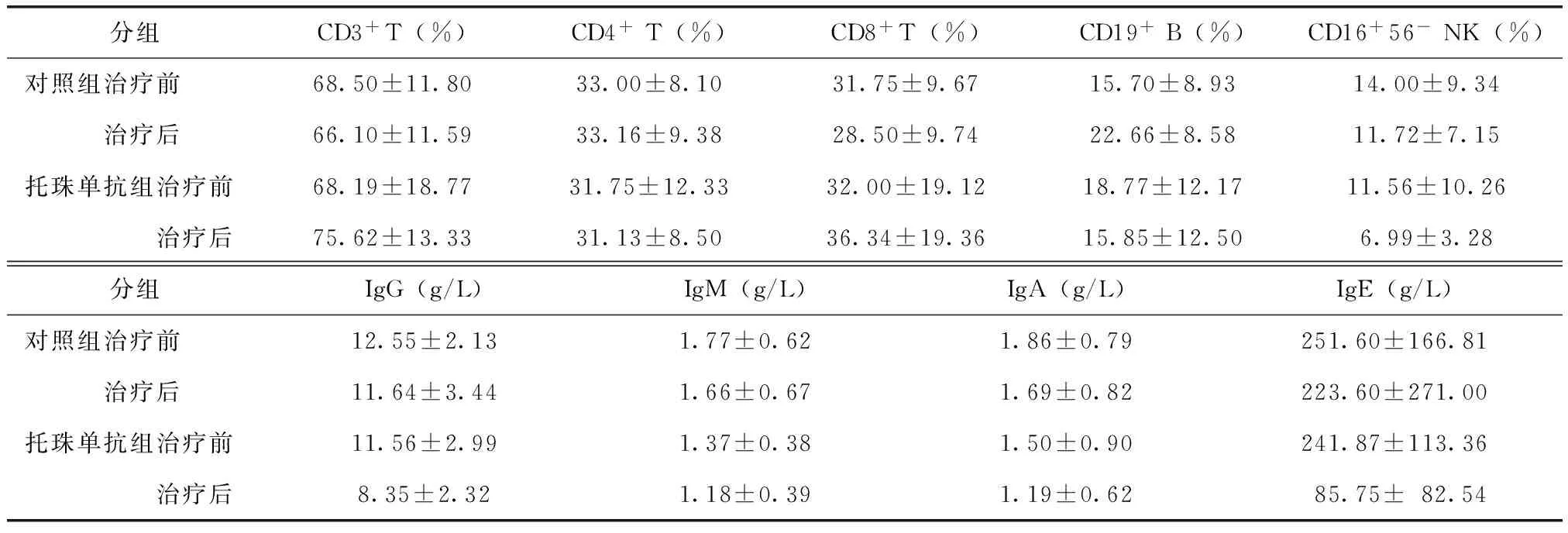
分组CD3+T(%)CD4+T(%)CD8+T(%)CD19+B(%)CD16+56-NK(%)对照组治疗前68.50±11.8033.00±8.1031.75±9.6715.70±8.9314.00±9.34 治疗后66.10±11.5933.16±9.3828.50±9.7422.66±8.5811.72±7.15托珠单抗组治疗前68.19±18.7731.75±12.3332.00±19.1218.77±12.1711.56±10.26 治疗后75.62±13.3331.13±8.5036.34±19.3615.85±12.506.99±3.28分组IgG(g/L)IgM(g/L)IgA(g/L)IgE(g/L)对照组治疗前12.55±2.131.77±0.621.86±0.79251.60±166.81 治疗后11.64±3.441.66±0.671.69±0.82223.60±271.00托珠单抗组治疗前11.56±2.991.37±0.381.50±0.90241.87±113.36 治疗后8.35±2.321.18±0.391.19±0.6285.75±82.54
不良事件评价
托珠单抗组(n=8)使用12周,6例(75%)出现较基线转氨酶轻度升高,2例(25%)出现上呼吸道感染,托珠单抗组1例注射2周后出现一过性转氨酶升高,转氨酶升高至正常2~3倍,加强护肝、托珠单抗减半量治疗后,恢复正常。对照组(n=10)2例(20%)出现转氨酶升高,4例(40%)出现上呼吸道感染。两组均未见严重并发症(三系减少、严重感染、恶性肿瘤等)发生。
血脂浓度升高:第12周时,与基线比较,托珠单抗组8例均出现血脂(包括空腹总胆固醇、低密度脂蛋白、高密度脂蛋白、三酰甘油)水平升高,高于正常值;对照组未出现明显的血脂变化。同时,托珠单抗组血小板浓度呈上升趋势,10~12周达到高峰,为基线值的2~3倍;对照组未见明显的上升峰。12周内均未观察到心血管事件、血栓形成的增加。
过敏和耐药:托珠单抗组治疗期间均未出现过敏(皮疹、腹泻、发热等)或耐药情况。
讨 论
全身型幼年特发性关节炎治疗一直是医学界的难点,传统的DMARDs及TNF-α拮抗剂对改善病情效果不佳,长期使用激素带来的毒副作用远大于其治疗效果。大量的论据表明,IL- 6在活动期全身型幼年特发性关节炎患儿的外周血中高表达,同时IL- 6相关的炎症蛋白如血清淀粉样蛋白A、C反应蛋白等,也明显升高,提示IL- 6在全身型幼年特发性关节炎的发病过程中起着重要作用。IL- 6作为一个炎症因子,能调控内环境功能,包括糖代谢和下丘脑垂体肾上腺素轴的调节。可以引起发热,诱导急性期蛋白和提高外周血白细胞计数[11]。托珠单抗可有效的拮抗IL- 6的游离型或膜型受体,阻断炎症信号的传递,从而控制病情,早在几年前该药在日本、美国已经批准用于全身型幼年特发性关节炎的治疗[12]。本研究显示IL- 6受体拮抗剂-托珠单抗对于全身型幼年特发性关节炎的治疗有效性、安全性及对免疫细胞异常激活具有调理作用。
研究结果显示,托珠单抗组ACR评分较对照组有明显的改善,治疗12周后,C反应蛋白(图1A)、红细胞沉降率(图1B)、铁蛋白(图1C)下降明显(P<0.05),并且在托珠单抗组治疗后(100%)第2周基本降至正常,发热、皮疹、关节痛等症状迅速缓解;对照组炎症指标下降相对缓慢,12周后仍有部分未能降至正常。同时,12周治疗中,托珠单抗组激素每2周减量1次,降至最低剂量隔天维持,期间未发现再燃、复发等情况。对照组12周内激素减量出现复发共6例(60%),感染诱发2例(20%)。已有不少研究表明,托珠单抗对联合DMARDs药物疗效不佳的全身型幼年特发性关节炎、TNF-α拮抗剂或抑制剂治疗无效的幼年特发性关节炎,仍有效果,并具有良好的安全性[13]。关于成人类风湿关节炎研究,托珠单抗单药治疗早期类风湿关节炎患者的疗效优于甲氨蝶呤单药治疗[14- 15]。
本研究显示,托珠单抗组对转氨酶的升高有一定的影响,其中有1例(12.5%)出现一过性的转氨酶升高,为正常值2~3倍,特别是同时服用甲氨蝶呤时更应注意,应定期检测肝功能情况,发现转氨酶异常时,应及时调整剂量,甚至停药。托珠单抗最主要的不良反应为感染,国内外均有不少研究显示,托珠单抗可导致中性粒细胞降低,但未表明与感染相关[16- 17]。本研究也发现托珠单抗组均存在血脂代谢异常,表现为三酰甘油、低密度脂蛋白等升高;同时,随着治疗时间的延长,血小板呈现上升的趋势,需密切观察血栓形成、心血管事件的发生。治疗必要时,给予降脂、抗凝药物。
托珠单抗不仅可以改善全身型幼年特发性关节炎的病情,同时还具有免疫调理作用。IL- 6参与B细胞的终末分化以及维持浆细胞的存活。记忆B细胞和浆细胞均高表达IL- 6受体,因此阻断IL- 6可抑制浆细胞的分化和存活以及免疫球蛋白的分泌。托珠单抗组治疗12周后免疫球蛋白IgA、IgG、IgM、CD19+B细胞计数均较基线明显降低(P<0.05),而对照组则无明显变化(P>0.05),提示阻断IL- 6可调节亢进的体液免疫,这与国外报道[18]一致。本研究尚未对托珠单抗组进行治疗后的关节MRI检测,但从患儿症状以及疼痛评分、关节肿胀的消退,可判断关节炎症较用药前有明显好转。
不少研究表明,IL- 6可促进T细胞分化,IL- 6受体拮抗后,降低抗CD3/CD28抗体生产,抑制抗CD3/CD28抗体诱导的CD4+T细胞分化[19]。托珠单抗组CD4+T、CD19+B细胞的比例较基线降低(P<0.05),CD8、CD3+T细胞比例较基线升高,提示托珠单抗对T细胞有一定的调节作用。同时IL- 6参与Th17细胞的分化,在 IL- 6、IL- 23 等炎症因子的刺激下,促进CD4+T细胞向Th17细胞分化,分泌大量IL- 17,从而诱导滑膜成纤维细胞表达大量核因子-κB受体活化因子配基(receptor activator of nuclear factor-κ B ligand,RANKL)蛋白导致关节破坏[20]。托珠单抗可通过阻断IL- 6下调T细胞表达,从而减轻关节破坏,这也有助于解释患儿关节症状缓解的原因。
目前认为全身型幼年特发性关节炎与固有免疫功能障碍有密切关系,主要为CD16+56-NK细胞吞噬功能障碍,刺激T淋巴细胞大量激活,分泌大量炎症因子。研究表明严重类型的类风湿关节炎,托珠单抗的疗效可能与外周血中的CD16+56-NK细胞浓度有关[21],这是因为NK细胞表面存在IL- 6的受体, IL- 6刺激可通过调节CD16+56-NK细胞Src 同源区 2(Src-homology domain 2,SH2)蛋白酪氨酸磷酸酶(SH2-containing protein tyrosine phos-phatase,SHP)2的表达,降低其活性以及下调颗粒酶B、穿孔素分泌(P<0.05)。而加入抗IL- 6抗体后,可有利于CD16+56-NK细胞功能的恢复[22]。本研究1例全身型幼年特发性关节炎继发巨噬细胞活化综合征患儿,使用多种TNF-α拮抗剂(阿达木单抗、依那西普等)、激素及DMARDs药物后,红细胞沉降率、C反应蛋白仍不能降至正常水平,并有持续左踝关节肿胀,多次激素减量时出现再燃,而第2次托珠单抗注射后红细胞沉降率、C反应蛋白逐渐降低、关节肿胀缓解,较使用阿达木单抗时,有明显差异(P<0.05)。两组CD16+56-NK细胞较基线变化不明显(P>0.05),推测可能由于托珠单抗主要改善CD16+56-NK细胞功能,恢复其自然杀伤的识别能力。
综上所述,托珠单抗能有效的缓解活动期全身型幼年特发性关节炎的症状,迅速的降低炎症指标,对于DMARDs疗效不佳者同样有效,同时,通过阻断IL- 6的信号传导,托珠单抗可以调节CD4+/CD8+T细胞的比例,降低CD19+B细胞,从根本上调节免疫系统,从而延缓关节破坏。但需权衡感染风险、肝功能异常、血脂紊乱等的利弊关系。
[1]Beukelman T. Treatment advances in systemic juvenile idiopathic arthritis[J]. F1000Prime Rep, 2014, 6: 21.
[2]Minoia F, Davì S, Horne A, et al. Clinical features, treatment, and outcome of macrophage activation syndrome complicating systemic juvenile idiopathic arthritis: a multinational, multicenter study of 362 patients[J]. Arthritis Rheumatol, 2014, 66: 3160- 3169.
[3]Correll CK, Binstadt BA. Advances in the pathogenesis and treatment of systemic juvenile idiopathic arthritis[J]. Pediatr Res, 2014, 75: 176- 183.
[4]Yokota S,Miyamae T,Imagawa T,et al.Therapeutic efficacy of humanized recombinant anti-interleukin- 6 receptor antibody in children with systemic-onset juvenile idiopathic arthritis[J]. Arthritis Rheum, 2005, 52: 818- 825.
[5]Jones SA1, Scheller J, Rose-John S.Therapeutic strategies for the clinical blockade of IL- 6/gp130 signaling[J]. J Clin Invest, 2011, 121: 3375- 3383.
[6]De Benedetti F, Brunner HI, Ruperto N,et al. Randomized trial of tocilizumab in systemic juvenile idiopathic arthritis[J]. N Engl J Med, 2012, 367: 2385- 2395.
[7]Lundquist LM, Cole SW, Sikes ML.Efficacy and safety of tofacitinib for treatment of rheumatoid arthritis[J]. World J Orthop, 2014, 5: 504- 511.
[8]Kostik M, Dubko M, Masalova V,et al. Successful treatment with tocilizumab every 4 weeks of a low disease activity group who achieve a drug-free remission in patients with systemic-onset juvenile idiopathic arthritis[J]. Pediatr Rheumatol Online J, 2015,13: 4.
[9]史群,赵岩,鲍春德,等.托珠单抗联合改善病情抗风湿药治疗类风湿关节炎的多中心、随机、双盲、安慰剂对照临床研究[J]. 中华内科杂志,2013, 52:323- 329.
[10] 何晓琥. 幼年特发性关节炎(加拿大埃得蒙顿2001年国际风湿病学联盟新的分类标准讨论稿)[J]. 中华风湿病学杂志, 2002,6:62.
[11] Gigante B,Strawbridge RJ,Velasquez IM,et al. Analysis of the role of interleukin 6 receptor haplotypes in the regulation of circulating levels of inflammatory biomarkers and risk of coronary heart disease[J]. PLoS One, 2015, 10: e0119980.
[12] Diamantopoulos A, Finckh A, Huizinga T,et al. Tocilizumab in the treatment of rheumatoid arthritis: a cost-effectiveness analysis in the UK[J]. Pharmacoeconomics, 2014,32: 775- 787.
[13] Yokota S, Imagawa T, Mori M,et al. Longterm safety and effectiveness of the anti-interleukin 6 receptor monoclonal antibody tocilizumab in patients with systemic juvenile idiopathic arthritis in Japan[J]. J Rheumatol, 2014, 41: 759- 767.
[14] 姜楠,费允云,赵岩.白细胞介素- 6阻断剂在类风湿关节炎的治疗应用[J].中华临床免疫和变态反应杂志,2012,3:232- 236.
[15] 郑西希,张奉春. 人源化白细胞介素- 6受体抗体在类风湿关节炎治疗中的应用[J]. 中华临床免疫和变态反应杂志,2014,4:333- 337.
[16] Mori S, Yoshitama T, Hidaka T,et al. Effectiveness and safety of tocilizumab therapy for patients with rheumatoid arthritis and renal insufficiency: a real-life registry study in Japan (the ACTRA-RI study) [J]. Ann Rheum Dis, 2015, 74: 627- 630.
[17] Shovman O, Shoenfeld Y, Langevitz P. Tocilizumab-induced neutropenia in rheumatoid arthritis patients with previous history of neutropenia: case series and review of literature[J]. Immunol Res, 2015, 61: 164- 168.
[18] Shirota Y, Yarboro C, Fischer R,et al. Impact of anti-interleukin- 6 receptor blockade on circulating T and B cell subsets in patients with systemic lupus erythematosus[J]. Ann Rheum Dis, 2013, 72: 118- 128.
[19] Okazaki M, Yamada Y, Nishimoto N,et al. Characterization of anti-mouse interleukin- 6 receptor antibody[J]. Immunol Lett, 2002, 84: 231- 240.
[20] Ju JH, Heo YJ, Cho ML,et al. Modulation of STAT- 3 in rheumatoid synovial T cells suppresses Th17 differentiation and increases the proportion of Treg cells[J]. Arthritis Rheum, 2012, 64: 3543- 3552.
[21] Daïen CI, Gailhac S, Audo R, et al, High levels of natural killer cells are associated with response to tocilizumab in patients with severe rheumatoid arthritis[J]. Rheumatology (Oxford), 2015,54:601- 608.
[22] Kang YJ, Jeung IC, Park A, et al, An increased level of IL- 6 suppresses NK cell activity in peritoneal fluid of patients with endometriosis via regulation of SHP- 2 expression[J]. Hum Reprod, 2014, 29: 2176- 2189.