H9亚型禽流感病毒血凝素单克隆抗体制备及鉴定
邓显文 谢芝勋 谢志勤 刘加波 庞耀珊 谢丽基 范晴 罗思思 黄莉 黄娇玲 曾婷婷 张芳
摘要:【目的】制备H9亚型禽流感病毒(AIV)血凝素(HA)单克隆抗体,为检测诊断AIV提供技术支持。【方法】以灭活H9亚型AIV广西分离株为免疫原,免疫6~8周BALB/c雌性小鼠,然后取其脾细胞与Sp2/0骨髓瘤细胞进行细胞融合,经血凝抑制试验(HI)及间接免疫荧光试验(IFA)筛选H9亚型AIV血凝素单克隆抗体的杂交瘤细胞。【结果】经过4次亚克隆,获得3株稳定的H9单克隆抗体杂交瘤细胞株,分别命名为8A4、1B11和7F1细胞株,其细胞株培养上清液HI效价为27~210,腹水HI效价为216~219;单克隆抗体亚类鉴定结果表明,3株H9单克隆抗体均属于IgG1亚类,其轻链均为K链。3株H9单克隆抗体只与H9亚型AIV发生特异性HI反应,而与其他HA亚型AIV及新城疫病毒(NDV)、减蛋综合症病毒(EDS)、传染性支气管炎病毒(IBV)无交叉反应。3株H9单克隆抗体细胞株的抗体分泌能力稳定性良好。【结论】用灭活H9亚型AIV为免疫原能成功制备针对H9亚型AIV血凝素的单克隆抗体,且具有良好的亚型广谱性和特异性。
关键词: 禽流感病毒(AIV);H9亚型;血凝素;单克隆抗体;HI效价;亚型广谱性
中图分类号: S852.659.5 文献标志码:A 文章编号:2095-1191(2016)04-0679-05
0 引言
【研究意义】禽流感(Avian influenza,AI)是由A型禽流感病毒(Avian influenza virus,AIV)感染禽类引起的一类传染病(殷震和刘景华,1997),在我国广泛存在,且近年来危害越来越严重,给我国造成至少600亿元的经济损失(沙爱龙和刘泽隆,2007),其中2014年发生高致病性AI(H5N1亚型),累计发病家禽5.1万羽,销毁525.0万羽(孙洪涛等,2015),甚至威胁到人类公共卫生(王秀荣和陈化兰,2005)。因此,加强AIV研究及建立快速准确的诊断方法已成为AI防控工作的热点和重点。【前人研究进展】单克隆抗体因具有单一抗原决定簇的特异性,且效价高、理化性状均一、重复性强、生产成本低,已被广泛应用于病毒学诊断(刘萍等,2012;祭芳等,2014)。李长瑜等(2007)用胶体金标记提纯的小鹅瘟病毒(Goose plaguo virus,GPV)单克隆抗体2B8并制备金标棉,以马抗GPV多克隆抗体和羊抗鼠抗体喷涂NC膜,组装获得只能检测出GPV的胶体金检测卡;张祥斌等(2008)制备获得的猪流感病毒(SIV)单克隆抗体(F6A4C10)与H1N1亚型SIV抗原具有特异的免疫反应性,为H1N1亚型SIV的鉴别诊断奠定了基础;谢志勤等(2012)通过克隆筛选成功获得2株能稳定传代并分泌抗禽呼肠孤病毒单克隆抗体的杂交瘤细胞株(SF6-3K3和SB2-1K3),间接ELISA测定效价在105以上,具有良好的特异性,可用于禽呼肠孤病毒的特异性检测;曹丙蕾等(2014)通过原核表达获得了能与猪繁殖与呼吸综合征病毒(PRRSV)N蛋白发生特异性反应的单克隆抗体(6D10和3H5),能有效检测到PRRSV经典毒株和高致病性变异毒株。目前,国内外己有制备AIV单克隆抗体并用于快速诊断的研究报道(孙林等,2010;杨霞等,2011;崔佳莹等,2011),且效果显著。此外,单克隆抗体在动物产品药物残留检测技术方面也得到推广应用,并研制出兽药残留ELISA检测试剂盒,其中一些已实现产业化,取得了顯著的经济效益和社会效益(李晓莉等,2009;李秀婷等,2009)。【本研究切入点】AIV血凝素(Hemagglutinin,HA)直接参与AIV的致病过程,其编码基因点的突变引起抗原变异,因此制备出针对不同亚型AIV的血凝素单克隆抗体,可为研发AIV检测试剂盒奠定基础,但至今鲜见有关H9亚型AIV血凝素单克隆抗体制备及鉴定的研究报道。【拟解决的关键问题】以H9亚型AIV广西分离株为抗原免疫BALB/c,采用杂交瘤技术制备特异的H9亚型AIV血凝素单克隆抗体,为检测诊断AIV提供技术支持。
1 材料与方法
1. 1 试验材料
AIV广西分离株[A-chicken-Guangxi-LS-2013(H9N2)]、SP2/0骨髓瘤细胞、新城疫病毒(NDV)、减蛋综合症病毒(EDS)和传染性支气管炎病毒(IBV)由广西畜禽疫苗新技术重点实验室保存提供;6~8周SPF级BALB/c雌性小鼠购自广西医科大学实验动物中心;灭活剂β-丙内醋、弗氏完全佐剂、弗氏不完全佐剂、秋水仙素、HT培养基、HAT选择培养基、PEG(MW-4000)融合试剂和鼠源MAb亚类鉴定试剂盒均购自Sigma公司;胎牛血清购自Invitrogen公司;DMEM培养基购自Hycon公司;96孔酶标板、BSA及四甲基联苯胺(TMB)、HRP和FITC标记的山羊抗小鼠IgG抗体购自深圳晶美生物工程有限公司。
1. 2 单克隆抗体制备
1. 2. 1 动物免疫及单克隆抗体制备 用β-丙内醋灭活已浓缩纯化的AIV广西分离株作为免疫抗原,首免用弗氏完全佐剂等体积乳化,多点皮下注射免疫6~8周BALB/c雌性小鼠;以弗氏不完全佐剂乳化病毒在首免后第21和35 d进行加强免疫;最后一次免疫是在细胞融合前3 d尾静脉采血测定抗体效价,选抗体效价高的小鼠经腹腔注射加强免疫。无菌取免疫小鼠脾脏与Sp2/0骨髓瘤细胞进行细胞融合试验。
1. 2. 2 单克隆抗体检测方法的建立 在细胞融合第9、12和15 d分别取融合细胞上清液,以4 U的AIV广西分离株作检测抗原,采用血凝抑制试验(HI)检测融合细胞上清液。同时以4 U的AIV广西分离株作包被抗原,以SP2/0骨髓瘤细胞培养上清作阴性对照,免疫小鼠阳性血清作阳性对照,建立间接ELISA对融合细胞上清液进行检测筛选。
1. 2. 3 腹水制备 用0.5 mL灭菌白油腹腔注射小鼠,7 d后腹腔注射1×106个杂交瘤细胞,接种细胞7~10 d后可产生腹水,待腹水尽可能多时收集腹水。
1. 3 单克隆抗体鉴定
1. 3. 1 杂交瘤细胞染色体鉴定 收集培养3~4 d的杂交瘤细胞,加入0.04~0.06 mg/mL秋水仙素,移入新瓶继续培养6~10 h。收集细胞,用氯化钾溶液进行低渗处理,离心收集细胞后用新配制的甲醇—冰乙酸固定液固定,离心收集细胞,滴片后以姬姆萨染色,镜检观察计数,并对杂交瘤细胞染色体组型进行分析。
1. 3. 2 单克隆抗体亚类鉴定 取3株H9亚型AIV血凝素单克隆抗体的杂交瘤细胞上清液,按照鼠源MAb亚类鉴定试剂盒说明对其进行亚类鉴定。
1. 3. 3 杂交瘤细胞稳定性检测 在液氮中冷冻保存后第3和第6个月分别复苏杂交瘤细胞,收集上清液,用HI及间接ELISA检测上清液中的H9单克隆抗体效价,测定H9单抗杂交瘤细胞的抗体分泌能力。
1. 3. 4 抗体效价测定 以HI测定培养上清液和腹水的H9单克隆抗体效价。
1. 3. 5 单克隆抗体广谱性检测 将H9单克隆抗体的杂交瘤细胞培养上清液分别与H9亚型不同病毒分离株进行HI试验,检测其广谱性。
1. 3. 6 单克隆抗体特异性检测 取H9单克隆抗体的杂交瘤细胞培养上清液分别与不同亚型AIV毒株及NDV、EDS和IBV进行HI试验,检测其特异性。
1. 3. 7 间接免疫荧光试验(IFA) 按1∶100稀释AIV广西分离株,然后接种于48孔细胞培养板中的MDCK细胞(史爱华等,2011), 感染1.5 h后用PBS冲洗,加入胰酶于37 ℃培养48.0 h,用冰预冷甲醇固定细胞,分别以8A4、1B11和7F1株杂交瘤细胞培养上清液作一抗,以FITC标记羊抗鼠IgG作二抗,同时设阴性对照组,荧光显微镜下观察摄影。
2 结果与分析
2. 1 单克隆抗体制备及阳性细胞株建立
经过细胞融合,采用HI检测细胞上清液,结果筛选得到4株阳性杂交瘤细胞,经过4次亚克隆,同时用间接ELISA检测,最后获得3株稳定的H9单克隆抗体杂交瘤细胞株,分别命名为8A4、1B11和7F1细胞株。
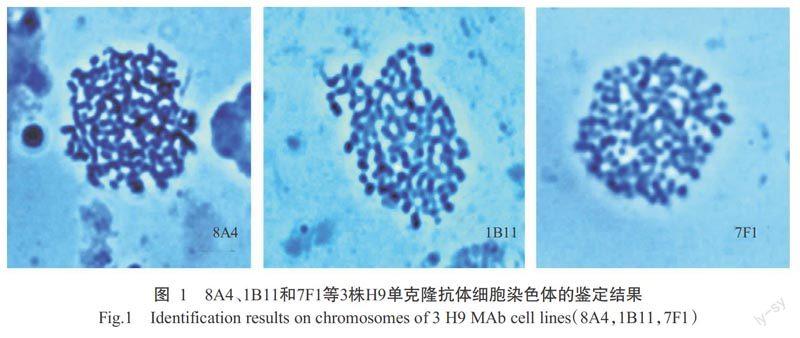
2. 2 单克隆抗体细胞株染色体鉴定结果
采用秋水仙素对3株稳定的H9单克隆抗体杂交瘤细胞株进行染色体鉴定,结果发现8A4、1B11和7F1细胞株的染色体数分别为106、109和104,说明3株杂交瘤细胞为骨髓瘤细胞与脾细胞的融合细胞(图1)。
2. 3 单克隆抗体亚类鉴定结果
用鼠源单克隆抗体亚类鉴定试剂盒对8A4、1B11和7F1细胞株进行亚类鉴定,结果发现3株H9单克隆抗体均属于IgG1亚类,其轻链均为K链(表1)。
2. 4 血凝抑制效价结果
H9单克隆抗体8A4、1B11和7F1细胞株培养上清液的HI效价分别为29、210和27,腹水HI效价分别为217、219和216。说明用腹水制备的H9单克隆抗体HI效价非常高,符合单克隆抗体制备的要求。
2. 5 单克隆抗体广谱性检测结果
将8A4、1B11和7F1细胞株培养上清液分别与20株H9亚型AIV进行HI试验,结果发现,3株H9单克隆抗体能与18株H9亚型AIV产生良好反应,仅有2株鸟类H9亚型AIV反应较差(表2),说明3株H9单克隆抗体与H9亞型AIV均能结合,具有较好的广谱性。
2. 6 单克隆抗体特异性检测结果
以制备获得的3株H9单克隆抗体与15株不同亚型AIV及NDV、EDS、IBV进行HI试验,结果表明, 3株H9单克隆抗体只与H9亚型AIV产生良好反应,而与其他亚型AIV及NDV、EDS、IBV无交叉反应,说明制备获得的3株H9单克隆抗体具有良好的特异性(表3)。
2. 7 单克隆抗体稳定性试验结果
分别在液氮冷冻保存第3和第6个月复苏杂交瘤细胞,用HI检测上清液中的H9单克隆抗体效价,结果显示,其HI效价分别由29、210和27下降至28、29和26,说明3株H9单克隆抗体细胞株的抗体分泌能力稳定性良好。
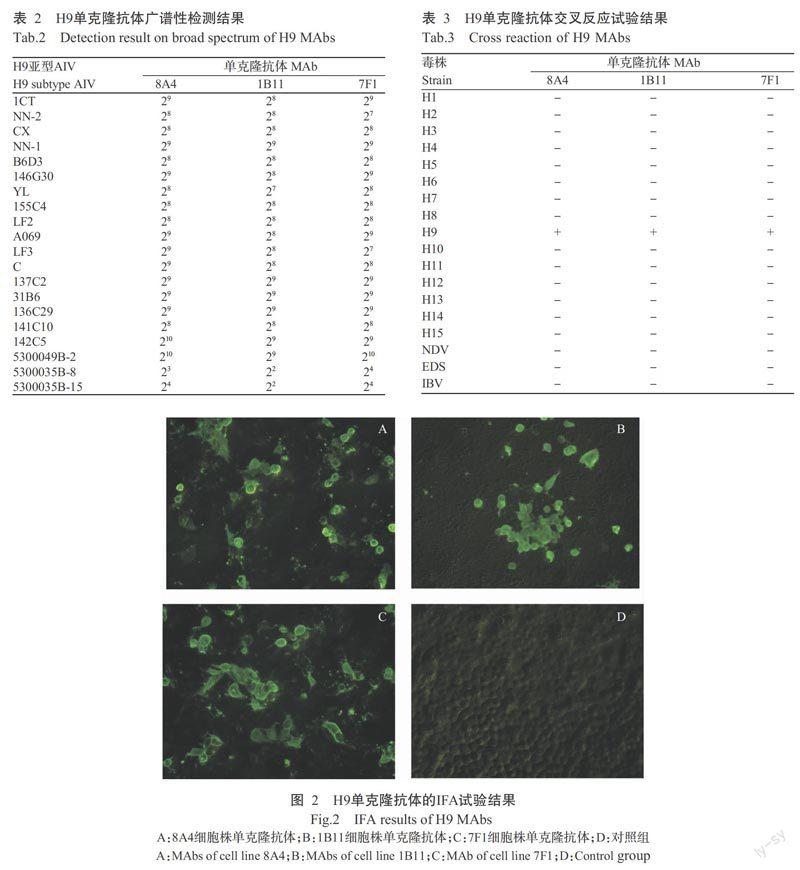
2. 8 间接免疫荧光试验结果
由图2可以看出,制备获得的3株H9单克隆抗体均能与感染H9亚型AIV的MDCK细胞发生特异性结合,荧光显微镜下可观察到明亮的绿色荧光,而未感染病毒的MDCK细胞未见绿色荧光。
3 讨论
防控AI的关键技术是建立快速的AIV诊断方法。常规的病毒分离鉴定诊断周期长,HI试验虽然普遍应用,但多抗血清的制备繁琐,且不同批次的质量差异较明显,其特异性和敏感性较差,批间检测结果差异大(闫海滨等,2014)。目前,在各类疾病的病原检测诊断中,单克隆抗体以其特异性高、敏感性强已被广泛应用。詹爱军等(2008)、孙林等(2010)先后制备获得H9亚型AIV血凝素单克隆抗体,能与H9亚型AIV发生特异的HI反应,为AI快速诊断及AIV的抗原性分析等奠定了基础。本研究以灭活的H9亚型AIV广西分离株免疫BALB/c雌性小鼠,成功研制出3株H9亚型AIV血凝素蛋白的单克隆抗体,特异性检测结果表明,制备获得的3株H9单克隆抗体均保持了自然状态下完整的抗原表位,具有很好的H9亚型特异性,与崔佳莹等(2011)采用GD261分离株制备H5亚型AIV血凝素单克隆抗体的研究结果一致,只是亚型不同。
AIV亚型众多,且在同亚型内还包含有许多毒株,其抗原性存在较大差异。因此,制备的单克隆抗体必须进行型特异性检测和同型的排谱反应。本研究对制备获得的3株H9亚型单克隆抗体进行广谱性检测,结果发现其均具有良好的HI反应,只有2株从鸟类分离获得的H9亚型AIV(5300035B-8和5300035B-15)反应较差,说明从鸟类分离获得的H9亚型AIV血凝素蛋白抗原发生了变异。这对AIV病原学诊断研究及防控H9亚型AI具有重要意义。
4 结论
用灭活H9亚型AIV为免疫原能成功制备针对H9亚型AIV血凝素的单克隆抗体,且具有良好的亚型广谱性和特异性。
参考文献:
曹丙蕾,张群,凌宗帅,邱洪凯,杨超然. 2014. 猪繁殖与呼吸综合征病毒山东分离株N蛋白基因的原核表达及其单克隆抗体的制备与鉴定[J]. 西南农业学报,27(4):1772-1776.
Cao B L,Zhang Q,Ling Z S,Qiu H K,Yang C R. 2014. Prokaryotic expression of gene of PRRSV SD-TA strain N protein and preparation and characterization of monoclonal antibodies[J]. Southwest China Journal of Agricultural Sciences,27(4):1772-1776.
崔佳莹,李印,于扬,张文亮,邓国华,陈化兰. 2011. H5N1亚型禽流感病毒血凝素蛋白单克隆抗体的制备及鉴定[J]. 中国预防兽医学报,33(6):476-478.
Cui J Y,Li Y,Yu Y,Zhang W L,Deng G H,Chen H L. 2011. Preparation and identification of monoclonal antibodies against HA protein of AIV H5N1 subtype[J]. Chinese Journal of Preventive Veterinary Medicine,33(6):476-478.
祭芳,曹欢,徐剑宏,史建荣. 2014. 抗玉米赤霉烯酮单克隆抗体的制备[J]. 江苏农业学报,30(2):417-422.
Ji F,Cao H,Xu J H,Shi J R. 2014. Development of monoclonal antibodies against zearalenone[J]. Jiangsu Journal of Agricultural Sciences,30(2):417-422.
李长瑜,周铁忠,张喜悦,王翌,胡桂学. 2007. 小鹅瘟病毒胶体金层析检测卡的研究[J]. 中国预防兽医学报,29(8):625-628.
Li C Y,Zhou T Z,Zhang X Y,Wang Y,Hu G X. 2007. Deve-lopmemt of gold immunochromatography calorie for detection of goose plague virus[J]. Chinese Journal of Preventive Veterinary Medicine,29(8):625-628.
李晓莉,张以芳,曾令兵,许映芳,肖晶,童亮. 2009. 单克隆抗体在水产养殖中的应用[J]. 动物医学进展,30(9):94-99.
Li X L,Zhang Y F,Zeng L B,Xu Y F,Xiao J,Tong L. 2009. Application of monoclonal antibodies in the aquaculture[J]. Progress in Veterinary Medicine,30(9):94-99.
李秀婷,孙宝国,吕跃钢,宋焕禄,宋红霞. 2009. 动物源性食品中药物残留的快速检测技术研究进展[J]. 食品科学,30(19):346-350.
Li X T,Sun B G,Lü Y G,Song H L,Song H X. 2009. Progress in rapid detection techniques for drug residues in animal-origin foods[J]. Food Science,30(19):346-350.
刘萍,陈苗苗,刘学荣,牟克斌,黄银君. 2012. 单克隆抗体研究进展[J]. 中国畜牧兽医,39(1):67-70.
Liu P,Chen M M,Liu X R,Mu K B,Huang Y J. 2012. Research progress in monoclonal antibodies[J]. China Animal Husbandry & Veterinary Medicine,39(1):67-70.
沙爱龙,刘泽隆. 2007. 禽流感及其对经济的影响[J]. 动物医学进展,28(6):99-102.
Sha A L,Liu Z L. 2007. Avian influenza and its influence on economy[J]. Progress in Veterinary Medicine,28(6):99-102.
史爱华,张建伟,沈佳,姜北宇,章振华,李林,景小冬. 2011. H9N2亚型禽流感病毒在MDCK细胞中增殖最佳条件研究[J]. 动物医学进展,32(11):42-45.
Shi A H,Zhang J W,Shen J,Jiang B Y,Zhang Z H,Li L,Jing X D. 2011. Study on optimal proliferation of H9N2 avian influenza virus in MDCK cells[J]. Progress in Veterinary Medicine,32(11):42-45.
孫洪涛,宋建德,朱迪国,魏荣. 2015. 2014年全球禽流感流行状况[J]. 中国动物检疫,32(7):13-16.
Sun H T,Song J D,Zhu D G,Wei R. 2015. Global epidemic situ-ation of avian influenza in 2014[J]. China Animal Health Inspection,32(7):13-16.
孙林,季琰,左为亮,王秀荣,潘志明,焦新安. 2010. 抗H9亚型禽流感病毒血凝素单克隆抗体的制备和鉴定[J]. 生物技术通讯,21(1):47-50.
Sun L,Ji Y,Zuo W L,Wang X R,Pan Z M,Jiao X A. 2010. Development and characterization of monoclonal antibodies against hemagglutinin of H9 subtype avian influenza virus[J]. Letters in Biotechnology,21(1):47-50.
王秀荣,陈化兰. 2005. 禽流感与公共卫生[J]. 基础医学与临床,25(12):1079-1083.
Wang X R,Chen H L. 2005. Avian influenza and public health[J]. Basic Medical Sciences and Clinics,25(12):1079-1083.
谢志勤,谢芝勋,刘加波,庞耀珊,邓显文,谢丽基,彭宜,范晴. 2012. 禽呼肠孤病毒S1733株单克隆抗体的制备及特性鉴定[J]. 中国畜牧兽医,39(11):47-51.
Xie Z Q,Xie Z X,Liu J B,Pang Y S,Deng X W,Xie L J,Peng Y,Fan Q. 2012. Preparation and identification of monoclonal antibody against reovirus S1733[J]. China Animal Husbandry & Veterinary Medicine,39(11):47-51.
闫海滨,薛树山,王宏燕,张鑫,吴运谱,石霖,张秀萍,赵鹏. 2014. 禽流感与鸡新城疫HA和HI试验影响因素分析[J]. 现代畜牧兽医,(8):43-45.
Yan H B,Xue S S,Wang H Y,Zhang X,Wu Y P,Shi L,Zhang X P,Zhao P. 2014. Analysis of influence factors of HA and HI test methods of detecting avian influenza and newcastle disease[J]. Modern Journal of Animal Husbandry and Ve-
terinary Medicine,(8):43-45.
杨霞,陈少渠,李建丽,王川庆,王泽霖. 2011. H9N2亚型禽流感病毒非结构蛋白基因NS1的表达及其单克隆抗体的研制[J]. 中国兽医学报,31(9):1295-1300.
Yang X,Chen S Q,Li J L,Wang C Q,Wang Z L. 2011. Expression of the non-constructual protein-1(NS1) of avian influenza virus H9N2 and preparation of its monoclonal antibodies[J]. Chinese Journal of Veterinary Science,31(9):1295-1300.
殷震,刘景华. 1997. 动物病毒学[M]. 第2版. 北京:科学出版社.
Yin Z,Liu J H. 1997. Animal Virology[M]. The 2nd Edition. Beijing:Science Press.
詹爱军,王新卫,陈枝楠,卢体康,花群义. 2008. 抗H9N2 AIV HA单克隆抗体的制备及其在胶体金层析检测中的初步应用[J]. 河南农业科学,(9):123-126.
Zhan A J,Wang X W,Chen Z N,Lu T K,Hua Q Y. 2008. Preparation of monoclonal antibodies against HA of H9N2 AIV and its preliminary application in colloidal gold immunochromatographic assay[J]. Henan Aricultural Sciences,(9):123-126.
张祥斌,谢青梅,马静云,曹永长,冀君,李少璃,毕英佐. 2008. H1N1亚型猪流感病毒HA基因的表达及单克隆抗体的制备[J]. 中国兽医科学,38(11):962-967.
Zhang X B,Xie Q M,Ma J Y,Cao Y C,Ji J,Li S L,Bi Y Z. 2008. Expression of HA gene of H1N1 subtype swine influenza virus and preparation of a monoclonal antibody against HA protein[J]. Chinese Veterinary Science,38(11):962-967.
(責任编辑 兰宗宝)

