溃疡性结肠炎患者肠道机械屏障变化与STAT3信号通路关系的研究
卫江鹏,刘 刚,张 霆,王建林,刘 彤
天津医科大学总医院普通外科,天津 300052
溃疡性结肠炎患者肠道机械屏障变化与STAT3信号通路关系的研究
卫江鹏,刘 刚,张 霆,王建林,刘 彤
天津医科大学总医院普通外科,天津 300052
目的 探讨溃疡性结肠炎(ulcerative colitis,UC)患者肠道机械屏障变化与信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)信号通路的关系。方法 收集200例UC患者肠黏膜组织作为UC组,以50名健康体检者肠黏膜标本为对照组。UC患者以Mayo评分分为轻度(68例)、中度(70例)和重度(62例)。免疫组化法检测咬合蛋白(Occludin)、紧密连接蛋白l(Claudin-1)和STAT3蛋白表达,并对相关临床指标进行统计学分析。结果 与对照组相比,UC组Occludin、Claudin-1的表达水平显著降低(P<0.05),STAT3表达水平明显升高(P<0.05)。三种蛋白的表达水平在轻、中、重度UC组间相比,差异均有统计学意义(P<0.05),其中Occludin和Claudin-1表达随着UC分级增加显著减少(rs=-0.914,rs=-0.933,P<0.05),STAT3表达随着UC分级增加而显著增多(rs=0.942,P<0.05)。Occludin及Claudin-1表达水平与STAT3表达水平呈负相关(r=-0.924,r=-0.983,P<0.05)。结论 STAT3信号通路可能通过影响肠黏膜上皮细胞间紧密连接蛋白Occludin和Claudin-1的表达引起UC肠黏膜机械屏障损伤。STAT3基因可能成为干预治疗UC的一个潜在靶点。
溃疡性结肠炎;肠上皮屏障功能;紧密连接蛋白;信号转导及转录活化因子3
目前认为肠道屏障功能损伤在溃疡性结肠炎(ulcerative colitis,UC)发生、发展过程中发挥重要作用,但其机制尚未完全明确。研究显示信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)与UC发病密切相关[1]。本研究通过检测UC患者肠黏膜STAT3蛋白、紧密连接蛋白1(Claudin-1)和咬合蛋白(Occludin)的表达,探讨UC肠道机械屏障变化与STAT3信号通路的关系,进而分析UC的发病机制。
1 资料与方法
1.1 一般资料收集2010年1月-2013年2月因具有UC症状在天津医科大学总医院内镜室行电子结肠镜检查且肠镜表现及病理诊断为UC患者的标本200例[诊断标准参照“炎症性肠病诊断与治疗的共识意见(2012)”[2]],男109例,女91例,年龄14~82岁,平均年龄(45±3)岁。根据Mayo[3]分级方法分为轻度68例,中度70例和重度62例。病变范围:直肠53例,左半结肠78例,广泛结肠69例。收集2012年1月-2013年2月天津医科大学总医院50名健康体检者肠道黏膜标本作为对照组,男25名,女25名,年龄38~88岁,平均年龄(62±2)岁。此研究已通过天津医科大学总医院伦理委员会批准,所有患者均签署知情同意书。
1.2 试剂与方法
1.2.1 主要试剂:兔抗人Occludin多克隆抗体购自英国Abcam公司;兔抗人Claudin-1多克隆抗体、兔抗人STAT3多克隆抗体、含5%BSA封闭液和SABC的羊抗兔/羊抗小鼠二抗试剂盒、3,3-二氨基联苯胺(DAB)试剂盒均购自中国武汉博士德生物工程有限公司。
1.2.2 免疫组化法:将两组结肠黏膜用4%多聚甲醛固定后,脱水制成蜡块,所有组织蜡块均以4 μm连续切片,两组切片经脱蜡、水化、热修复抗原后加5% BSA封闭液,依次加一抗、人生物素化二抗、链霉素亲和素酶,常温孵育,经DAB显色及苏木精复染,盐酸乙醇分化、脱水、二甲苯透明、中性树脂封片、显微镜镜检并拍照。由两名病理科医师采用独立双盲法在低倍镜(40倍)下选取阳性细胞最密集区,然后在200倍视野下计数100个细胞,计算阳性细胞的百分率,最终以平均百分数字作为每张切片的结果[4]。
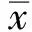
2 结果
2.1 两组肠黏膜Occludin、Claudin-1和STAT3表达水平Occludin连续分布于肠道黏膜上皮细胞和腺体细胞,为棕黄色染色颗粒;Claudin-1主要分布于肠上皮紧密连接的细胞膜(包括细胞膜顶部),膜内近侧的胞质区少量染色,为棕黄色染色颗粒。STAT3染色阳性表达为淋巴细胞或中性粒细胞胞浆或包膜呈棕黄色颗粒(见图1)。UC组Occludin、Claudin-1的表达与对照组相比显著降低,(31.46±11.27)%vs(43.37±5.89)%(t=7.23,P<0.05);(59.58±15.33)%vs(69.28±4.42)%(t=4.42,P<0.05)。与正常对照组相比,UC组STAT3表达水平显著升高(42.73±8.38)%vs(87.24±9.81)%(t=7.22,P<0.05)。

图1 对照组和UC组肠黏膜Occludin、Claudin-1及STAT3蛋白表达(200×) A:对照组Occludin(强阳性);B:UC组Occludin(阴性);C:对照组Claudin-1(强阳性);D:UC组Claudin-1(阴性);E:对照组STAT3(阴性);F:UC组STAT3(强阳性)
2.2 UC组肠黏膜Occludin、Claudin-1和STAT3表达水平与临床参数的关系UC组肠黏膜Occludin、Claudin-1阳性细胞表达率由轻度到重度显著减少,STAT3表达由轻度到重度显著增加(P<0.05);Occludin、Claudin-1与Mayo分级呈负相关(rs=-0.914,P<0.05),STAT3与Mayo分级呈正相关(rs=0.942,P<0.05)。Occludin、Claudin-1和STAT3在不同性别、年龄和病变范围的表达间比较差异无统计学意义(P>0.05,见表1)。Pearson相关分析显示:UC组肠道黏膜Occludin、Claudin-1表达与STAT3表达水平呈负相关(rs=-0.924,rs=-0.983,P<0.05)。
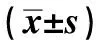
表1 UC组Occludin、Claudin-1、STAT3表达与临床病理参数的关系
3 讨论
研究表明STAT3是介导细胞因子信号通路的重要转录因子,可与多种细胞因子相结合并通过JAK/STAT途径发挥诱导细胞信号转导作用[5]。Murano等[6]的实验发现肠黏膜中STAT3信号通路被激活后可促进肠上皮细胞编码多种促炎因子。此外,其他一些研究表明炎症介质可通过STAT3信号通路促进髓样相关蛋白8(myeloid-related protein 8,MRP8)的表达,进而引起肠黏膜研中性粒细胞的趋化及黏附[7],加重UC炎症反应。本实验结果显示,UC患者肠黏膜STAT3蛋白表达水平较对照组明显升高,随着病程进展STAT3表达量明显增加,这与Li等[8]的研究结果一致,因而推测STAT3参与了UC的发病,并在疾病进展过程中发挥重要作用,可能成为未来UC治疗的新靶点[9]。
Claudin-1与Occludin组成肠道上皮紧密连接并通过控制大分子物质和离子的通过,对维护上皮细胞两侧物质的差异及保持细胞极性,保持肠道稳态具有重要作用[10]。本研究显示UC患者肠黏膜Claudin-1和Occludin表达水平显著降低,随着病程进展,表达量进一步减少。此结果表明肠道黏膜Claudin-1和Occludin表达减少引起机械屏障损伤而导致的肠道菌群移位、内毒素吸收可能是UC发生和发展的重要分子学基础。Kim等[11]在Caco-2细胞模型实验中发现当STAT3核转位增多时会导致包括Occludin在内的多种肠屏障结构蛋白基因表达降低,导致肠道紧密连接受损。本研究中,STAT3、Occludin及Claudin-1与UC疾病分级密切相关;且Claudin-1和Occludin蛋白表达与STAT3蛋白表达水平呈显著负相关。可以推测,STAT3通过影响Claudin-1和Occludin蛋白的表达,进而导致上皮细胞间紧密连接减少,上皮细胞间隙通透性增强,引起肠道菌群及内毒素移位,最终出现肠道稳态失衡,影响UC的发病及病程进展。
综上,肠黏膜上皮Claudin-1和Occludin的表达减少是UC发病及进展的重要分子学基础,STAT3作为一种可介导多种信号通路的转录因子,通过调控基因表达来影响Claudin-1和Occludin的表达水平,进而破坏肠黏膜机械屏障的完整性参与了UC的发病,并在疾病进展过程中发挥关键作用。如何通过靶向干预STAT3的表达,进而阻断这一机制的发生,减轻肠黏膜机械屏障的损伤,对UC的诊断治疗具有重要意义,未来或成为对UC研究的新热点。
[1]Cénit MC, Alcina A, Márguez A, et al. STAT3 locus in inflammatory bowel disease and multiple sclerosis susceptibility [J]. Genes Immun, 2010, 11(3): 264-268.
[2]Chinese cooperative group for the study on IBD, Chinese society of gastroenterology. Consensus on the management of inflammatory bowel disease in China (2012, Guangzhou) [J]. Chin J Dig, 2012, 32(12): 796-813. 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年,广州)[J]. 中华消化杂志, 2012, 32(12): 796-813.
[3]D′Haens G, Sandborn WJ, Feagan BG, et al. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis [J]. Gastroenterology, 2007, 132(2): 763-786.
[4]Cates JM, Troutman KA Jr. Quality management of the immunohistochemistry laboratory: a practical guide [J]. Appl Immunohistochem Mol Morphol, 2015, 23(7): 471-480.
[5]Morikawa T, Baba Y, Yamauchi M, et al. STAT3 expression, molecular features, inflammation patterns, and prognosis in a database of 724 colorectal cancers [J]. Clin Cancer Res, 2011, 17(6): 1452-1462.
[6]Murano T, Okamoto R, Ito G, et al. Hes1 promotes the IL-22-mediated antimicrobial response by enhancing STAT3-dependent transcription in human intestinal epithelial cells [J]. Biochem Biophys Res Commun, 2014, 443(3): 840-846.
[7]Lee MJ, Lee JK, Choi JW, et al. Interleukin-6 induces S100A9 expression in colonic epithelial cells through STAT3 activation in experimental ulcerative colitis [J]. PLoS One, 2012, 7(9): e38801.
[8]Li F, Zou Y, Li X. Up-regulation of signal transducer and activator of transcription-3 is associated with aggravation of ulcerative colitis [J]. Surgeon, 2010, 8(5): 262-266.
[9]Neufert C, Pickert G, Zheng Y, et al. Activation of epithelial STAT3 regulates intestinal homeostasis [J]. Cell Cycle, 2010, 9(4): 652-655.
[10]Yamamoto-Furusho JK, Mendivil-Rangel EJ, Fonseca-Camarillo G. Differential expression of occludin in patients with ulcerative colitis and healthy controls [J]. Inflamm Bowel Dis, 2012, 18(10): E1999.
[11]Kim CY, Kim KH. Curcumin prevents leptin-induced tight junction dysfunction in intestinal Caco-2 BBe cells [J]. J Nutr Biochem, 2014, 25(1): 26-35.
(责任编辑:王豪勋)
The relationship between the change of intestinal mechanical barrier function in patients with ulcerative colitis and STAT3 pathway
WEI Jiangpeng, LIU Gang, ZHANG Ting, WANG Jianlin, LIU Tong
Department of General Surgery, Tianjin Medical University General Hospital, Tianjin 300052, China
Objective To investigate the relationship between the change of mechanical barriers in patients with ulcerative colitis (UC) and the signal transducer and activator of transcription 3 (STAT3) pathway.Methods Specimens were obtained in 200 patients with UC and 50 controls respectively, samples were classified into three groups as mild (68 cases), moderate (70 cases) and severe (62 cases) according to Mayo classification. Immunohistochemistry was performed to examine the expressions of Occludin, Claudin-1 and STAT3. The result and the clinical data were analyzed. Results Compared with control group, the expressions of Occludin and Claudin-1 significantly decreased (P<0.05), STAT3 significantly increased in UC group (P<0.05). The levels of three proteins were different in each active subgroups (P<0.05). Occludin and Claudin-1 were decreased significantly with the increase of UC classification (rs=-0.914,rs=-0.933,P<0.05), STAT3 was significant increased with the increase of UC classification (rs=0.942,P<0.05). With the increase of STAT3, Occludin and Claudin-1 levels were decreased significantly (r=-0.924,r=-0.983,P<0.05).Conclusion STAT3 may be involved in intestinal mucosa barrier damage through inhibition of Occludin and Claudin-1 expressions, resulting in the occurrence and development of UC.
Ulcerative colitis; Epithelial barrier function; Tight junction proteins; Signal transducer and activator of transcription 3
黎介寿院士肠道屏障研究专项基金(LJS201008);天津市卫生局科技基金(2011KZ66)
卫江鹏,硕士,研究方向:炎症性肠病的临床与基础。E-mail:EdficRango@163.com
刘刚,博士,主任医师,研究方向:炎症性肠病的临床与基础。E-mail:landmark1503@sina.com
10.3969/j.issn.1006-5709.2016.01.011
R574.62
A
1006-5709(2016)01-0047-04
2015-03-05

