高原低氧对大鼠肝脏氧化应激损伤的研究
万平新,万顺梅,杨丽红,郭艳芳,张红云
1.甘肃省靖远县中医院康复科,甘肃 靖远 730600; 2.中国人民解放军第一医院 消化内科; 3.兰州军区兰州武都路干休所
高原低氧对大鼠肝脏氧化应激损伤的研究
万平新1,万顺梅2,杨丽红3,郭艳芳3,张红云2
1.甘肃省靖远县中医院康复科,甘肃 靖远 730600; 2.中国人民解放军第一医院 消化内科; 3.兰州军区兰州武都路干休所
目的 模拟高原低压、低氧环境建立大鼠缺氧模型,探讨不同缺氧时间对大鼠缺氧肝损伤程度的影响。方法 采用国产低压低氧动物实验舱模拟海拔 6 000 m 高原缺氧环境,观察1 d、3 d、5 d、7 d 不同缺氧时间大鼠组织病理学变化情况,并测定血浆丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)的变化及丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性的变化。结果 ALT、AST、ALP、 MDA随缺氧时间的延长而升高,尤其以5 d、7 d缺氧组升高明显(P<0.05),SOD活性明显下降(P<0.05),并可见组织形态发生明显改变。结论 高原低压低氧环境能引起大鼠肝脏发生氧化应激反应而导致肝损伤,其损伤程度随时间延长而加重,该模型为下一步研究高原脂肪肝的发病机制及防治提供基础。
高原;缺氧;肝损伤;低压氧舱
缺氧性肝损伤是指由于各种急性或慢性缺氧对肝细胞的损害,其病理表现常为肝细胞肿胀及脂肪变性,严重者甚至发生肝大鼠叶中央区细胞坏死。随着进入高原地区人群的增多,可能出现急性缺氧,也可能因长期生活在高原环境中存在慢性缺氧,最终可能造成缺氧性肝损伤。既往的高原病研究主要集中在高原肺损伤、高原脑损伤及高原性心脏病等方面,而对于高原低氧环境导致肝损伤的研究还相对较少,本研究模拟低压低氧大鼠动物模型,探讨随着缺氧时间变化实验动物各项指标的变化,为下一步高原脂肪肝防治研究奠定基础。
1 材料与方法
1.1 实验动物SPF 级大白鼠,雄性,8 周龄,40只,体质量190~220 mg,由甘肃中医学院实验动物中心提供[动物合格证号: SCXK(甘) -2012-0001]。
1.2 实验仪器采用日立7600-020 全自动生化分析仪(日本,株式会社日立高新技术)测定血清生化指标,所用试剂盒均购自南京建成生物工程研究所,FLYD-WC50-ⅡA 型低压低氧动物实验舱(中航工业贵州风雷航空军械有限责任公司)。
1.3 低压低氧动物实验舱模拟缺氧肝损伤大鼠模型的建立标准大鼠常规饲养适应3 d 后,随机分为正常对照组和缺氧1 d、3 d、5 d、7 d 组,共5 组,每组8只。按不同缺氧时间分别将各缺氧组大鼠放入低压舱,密闭舱门,以10 m/s 的速度减压,模拟上升至海拔6 000 m以上,并维持相应的减压时间,在完成预定缺氧时间后,调节进气孔阀门,以20 m/s 的速度缓慢降至正常海拔高度。水合氯醛麻醉后,股静脉放血5 ml(用于生化检测)后即处死,迅速解剖分离肝脏组织,用生理盐水洗3 次,清除残血,置于10%中性甲醛液中固定,制作普通病理切片。实验过程中无大鼠死亡。
1.4 生化指标测定ALT、AST、ALP、SOD活性及MDA含量检测,均按相应的试剂盒说明书操作。
1.5 病理学检测在肝脏最大叶距边界5 mm处取大鼠肝组织,浸泡固定,石蜡包埋,切片,HE染色,光镜下观察。
2 结果
2.1 生化指标的变化大鼠在升至模拟海拔高度6 093 m、349 mmHg,与正常对照组比较,缺氧组ALT、AST、ALP、MDA随缺氧时间的延长而升高,尤其以缺氧5 d、7 d组升高明显(P<0.05);SOD活性较正常对照组明显下降(P<0.05,见表1~2)。
2.2 肝脏组织的病理学表现HE 染色光镜下观察,正常对照组大鼠肝结构正常,血管清晰可见,细胞形态结构完好。6 000 m大鼠缺氧1 d组与正常对照组比较,肝细胞轻度浊肿变性,部分呈空泡样变,伴炎性细胞浸润,随缺氧时间延长,缺氧3 d组肝细胞浊肿变性,空泡样变及炎性细胞浸润较正常对照组明显,比缺氧1 d组稍重,缺氧5 d 组和 7 d 组比缺氧1 d组和3 d组严重,以缺氧7 d组明显,肝细胞浊肿变性明显,空泡样变增多(见图1)。
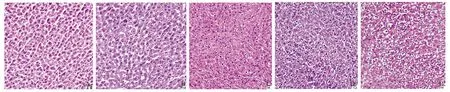
图1 模拟海拔 6 000 m 急性缺氧不同时间大鼠肝组织显微结构的影响(200×) A:对照组;B:缺氧1 d 组; C:缺氧 3 d 组; D:缺氧 5 d 组; E:缺氧 7 d 组
表1 模拟海拔6 000 m急性缺氧不同时间大鼠肝酶活性的影响(U/L, ±s)
注:与正常对照组比较,aP<0.05;bP<0.01;cP<0.001。

表2 各组大鼠肝脏SOD活性和MDA含量的变化±s )
注:与正常对照组比较,aP<0.05;bP<0.01;cP<0.001。
3 讨论
高原缺氧初期, 机体可以在代偿范围内产生适应性变化,但持续的缺氧最终导致组织细胞缺氧损伤, 这种缺氧损伤主要表现在细胞膜、线粒体、溶酶体变化上, 缺氧造成细胞膜对离子的高通透性, 钠离子内流, 又由于ATP生成减少, 使钠泵发生功能性障碍, 钠离子进一步内流, 导致细胞水肿。
高海拔地区由于空气稀薄、氧分压低,因组织缺氧可引起肝功能部分损伤,包括ALT、AST等肝脏功能监测指标升高[1]。高原缺氧使氧自由基产生增多加重细胞损伤,抗氧化剂SOD活性下降。在高原缺氧环境下,机体会发生一定程度的氧自由基代谢紊乱,SOD 活性显著下降,MDA 含量显著升高[2]。MDA 是氧自由基和生物膜多聚不饱和脂肪酸发生脂质过氧化反应的产物,其产生的量与氧自由基清除的量相平行,测定MDA 可反映氧自由基的代谢情况,间接反映出细胞损伤的程度[3]。大量流行病学调查表明,高原低氧环境诱导体内氧自由基堆积可能导致肝细胞膜受损和肝脏损伤[4]。有研究报道,间歇低氧及持续低氧均可引起脂质过氧化产物丙二醛明显增加,从而导致肝损伤[5]。
急性或慢性长期缺氧,导致肝内血管充血扩张,血液淤滞,肝内微循环不畅,肝组织营养障碍,肝细胞膜通透性改变,致肝细胞充血、水肿及脂肪变性。急性低压缺氧所致的氧化性应激及其介导的氧化性损伤也是急性高原病发病机制的一个重要方面[6-7],有文献报道,缺氧性肝损害与缺氧时间呈正相关[8]。
本实验研究显示,实验大鼠在升至模拟海拔6 000 m高度后,与正常对照组相比,ALT、AST、ALP、MDA含量明显升高,SOD活性明显下降,与正常对照组比较,肝细胞组织形态发生了明显变化,肝细胞浊肿变性,空泡样变及炎性细胞浸润更为明显。说明在此条件下缺氧12 h 即可复制出急性肝损伤动物模型。
目前研究发现,高原低氧环境地区脂肪肝的发病率高于平原地区脂肪肝,各种急慢性高原病严重影响着高原地区军民的身体健康状况,该模型为下一步研究高原脂肪肝的发病机制提供了有利条件,在高原脂肪肝的防治研究中具有重要意义。
[1]Zhang YH, Yuan ZC, Guo RL, et al. Analysis of liver function test results of the population in the plateau to plain for 3 years [J]. Int J Lab Med, 2011, 32(14): 1622-1623. 张雅鸿, 袁振才, 郭瑞林, 等. 高原暴露人群返平原近3年肝功能检测结果分析[J].国际检验医学杂志, 2011, 32(14): 1622-1623.
[2] Qian J, Jiang F, Wang B, et al. Ophiopgonin D prevents H2O2-induced injury in primary human umbilical cells [J]. J Ethnopharmacol, 2010, 128(2): 438-445.
[3] Shen ZB, Yin YQ, Tang CP, et al. Pharmacodynamic screening and simulation study of anti-hypoxia active fraction of Xiangdan injection [J]. J Ethnopharmacol, 2010, 127(1): 103-107.
[4] Rong L, Dai LL, Zeng WZ, et al. Protective effect of salidroside on liver injury of rats under altitude hypoxia simulation [J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2010, 14(31): 5813-5817. 荣黎, 戴立里, 曾维政, 等. 红景天甙对拟高原缺氧大鼠肝损伤的保护作用[J].中国组织工程研究与临床康复, 2010, 14(31): 5813-5817.
[5] Zhang Z, Dong LX, Li S, et al. Study on oxidative stress injury induced by intermittent hypoxia in rats [J]. China Parc Med, 2013, 8(34): 250-251. 张祯, 董丽霞, 李硕, 等. 间歇低氧对大鼠肝脏氧化应激损伤的研究[J].中国实用医药, 2013, 8(34): 250-251.
[6] Dosek A, Ohno H, Acs Z, et al. High altitude and oxidative stress [J]. Respir Physiol Neurobiol, 2007, 158(2-3): 128-131.
[7] Maiti P, Singh SB, Mallick B, et al. High altitude memory impairment is due to neuronal apoptosis in hippocampus, cortex and striatum [J]. J Chem Neuroanat, 2008, 36(3-4): 227-238.
[8] Deng HY, Luo FM. The effect of NK 1 tachykinin receptor antagonist on hypoxia induced hepatic function injury and hepatocellular apoptosis in rats [J]. Journal of Biomedical Engineering, 2011, 28(5): 992-996. 邓宏宇, 罗凤鸣. P 物质受体拮抗剂对缺氧大鼠模型肝功能及肝细胞凋亡的影响[J].生物医学工程学杂志, 2011, 28(5): 992-996.
(责任编辑:陈香宇)
The research of hepatic oxidative stress injury in high altitude hypoxia in rats
WAN Pingxin1, WAN Shunmei2, YANG Lihong3, GUO Yanfang2, ZHANG Hongyun2
1. Department of Rehabilitation, Jingyuan Hospital of Traditional Chinese Medicine, Jingyuan 730600; 2. Department of Gastroenterology, the First Hospital of Chinese PLA; 3. Lanzhou Military Wudu Road Retired Cadresy, China
Objective To establish an animal model of mountain sickness by a decompression chamber and to investigate the effect of different hypoxia durations on the injury degree of liver in experimental rat.Methods Rats were housed in a decompression chamber and exposed to simulated high altitude of 6 000 meters for 1 day, 3 days, 5 days, 7 days, respectively. Pathological changes, the serum MDA content, ALT, AST, ALP activity and SOD activity were examined. Results The serum MDA content, ALT, AST, ALP activity were gradually increased with time expanded of hypoxia, especially in 5 days, 7 days, the SOD activity was obviously decreased (P<0.05).Pathological changes of liver tissues were obvious. Conclusion High altitude hypoxia can induce liver oxidative stress and cause liver damage in rat. The injury was aggravated with time expanded of hypoxia. This model provides the basis for the mechanism study of fatty liver and its prevention and control.
High altitude; Hypoxia; Liver injury; Decompression chamber

万平新,主治医师,研究方向:脂肪肝的中医药防治
万顺梅,副主任医师,研究方向:脂肪肝的防治。E-mail:lily2008960@163.com
10.3969/j.issn.1006-5709.2016.01.023
R575
A
1006-5709(2016)01-0084-03
2014-12-10

