融合表达小鼠IgG2b-Fc可增强人类免疫缺陷病毒1型 Gag DNA 疫苗的免疫原性
陈沁韵,万延民,丁相卿 ,任艳琴,肖健,徐建青
1.复旦大学附属公共卫生临床中心,上海 201508;2.复旦大学生物医学研究院,上海 200032;3.广西中医药大学基础医学院,南宁 530200
·论著·
融合表达小鼠IgG2b-Fc可增强人类免疫缺陷病毒1型 Gag DNA 疫苗的免疫原性
陈沁韵1,2,万延民1,丁相卿1,2,任艳琴1,肖健3,徐建青1,2
1.复旦大学附属公共卫生临床中心,上海 201508;2.复旦大学生物医学研究院,上海 200032;3.广西中医药大学基础医学院,南宁 530200
摘要:为阐明小鼠IgG2b-Fc对DNA疫苗免疫原性的增强作用,首先构建表达人类免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)CN54Gag基因的DNA疫苗及表达Gag与小鼠IgG2b-Fc融合基因的DNA疫苗,限制性酶切和DNA测序结果表明这两个疫苗均构建成功,蛋白免疫印迹结果也显示其正确表达。然后,利用上述DNA疫苗接种C57BL/6小鼠,比较两个DNA疫苗所诱导的特异性体液免疫反应和特异性细胞免疫反应。结果显示,融合表达小鼠IgG2b-Fc对特异性细胞免疫和体液免疫反应均有增强作用,但只有对特异性体液免疫反应的增强作用有统计学意义。
关键词:人类免疫缺陷病毒1型;人类免疫缺陷病毒疫苗;Gag;IgG-Fc
艾滋病(acquired immunodeficiency syndrome,AIDS)是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)引起的人体免疫系统方面的疾病。截至2014年底,全球约有3 690万名HIV携带者。2014年全球新发HIV感染200万例,AIDS相关死亡120万例。抗反转录病毒治疗是目前AIDS的主要治疗手段,可显著改善HIV感染者的生活质量、延长生存期,但不能完全清除病毒[1-2]。患者须终身用药,一旦停止用药,病毒载量快速反弹[3-4];而长期用药可导致耐药性产生、药物相关毒副作用增加、患者依从性不佳、经济负担重等问题[5-6]。因此,研制HIV疫苗是最终预防和控制AIDS的关键。
DNA疫苗因安全性好、易于制备及可同时刺激机体产生特异性体液和细胞免疫应答[7-8]等特点而广泛用于HIV疫苗研究,但其免疫原性较弱。因此,探索提高 DNA 疫苗免疫原性的策略和方法是 DNA 疫苗研制的重要环节。提高DNA疫苗免疫原性的途径主要有改进疫苗设计、添加佐剂、改进免疫途径和免疫方案等[9-11]。其中,利用生物分子佐剂增强免疫应答被认为是最有效的途径之一[12-13]。本研究采用小鼠IgG2b-Fc作为佐剂,构建HIV-1 Gag融合小鼠IgG2b-Fc DNA疫苗,通过小鼠免疫实验观察IgG2b-Fc对HIV-1 Gag特异性免疫反应的增强作用。
1材料与方法
1.1材料
1.1.1菌株、细胞、质粒和蛋白大肠埃希菌Top10感受态和转染用HEK293T细胞为本室保存;空载质粒pSVl.0、DNA疫苗质粒pSVl.0-CN54Gag均为本室保存。HIV-1 Gag(CN54株)原核表达蛋白购自北京安百胜生物科技有限公司。
1.1.2工具酶和主要试剂各种限制性内切酶、4 DNA连接酶和其他工具酶均购自Thermo Fisher Scientific公司,2×EasyTaq PCR SuperMix 购自北京全式金生物技术有限公司,Eastep TM 凝胶及聚合酶链反应(polymerase chain reaction,PCR)回收试剂盒购自上海普洛麦格生物产品有限公司,真核细胞转染试剂TurboFect购自Thermo Fisher Scientific公司,RPMI 1640培养基、DMEM培养基购自Corning公司,不含血清细胞培养基FreeStyle 293 Expression Medium购自Gibco公司,Protein A+G Agarose购自碧云天生物技术,6×Protein Loading Buffer购自北京全式金生物技术有限公司,质粒大量提取试剂盒(EndoFree Plasmid Giga Kit)购自德国Qiagen公司,小鼠γ干扰素(interferon γ,IFN-γ)酶联免疫斑点(enzyme-linked immunospot,ELISPOT)试剂盒购自美国BD公司,ELISPOT所用HIV-1 CN54Gag蛋白肽库由吉尔生化(上海)有限公司合成。
1.2方法
1.2.1IgG2b-Fc片段的设计与合成在美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库中检索获得C57BL/6小鼠IgG2b重链铰链区、CH2区和CH3区的编码区序列(http://www.ncbi.nlm.nih.gov/nuccore/FJ232994.1),总长720 bp,在序列5′端引入XbaⅠ酶切位点和保护碱基,3′端引入BamHⅠ酶切位点和保护碱基,序列由上海捷瑞生物工程有限公司合成。按常规分子克隆法将XbaⅠ和BamHⅠ双酶切的IgG2-Fc基因连入空载质粒pSVl.0,酶切鉴定正确的质粒送铂尚生物技术(上海)有限公司测序,鉴定无误后命名为pSV-IgG2b。
1.2.2pSV-Gag-IgG2b融合质粒的构建为有利于免疫原Gag的分泌与表达,在Gag基因前添加分泌型信号肽(secretory signal peptide)基因:人IgG1分泌型信号肽基因序列为GGATGGTC-ATGTATCATCCTTTTTCTAG TAG CAACTGC-AACC(http://www.ncbi.nlm.nih.gov/nuccore/218533931)。采用重叠延伸 PCR(overlap extension PCR),以pSVl.0-CN54Gag为模板,引入SalⅠ酶切位点、XbaⅠ酶切位点及相应的保护碱基,设计第1轮PCR上游引物F1:CATCCTTTTTCTAGTA-G CAACTG CAACCGCCGCCAGGGCCAGCAT;第2轮PCR上游引物F2:ACGCGTCGACATG-GGATGGTCATGTATCATCC TTTTTC TAGTA-GC;下游引物R:CTAGTCTAGATTCCTGGCT-GCTGGGGTCGTT。引物由上海捷瑞生物工程有限公司合成,工作浓度均为10 μmol/L。第1轮PCR反应体系:模板1 μL、2×EasyTaq PCR SuperMix 10 μL、F1 0.8 μL、R 0.8 μL、灭菌水7.4 μL。反应条件: 95 ℃ 25 s,66 ℃ 30 s,72 ℃ 1 min 20 s,30个循环。第2轮PCR反应体系:第1轮PCR扩增产物1 μL、2×EasyTaq PCR SuperMix 10 μL、F2 0.8 μL、R 0.8 μL、灭菌水7.4 μL。反应条件: 95 ℃ 25 s,66 ℃ 30 s,72 ℃ 1 min 20 s,30个循环。按常规分子克隆法将SalⅠ和XbaⅠ双酶切的Gag基因连入质粒pSV-IgG2b,酶切鉴定正确的质粒送铂尚生物技术(上海)有限公司测序,鉴定无误后命名为pSV-Gag-IgG2b。
1.2.3pSV-Gag质粒的构建构建不融合IgG2基因的对照组pSV-Gag质粒。以pSV-Gag-IgG2b融合质粒构建过程中第2轮PCR产物作为模板,设计下游引物R2:CTAGTCTAGATTATTCCTG-GCTGCTGGG。引物由上海捷瑞生物工程有限公司合成,工作浓度为10 μmol/L。PCR反应体系:模板1 μL、2×EasyTaq PCR SuperMix 10 μL、F2 0.8 μL、R2 0.8 μL、灭菌水7.4 μL。反应条件:95 ℃ 25 s,66 ℃ 30 s,72 ℃ 1 min 30 s,30个循环。按常规分子克隆法将SalⅠ和XbaⅠ双酶切的Gag基因连入空载质粒pSV1.0,酶切鉴定正确的质粒送铂尚生物技术(上海)有限公司测序,鉴定无误后命名为pSV-Gag。
1.2.4pSVl.0质粒、pSV-IgG2b质粒、pSV-Gag-IgG2b质粒和pSV-Gag质粒的体外转染在6孔板中接种6×105/mL HEK293T细胞2 mL,培养过夜,至细胞融合90%~95%,换不含血清的细胞培养基FreeStyle 293 Expression Medium,每孔2 mL。将4 μL质粒(1 μg/μL)加入400 μL不含血清和抗生素的DMEM培养基中,取转染试剂TurboFect 6 μL加入上述混合液中,涡旋振荡,室温放置20 min,加入6孔板。37 ℃、5% CO2孵育48 h后进行检测。
1.2.5DNA疫苗表达效果的检测重悬pSVl.0质粒、pSV-IgG2b质粒、pSV-Gag质粒和pSV-Gag-IgG2b质粒转染的HEK293T细胞,1 000 离心10 min,分别收取细胞和细胞培养上清液。细胞用磷酸盐缓冲液(phosphate buffered saline,PBS)洗1遍,加入6×Protein Loading Buffer进行裂解,沸水煮10 min制成十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)样品。将40 μL Protein A+G磁珠加入pSV-Gag-IgG2b质粒转染的细胞培养上清液中,4 ℃孵育过夜进行富集,1 000 离心5 min,弃上清液,加入6×Protein Loading Buffer进行裂解,沸水煮10 min制成SDS-PAGE样品。将5 μL HIV-1 p55小鼠单克隆抗体(简称单抗)加入pSV-Gag质粒转染的细胞培养上清液中,4 ℃孵育过夜,加入40 μL Protein A+G磁珠,4 ℃孵育4 h,1 000 离心5 min,弃上清液,加入6×Protein Loading Buffer进行裂解,沸水煮10 min制成SDS-PAGE样品。将细胞裂解液样品和细胞培养上清液样品进行10% SDS-PAGE。电泳所得凝胶湿转(200 mA电流,120 min)至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉封闭1 h。pSVl.0质粒、pSV-Gag质粒和pSV-Gag-IgG2b质粒转染后的样品封闭结束后,按1∶200加入HIV阳性患者血清(健康人血清作为阴性对照),室温反应2 h,用含吐温20的PBS(PBS with Tween 20,PBST)洗3次,加入1∶2 000稀释的辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗人IgG抗体,室温反应1 h,PBST洗3次,加入底物进行膜上显色。pSV-IgG2b质粒转染后的样品封闭结束后,按1∶2 000加入HRP标记的山羊抗小鼠IgG抗体,室温反应l h,PBST洗3次,加入底物进行膜上显色。1.2.6DNA疫苗的制备用EndoFree PlasmidGiga Kit试剂盒对pSV-Gag质粒和pSV-Gag-IgG2b质粒进行大量制备,所有操作按说明书进行。制备好的无内毒素的质粒溶于无菌生理盐水中,调整浓度为l mg/mL。
1.2.7动物免疫体重为18~22 g的无特定病原体(specific pathogen free,SPF)级雌性C57BL/6小鼠购自上海西普尔-必凯实验动物有限公司。将C57BL/6小鼠按体重编号,采用随机数字表法分为两组,每组5只,分别接种pSV-Gag-IgG2b质粒和pSV-Gag质粒。接种时间分别设定在第0、2、4周,接种途径为肌内注射,接种剂量为每次每只小鼠50 μg DNA。免疫结束后2周,用颈椎脱臼法处死小鼠,分离脾细胞和小鼠血浆。
1.2.8细胞免疫反应的检测HIV-1 CN54Gag蛋白肽库均包含122条单肽,按N端到C端的排列顺序,将Gag蛋白全肽库按40条/段分解为3段,配制成3个肽库:Gag-1、Gag-2和Gag-3,其中最后一个肽库包含42条肽。每个肽库设复孔进行ELISPOT检测。在ELISPOT平板每孔加100 μL IFN-γ包被抗体,4 ℃包被过夜。用RPMI 1640完全培养基200 μL/孔洗1次,加封闭液室温封闭2 h;弃封闭液,将分离的小鼠脾细胞按2×105/孔加入ELISPOT 96孔板中,实验孔加多肽至5 μg/mL,阳性孔加PMA(终浓度50 ng/mL)和离子霉素(ionomycine)(终浓度1 μg/mL),空白对照孔只加脾细胞,补充RPMI 1640完全培养基至100 μL/孔,37 ℃、5% CO2孵育24 h;甩去细胞,每孔加200 μL冰预冷的去离子水,冰浴10 min,甩干,PBST洗3次;每孔加100 μL生物素化抗体,室温孵育2 h,弃反应液,PBST洗3次,甩干;每孔加100 μL链霉亲和素(streptavidin)-HRP,室温孵育1 h,弃反应液,PBST洗4次,PBS洗2次,甩干;每1 ml显色缓冲液加1滴显色底物,混匀后,按每孔100 μL加入,室温避光反应15~30 min,出现斑点后用自来水冲洗终止反应。待板干燥后,用北京赛智ChampSpot HI酶联斑点分析仪进行计数分析。
1.2.9体液免疫反应的检测用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测抗原特异性体液免疫反应。用终浓度为1 μg/mL的HIV-1 CN54Gag蛋白包被96孔板,每孔50 μL,4 ℃过夜。次日PBST洗3次,每孔加100 μL封闭液(5%脱脂奶粉),37 ℃封闭1 h,PBST洗3次;倍比稀释小鼠血清,每孔加 50 μL,37 ℃孵育1 h;PBST洗5次,按1∶2 000加入HRP标记的山羊抗小鼠IgG抗体,每孔50 μL,37 ℃孵育1 h;PBST洗5次,OPD显色系统避光显色15 min,最后用2 mol/L H2SO4终止反应,测量492。
1.3统计学方法
2结果
2.1pSV-Gag和pSV-Gag-IgG2b的酶切鉴定
两种DNA疫苗构建模式如图1A所示。将重组质粒pSV-Gag和pSV-Gag-IgG2b分别用SalⅠ+XbaⅠ及 SalⅠ+BamHⅠ双酶切,酶切产物进行1%琼脂糖凝胶电泳。pSV-Gag质粒双酶切电泳结果显示,在5 kb附近和1.5 kb附近各出现一条带,与预期的4 992 bp和1 533 kp一致。pSV-Gag-IgG2b质粒双酶切电泳结果显示,在5 kb附近和2.5 kb与2 kb之间各出现一条带,与预期的4 977 bp和2 256 bp一致。

A:Schematic representation of DNA vaccines.B:Enzyme identification of pSV-Gag and pSV-Gag-IgG2b.1,DL15000 marker;2,pSV-Gag digested with SalI and XbaI.3,pSV-Gag-IgG2b digested with SalI and BamHI;4,DL2000 marker.
图1DNA疫苗构建模式及鉴定
Fig.1Construction and identification of DNA vaccines
2.2外源基因表达的蛋白免疫印迹结果
用TurboFect将质粒pSV1.0、pSV-IgG2b、pSV-Gag和pSV-Gag-IgG2b转染至HEK293T细胞,培养48 h后收集细胞和细胞培养上清液,制备SDS-PAGE样品,进行蛋白免疫印迹检测。以HIV阳性患者血清为一抗,在转染质粒pSV1.0的细胞裂解液样品中未出现条带;在转染质粒pSV-Gag的细胞裂解样品和细胞培养上清液样品中出现了一条相对分子质量(Mr)60 000左右的条带;在转染质粒pSV-Gag-IgG2b的细胞裂解样品和细胞培养上清液样品中出现了一条Mr95 000左右的条带。以山羊抗小鼠IgG抗体为一抗,在转染质粒pSV-IgG2b的细胞裂解液样品中出现Mr25 000左右的条带。质粒pSV-Gag和质粒pSV-IgG2b均可正常表达,融合质粒pSV-Gag-IgG2b的蛋白Mr符合预期。以健康人血清为一抗对照,在转染质粒pSV-Gag和pSV-Gag-IgG2b的细胞裂解液样品中未出现特异性条带(图2)。
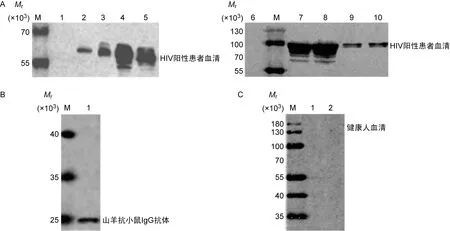
A:Western blotting of pSV1.0,pSV-Gag and pSV-Gag-IgG2b.M,protein marker;1 and 6,cell lysates of HEK293T cells transfected with pSV1.0;2 and 3,cell supernatants of HEK293T cells transfected with pSV-Gag;4 and 5,cell lysates of HEK293T cells transfected with pSV-Gag;7 and 8,cell lysates of HEK293T cells transfected with pSV-Gag-IgG2b;9 and 10,cell supernatants of HEK293T cells transfected with pSV-Gag-IgG2b.B:Western blotting of pSV-IgG2b.M,protein marker;1,cell lysates of HEK293T cells transfected with pSV-IgG2b.C.Western blotting of pSV-Gag and pSV-Gag-IgG2b with serum form healthy people.1,cell lysates of HEK293T cells transfected with pSV-Gag;2,cell lysates of HEK293T cells transfected with pSV-Gag-IgG2b.
图2蛋白免疫印迹结果
Fig.2Western blotting results
2.3免疫后小鼠的体液免疫反应检测
DNA免疫C57BL/6小鼠(50 μg/只),采用ELISA检测免疫结束后2周的小鼠特异性体液免疫反应,结果见图3。对Gag特异性总IgG效价以10为底取对数,pSV-Gag-IgG2b疫苗免疫组抗体效价为4.05±0.06,显著高于pSV-Gag疫苗免疫组的3.14±0.36(P=0.039 0)。

图3ELISA检测Gag特异性总IgG效价
Fig.3Gag specific total IgG titers detected by ELISA
2.4免疫后小鼠的细胞免疫反应检测
由于特异性T细胞在体外响应多肽刺激原时可分泌IFN-γ,基于该原理本研究采用ELISPOT检测DNA疫苗免疫小鼠诱发的特异性T细胞免疫反应。ELISPOT反应<50 SFC/106脾细胞视作无特异性T细胞反应。实验结果显示,HIV-1 Gag诱发了明显的特异性细胞免疫反应,其中pSV-Gag-IgG2b疫苗免疫组激发的针对CN54Gag肽库的总T细胞反应强度为(589.0±191.0)SFC/106脾细胞(图4A),高于对照组pSV-Gag疫苗免疫组的(344.0±68.59)SFC/106脾细胞,但两者间无统计学差异。
分析3个Gag肽库诱发的特异性T细胞反应,发现针对Gag-2肽库的T细胞反应强度最高,pSV-Gag-IgG2b疫苗免疫组为(411.0±154.0)SFC/106脾细胞,高于pSV-Gag疫苗免疫组的(245.5±64.64)SFC/106脾细胞(图4B)。针对Gag-3肽库的T细胞反应强度最低,两组均无特异性T细胞反应。pSV-Gag-IgG2b疫苗免疫组针对Gag-1肽库的T细胞反应强度为(138.8±8.93)SFC/106脾细胞,高于pSV-Gag疫苗免疫组的(98.00±47.40)SFC/106脾细胞。虽然表达HIV-1 Gag融合IgG2b-Fc基因的DNA疫苗可引起T细胞平均反应强度增高,但无统计学差异。

A:Total T cell responses of DNA vaccines.B:T cell responses after stimulation of three peptides.
图4T反应强度
Fig.4T cell response
3讨论
DNA疫苗进入动物或人体中,被局部体细胞(肌细胞、角质化细胞和成纤维细胞)或专职抗原呈递细胞(antigen presenting cell,APC)摄取,抗原基因编码的蛋白得以表达而作为疫苗的抗原。局部体细胞摄取抗原后,可通过主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类途径呈递抗原。专职APC捕获肌肉细胞分泌或凋亡肌肉细胞释放的抗原蛋白,快速转移至引流淋巴结,通过MHCⅡ类途径呈递抗原,或通过MHCⅠ类途径交叉呈递。树突细胞(dendritic cell,DC)作为最强大的专职APC,表面表达多种IgG受体(FcγR)。当抗原肽与IgG-Fc融合后,抗原肽-IgG-Fc融合蛋白可通过Fc片段与FcγR结合,介导抗原肽的呈递。这种方式可同时通过MHCⅠ和Ⅱ类途径呈递抗原,激活CD4+T细胞和CD8+T细胞,呈递效率远高于单个抗原[14-15]。因此,构建抗原肽与IgG-Fc的重组DNA疫苗可提高抗原肽的免疫原性[16]。例如,Zaharatos等[17]将HIV-1 p24抗原与小鼠IgG1-Fc和IgG2a-Fc片段进行基因融合,构建重组疫苗,结果显示融合小鼠IgG2a-Fc片段重组疫苗诱导机体产生的抗原特异性体液免疫应答提升了近10倍,而细胞免疫应答在各组间无显著差异。Wang等[18]将改造的人乳头瘤病毒58型(human papillomavirus 58,HPV58)E6 和E7基因融合人IgG-Fc及锚定蛋白糖基磷脂酰肌醇(glycosylphos-phatidylinositol,GPI),重组疫苗免疫小鼠后能产生有效的体液免疫应答和细胞免疫应答,人IgG Fc段增强了融合基因的免疫原性且利于鉴定。
由于不同 IgG亚类的Fc与不同种类的 FcγR亲和力不同[19],推测不同IgG亚类的Fc佐剂活性可能存在差异。本研究主要探讨了融合小鼠IgG2b-Fc片段对HIV-1 Gag DNA疫苗免疫原性的影响,结果显示pSV-Gag-IgG2b诱导机体产生的抗体效价与不融合Fc段的pSV-Gag疫苗相比,提升了近10倍(P=0.039 0),特异性T细胞反应在两组间无统计学差异,与Zaharatos等[17]报道的IgG2a-Fc佐剂效果相似。以往研究表明,虽然小鼠IgG2a和IgG2b均可与FcγRⅠ和FcγRⅣ结合,但IgG2a与这两种Fc受体的亲和力高于IgG2b,特别是IgG2b与活化性受体FcγRⅠ的亲和力比IgG2a低1 000倍[20]。然而,本研究发现IgG2b-Fc对HIV-1 Gag DNA疫苗免疫原性的增强作用与文献报道相近,提示Fc片段的佐剂活性并非由FcγRⅠ介导,也与Zaharatos等[17]对IgG2a-Fc的突变研究结果相符,他们发现通过突变使IgG2a丧失与FcγRⅠ的结合能力并未降低特异性免疫反应强度。此外,还不能排除其他可能提升免疫反应强度的途径,如融合Fc片段后可延长目标抗原的半衰期[21]。
综上所述,虽然IgG-Fc的佐剂活性机制尚未完全阐明,但本研究明确提示IgG2b-Fc与IgG2a-Fc具有相似的佐剂活性,为今后抗原-Fc融合疫苗的研究奠定了基础。
参考文献
[1]Maldarelli F,Palmer S,King MS,Wiegand A,Polis MA,Mican JA,Kovacs JA,Davey RT,Rock-Kress D,Dewar R,Liu SA,Rehm C,Brun SC,Hanna GJ,Kempf DJ,Coffin JM,Mellors JW.ART suppresses plasma HIV-1 RNA to a stable set point predicted by pretherapy viremia[J].PLoS Pathog,2007,3(4):484-488.
[2]Dornadula G,Zhang H,Vanuitert B,Stern J,Livornese L,Ingerman MJ,Witek J,Kedanis RJ,Natkin J,Desimone J,Pomerantz RJ.Residual HIV-1 RNA in blood plasma of patients taking suppressive highly active antiretroviral therapy[J].JAMA,1999,282(17):1627-1632.
[3]Davey RT,Bhat N,Yoder C,Chun TW,Metcalf JA,Dewar R,Natarajan V,Lempicki RA,Adelsberger JW,Miller KD,Kovacs JA,Polis MA,Walker RE,Falloon J,Masur H,Gee D,Baseler M,Dimitrov DS,Fauci AS,Lane HC.HIV-1 and T cell dynamics after interruption of highly active antiretroviral therapy(HAART)in patients with a history of sustained viral suppression[J].Proc Natl Acad Sci USA,1999,96(26):15109-15114.
[4]Chun TW,Davey RT,Engel D,Lane HC,Fauci AS.AIDS:Re-emergence of HIV after stopping therapy[J].Nature,1999,401(6756):874-875.
[5]Vidal F,Gutiérrez F,Gutiérrez M,Olona M,Sánchez V,Mateo G,Peraire J,Viladés C,Veloso S,López-Dupla M,Domingo P.Pharmacogenetics of adverse effects due to antiretroviral drugs[J].AIDS Rev,2010,12(1):15-30.
[6]Deeks SG,Phillips AN.HIV infection,antiretroviral treatment,ageing,and non-AIDS related morbidity[J/OL].BMJ,2009.http://www.bmj.com/content/338/bmj.a3172.long.
[7]Donnelly JJ,Ulmer JB,Shiver JW,Liu MA.DNA vaccines[J].Annu Rev Immunol,1997,15:617-648.
[8]Tang DC,Devit M,Johnston SA.Genetic immunization is a simple method for eliciting an immune response[J].Nature,1992,356(6365):152-154.
[9]Saade F,Petrovsky N.Technologies for enhanced efficacy of DNA vaccines[J].Expert Rev Vaccines,2012,11(2):189-209.
[10]Tregoning JS,Kinnear E.Using plasmids as DNA vaccines for infectious diseases[J/OL].Microbiol Spectr,2014.http://www.asmscience.org/content/journal/microbiolspec/10.1128/microbiolspec.PLAS-0028-2014.
[11]Felber BK,Valentin A,Rosati M,Bergamaschi C,Pavlakis GN.HIV DNA vaccine:Stepwise improvements make a difference[J].Vaccines(Basel),2014,2(2):354-379.
[12]Flingai S,Czerwonko M,Goodman J,Kudchodkar SB,Muthumani K,Weiner DB.Synthetic DNA vaccines:improved vaccine potency by electroporation and co-delivered genetic adjuvants[J/OL].Front Immunol,2013.http://journal.frontiersin.org/article/10.3389/fimmu.2013.00354/full.
[13]Scheerlinck J.Genetic adjuvants for DNA vaccines[J].Vaccine,2001,19(17-19):2647-2656.
[14]Regnault A,Lankar D,Lacabanne V,Rodriguez A,Théry C,Rescigno M,Saito T,Verbeek S,Bonnerot C,Ricciardi-Castagnoli P,Amigorena S.Fcgamma receptor-mediated induction of dendritic cell maturation and major histocompatibility complex class I-restricted antigen presentation after immune complex internalization[J].J Exp Med,1999,189(2):371-380.
[15]Rafiq K,Bergtold A,Clynes R.Immune complex-mediated antigen presentation induces tumor immunity[J].J Clin Invest,2002,110(1):71-79.
[16]Czajkowsky DM,Hu J,Shao ZF,Pleass RJ.Fc-fusion proteins:new developments and future perspectives[J].EMBO Mol Med,2012,4(10):1015-1028.
[17]Zaharatos GJ,Yu J,Pace C,Song Y,Vasan S,Ho DD,Huang Y.HIV-1 and influenza antigens synthetically linked to IgG2a Fc elicit superior humoral responses compared to unmodified antigens in mice[J].Vaccine,2011,30(1):42-50.
[18]Wang H,Yu J,Li L.A DNA vaccine encoding mutated HPV58 mE6E7-Fc-GPI fusion antigen and GM-CSF and B7.1[J].Onco Targets Ther,2015,8:3067-3077.
[19]Nimmerjahn F,Ravetch JV.Fcgamma receptors as regulators of immune responses[J].Nat Rev Immunol,2008,8(1):34-47.
[20]Guilliams M,Bruhns P,Saeys Y,Hammad H,Lambrecht BN.The function of Fcgamma receptors in dendritic cells and macrophages[J].Nat Rev Immunol,2014,14(2):94-108.
[21]Zhang MY,Wang Y,Mankowski MK,Ptak RG,Dimitrov DS.Cross-reactive HIV-1-neutralizing activity of serum IgG from a rabbit immunized with gp41 fused to IgG1 Fc:possible role of the prolonged half-life of the immunogen[J].Vaccine,2009,27(6):857-863.
Fusion expression of mouse IgG2b-Fc improves immunogenicity of human immunodeficiency virus type 1 Gag DNA vaccine
CHEN Qinyun1,2,WAN Yanmin1,DING Xiangqing1,2,REN Yanqin1,XIAO Jian3,XU Jianqing1,2
1.Shanghai Public Health Clinical Center Affiliated to Fudan University,Shanghai 201508,China;2.Institute of Biomedical Sciences,Fudan University,Shanghai 200032,China;3.School of Basic Medical Science,Guangxi University of Chinese Medicine,Nanning 530200,China
Abstract:To explore the immunogenicity of DNA vaccine expressing IgG2b-Fc,eukaryotic expression vectors pSV-Gag and pSV-Gag-IgG2b were constructed.The constructed DNA vaccines were validated by restriction enzyme digestion and DNA sequencing.Western blotting results showed both of the two DNA vaccines could be expressed at appreciable levels .C57BL/6 mice were injected with these two DNA vaccines by intramuscular injection and their antigen-specific humoral responses and T cell responses were compared after the last immunization.The results showed that human immunodeficiency virus type 1(HIV-1)Gag fused with mouse IgG2b-Fc elicited superior Gag-specific humoral responses and T cell responses,but there was only significant increase in antigen-specific humoral responses between the two DNA vaccines.
Key words:Human immunodeficiency virus type 1;Human immunodeficiency virus vaccine;Gag;IgG-Fc
基金项目:广西自然科学基金(2012GXNSFAA053120)
通信作者:徐建青
Corresponding author.XU Jianqing,E-mail:xujianqing2014@126.com
(收稿日期:2016-01-19)

