内毒素耐受对核苷酸结合寡聚化结构域2信号通路的影响
张辉军,王葆青,瞿介明
1.复旦大学附属中山医院肺科,上海 200032;2.上海交通大学医学院附属瑞金医院呼吸科,上海 200025
·论著·
内毒素耐受对核苷酸结合寡聚化结构域2信号通路的影响
张辉军1,王葆青1,瞿介明2
1.复旦大学附属中山医院肺科,上海 200032;2.上海交通大学医学院附属瑞金医院呼吸科,上海 200025
摘要:为研究内毒素耐受对核苷酸结合寡聚化结构域2(nucleotide-binding oligomerization domain containing 2,NOD2)信号通路的影响,将小鼠单核-巨噬细胞RAW264.7分为两组,分别给予小剂量脂多糖(lipopolysaccharide,LPS)(100 ng/mL)或磷酸盐缓冲液(phosphate buffered saline,PBS)预处理20 h,建立内毒素耐受组和对照组。每组细胞分别给予大剂量LPS(1 000 ng/mL)或热灭活烟曲霉孢子刺激,于刺激后0、2、6、12、24 h采用定量聚合酶链反应(polymerase chain reaction,PCR)检测细胞NOD2、受体相互作用蛋白2(receptor-interacting protein 2,RIP2)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)mRNA表达;采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测细胞上清液中白细胞介素8(interleukin 8,IL-8)和TNF-α浓度。结果显示,内毒素耐受组无论是大剂量LPS还是热灭活烟曲霉孢子刺激均不能增加NOD2、RIP2 和TNF-α mRNA表达及细胞上清液中IL-8、TNF-α浓度;而对照组大剂量LPS和热灭活烟曲霉孢子刺激均可提高NOD2、RIP2 和TNF-α mRNA表达及细胞上清液中IL-8、TNF-α浓度,尤以刺激后12 h增加显著,与刺激前(0 h)比较,差异有统计学意义(P<0.05)。结果提示,内毒素耐受可能对NOD2信号通路有抑制作用。
关键词:内毒素耐受;脂多糖;核苷酸结合寡聚化结构域2;烟曲霉
内毒素是革兰阴性细菌细胞壁组分中的一种脂多糖(lipopolysaccharide,LPS),能激发过度炎症反应,是临床上全身炎症反应综合征或感染性休克的常见原因[1]。内毒素耐受(endotoxin tolerance,ET)是指接受小剂量LPS刺激后形成的对后续大剂量LPS呈低反应或无反应的现象,其在动物模型和人体中均得到证实[2]。然而,到目前为止内毒素耐受机制还未完全明确[3]。
先天性免疫是机体抵御病原微生物入侵的第一道屏障。动物的先天性免疫主要通过模式识别受体(pattern recognition receptor,PRR)识别病原体相关分子模式(pathogen-associated molecular pattern,PAMP)来实现的。LPS是目前研究最多的PAMP,它是Toll样受体4(Toll-like receptor 4,TLR4)的特异性配体。当LPS与TLR4结合,TLR4被激活,继而激活核因子κB(nuclear factor κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK),引起大量促炎性细胞因子释放。核苷酸结合寡聚化结构域2(nucleotide-binding oligomerization domain containing 2,NOD2)蛋白是一种胞质内PRR,又称为凋亡加强结构域蛋白15(caspase recruitment domain-containing protein 15,CARD15),表达于中性粒细胞、树突细胞、上皮细胞中,主要参与胞质内病原微生物的识别。现已证实NOD2蛋白在抗细菌感染免疫中起重要作用。此外,本课题组以前的研究还发现NOD2与机体识别烟曲霉(Aspergillus,Af)的天然免疫反应有关,热灭活烟曲霉(heat-killed Aspergillus,HAf)孢子刺激可上调NOD2蛋白的表达,增加促炎性细胞因子的释放[4-5]。NOD2识别的配体主要为胞壁酰二肽(muramyl dipeptide,MDP),这是一种存在于所有革兰阴性和阳性细菌细胞壁内具有生物活性的肽聚糖的基本结构。NOD2识别细菌成分后诱导自身寡聚化,募集受体相互作用蛋白2(receptor-interacting protein 2,RIP2),并与RIP2相互作用;然后 RIP2与NF-κB抑制蛋白(inhibitor of NF-κB,IκB)激酶相互作用,激活NF-κB,促进促炎性细胞因子的转录[6-7]。
PRR一直是免疫学研究的热点,但到目前为止,关于NOD2在内毒素耐受中的作用研究较少。有研究发现,NOD2配体可增加LPS诱导的细胞因子释放,这种协同作用在内毒素休克时也可观察到[8]。Pauleau等发现2-/-小鼠内毒素休克时的存活率增加[9]。此外,Kim等研究也发现LPS诱导的促炎性细胞因子释放需NOD2的存在[10]。这些研究均提示,NOD2信号通路与LPS诱导的促炎性细胞因子释放有关,因此推测NOD2信号通路有可能参与内毒素耐受的过程。对此进行研究,将有助于阐明内毒素耐受的机制,并为内毒素耐受应用于临床提供理论依据。
1材料与方法
1.1材料
小鼠单核-巨噬细胞系RAW264.7细胞株购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所。烟曲霉菌株由复旦大学附属华山医院皮肤科真菌研究室惠赠。实时聚合酶链反应(polymerase chain reaction,PCR)相关试剂有TRIzolTMReagent(Invitrogen,USA)、SuperScript Ⅱ(Invitrogen,US)、Ex Taq®Hot-Start Version 2.0 for Real-time PCR Kit(TaKaRa公司)、SYBR®Green Ⅰ荧光定量PCR检测试剂盒(TaKaRa公司)。白细胞介素8(interleukin 8,IL-8)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海森雄科技实业有限公司。
1.2方法
1.2.1烟曲霉孢子的收获将烟曲霉菌株接种于沙氏琼脂培养基,37 ℃培养4 d。在超净工作台内用生理盐水冲洗培养基表面,收集分生孢子悬液,8层纱布过滤以去除菌丝;将孢子悬液转入离心管中,3 000 r/min离心15 min,去除上清液,孢子重悬于生理盐水中;用血球计数板计孢子数,调整孢子悬液密度为6.7×109/mL,煮沸1 h灭活;将收获的热灭活烟曲霉孢子悬液稀释100倍,接种于沙氏琼脂培养基以检测孢子活性。
1.2.2细胞培养及处理将RAW264.7细胞调整密度为5×105/mL,接种于24孔培养板,每孔1 mL,4 h 后细胞完全贴壁。细胞贴壁后内毒素耐受组加小剂量LPS,终浓度为100 ng/mL;对照组加等体积磷酸盐缓冲液(phosphate buffered saline,PBS)。20 h后弃上清液,用相应的无血清培养液洗2遍,加新鲜培养液,2 h后给予大剂量LPS(1 000 ng/mL)或热灭活烟曲霉孢子(细胞/孢子比为1∶10)刺激,每组于加入大剂量LPS或热灭活烟曲霉孢子后0、2、6、12、24 h取样本。该实验独立重复3次。
1.2.3实时PCR检测mRNA基因引物合成:通过文献检索获得引物序列(表1),应用引物设计软件Primer Primer 5.0和PubMed BLAST验证引物,反转录PCR产物经1.5%琼脂糖凝胶电泳证实目的条带大小符合,无明显杂带。
在相应时间点取样本,用冰PBS洗3遍,每孔加0.3 mL TRIzol反复吹打,使细胞变性,收集至1.5 mL无酶Eppendorf管,-70 ℃保存。提取细胞总RNA,反转录成cDNA,用定量PCR分别检测NOD2、RIP2、TNF-α mRNA及管家基因GAPDH mRNA,每次检测时将外参标准品进行10倍梯度稀释,取4个梯度(106、105、104、103copies/μL)作为扩增标准品,采用iCycle定量PCR专用分析软件根据循环阈值(cycle threshold,Ct)绘制标准曲线,根据各测定孔的Ct值在标准曲线上确定对应的log基因拷贝数(log copy number),自动列出最终定量结果,以其拷贝数与GAPDH的比值作为基因的最终相对表达量。
表1定量PCR引物序列
Tab.1Primers of quantitative PCR

GeneSense(5'-3')Antisense(5'-3')LengthNOD2GAAGTACATCCGCACCGAGGACACCATCCATGAGAAGACAG174bpRIP2ACGTCTGCAGCCTGGTATAGCAGGGCATCTAGCGACTGGTTAA101bpTNF-αGGTTTCGAAGTGGTGGTCTTGCCTGCCCCAATCCCTTTATT131bpGAPDHGGTATCGTGGAAGGACTCATGACATGCCAGTGAGCTTCCCGTTCAGC188bp
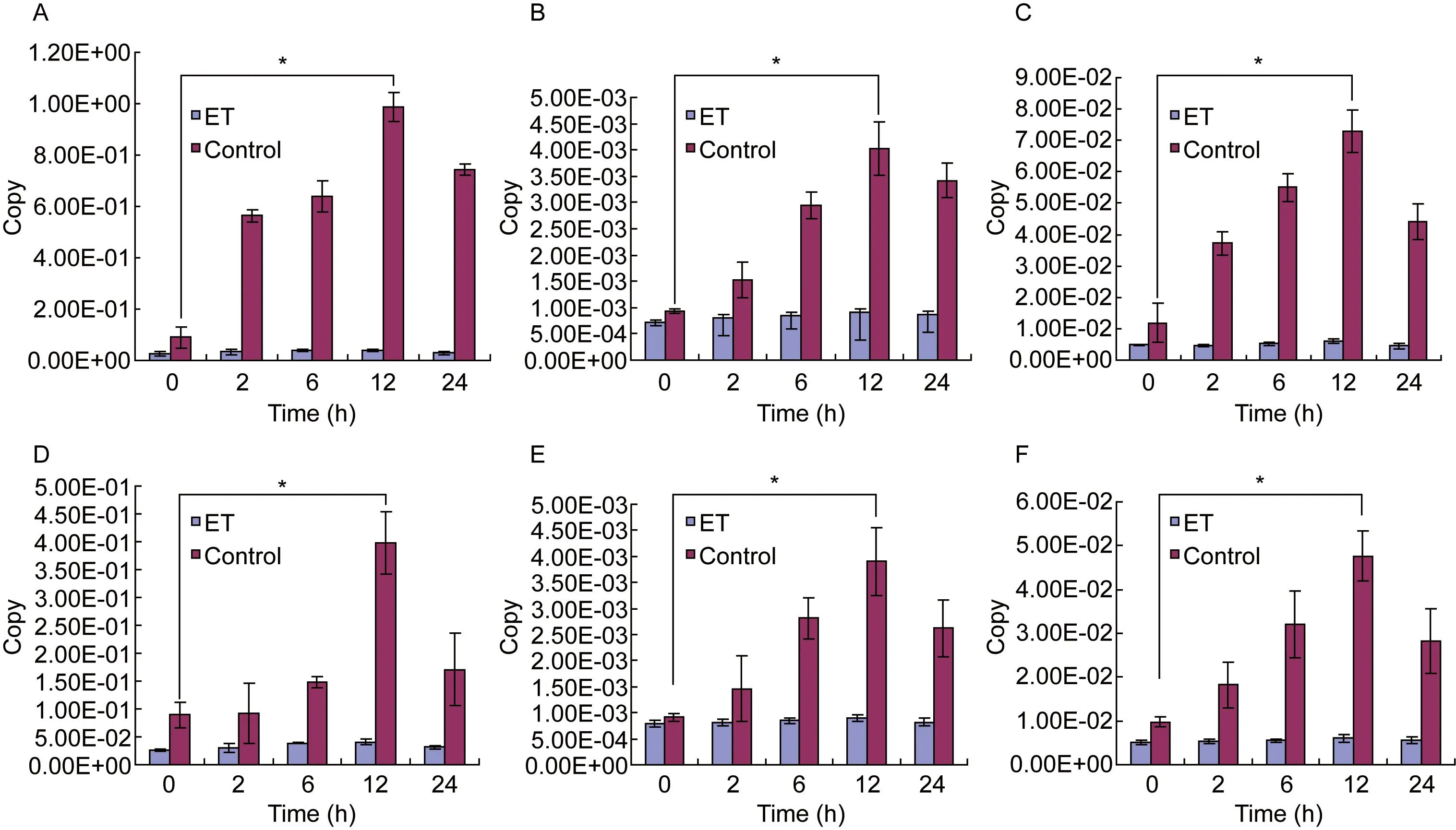
A:Expression of NOD2 mRNA after stimulation of LPS.B:Expression of RIP2 mRNA after stimulation of LPS.C:Expression of TNF-α mRNA after stimulation of LPS.D:Expression of NOD2 mRNA after stimulation of HAf.E:Expression of RIP2 mRNA after stimulation of HAf.F:Expression of TNF-α mRNA after stimulation of HAf.
图1定量PCR检测NOD2、RIP2、TNF-α mRNA表达
Fig.1Expressions of NOD2,RIP2 and TNF-α mRNA detected by quantitative PCR
1.2.4ELISA检测细胞上清液中IL-8和TNF-α浓度采用定量夹心酶联免疫技术统一检测各时间点细胞培养上清液中IL-8和TNF-α浓度,具体步骤按说明书操作。
1.3统计分析
采用SPSS 12.0软件处理数据,采用单因素方差分析,P<0.05为有显著性差异。
2结果
2.1NOD2、RIP2和TNF-α mRNA的表达
内毒素耐受组细胞接受大剂量LPS或热灭活烟曲霉孢子刺激后各时间点(2、6、12、24 h)NOD2、RIP2、TNF-α mRNA表达与刺激前(0 h)比较无显著增加;对照组细胞接受大剂量LPS或热灭活烟曲霉孢子刺激后各时间点(2、6、12、24 h)NOD2、RIP2、TNF-α mRNA表达增加,尤以12 h时最显著,与刺激前(0 h)比较,差异有统计学意义(P<0.05)(图1)。
2.2细胞上清液中IL-8和TNF-α浓度
内毒素耐受组细胞接受大剂量LPS或热灭活烟曲霉孢子刺激后各时间点(2、6、12、24 h)与刺激前(0 h)比较,细胞上清液中IL-8和TNF-α浓度无显著增加;对照组细胞接受大剂量LPS或热灭活烟曲霉孢子刺激后各时间点(2、6、12、24 h)细胞上清液中IL-8和TNF-α浓度增加,尤以12 h时最显著,与刺激前(0 h)比较,差异有统计学意义(P<0.05)(图2)。

A:Concentration of IL-8 after stimulation of LPS.B:Concentration of TNF-α after stimulation of LPS.C:Concentration of IL-8 after stimulation of HAf.D:Concentration of TNF-α after stimulation of HAf.
图2ELISA检测细胞上清液中IL-8和TNF-α浓度
Fig.2Concentrations of IL-8 and TNF-α detected by ELISA
3讨论
天然免疫系统能对危险信号如细菌、肿瘤、组织损伤进行监测并作出反应。监测到危险信号时,天然免疫系统可被激活,PRR在此过程中发挥重要作用。然而,过度炎症反应对机体是有害的,机体需一些重要机制对炎症反应进行精密调节,以防止发生感染性休克、自身免疫性疾病等不良后果。其中一个重要机制就是内毒素耐受[2,11]。促炎性细胞因子TNF-α可能是评判内毒素耐受最好的标记。在LPS耐受体内实验中,第一次LPS刺激后TNF-α分泌迅速升高,给予LPS再次刺激后TNF-α分泌显著减少[12]。本实验选择小鼠单核-巨噬细胞RAW264.7作为细胞模型,首先给予小剂量LPS预刺激,当再给予大剂量LPS刺激时TNF-α和IL-8释放无明显增加;而对照组给予大剂量LPS刺激后TNF-α和IL-8释放显著增加,证明内毒素耐受细胞模型建立成功。
有研究发现,LPS预刺激不仅可对后续大剂量LPS刺激起保护作用,还可减少其他炎症刺激所引起的促炎性细胞因子释放,如革兰阳性细菌感染[13]。而革兰阳性细菌细胞壁成分MDP是NOD2的特异性配体,提示LPS预处理可能对NOD2的功能产生影响。现已证实,NOD2信号通路不仅在细菌感染免疫中发挥重要作用,在抗烟曲霉感染免疫中也发挥重要作用,Wu等[14]研究发现烟曲霉刺激可增加NOD2和RIP2的表达;通过RNA干扰减少NOD2基因表达,则可减少烟曲霉诱导的促炎性细胞因子产生。Wu等[14]的研究还发现,经抗TLR2抗体预处理阻断TLR2,可减少MDP诱导的促炎性细胞因子释放,提示NOD2信号通路与TLR2信号通路存在某种密切联系。LPS是TLR4的特异性配体,虽然科学家们对TLR4信号通路和NOD2信号通路分别进行了深入研究,但关于两者相互联系的研究较少。Selvanantham等研究发现,细菌感染时NOD2蛋白能协同TLR4增加IL-2的产生并促进恒定自然杀伤T细胞(invariant nature killer T cell,iNKT细胞)的激活[15]。在过度表达NOD2的sw620细胞中,LPS诱导的IL-8产生明显增加[16]。这些研究结果均提示,NOD2信号通路与TLR4信号通路在机体抗感染免疫反应中密切相关,但具体机制尚未明确。本研究发现,对于小剂量LPS预处理的RAW264.7细胞,无论是用大剂量LPS还是热灭活烟曲霉孢子刺激,均未能上调NOD2、RIP2基因的表达,同时TNF-α、IL-8的分泌受到抑制;而对照组细胞大剂量LPS和热灭活烟曲霉孢子刺激均显著上调NOD2、RIP2基因的表达,显著增加TNF-α、IL-8的分泌,提示LPS预处理对NOD2信号通路产生抑制作用,从而减少了促炎性细胞因子释放。
综上所述,内毒素耐受可抑制NOD2信号通路,但具体机制和意义有待进一步研究。
参考文献
[1]Castegren M,Skorup P,Lipcsey M,Larsson A,Sjölin J.Endotoxin tolerance variation over 24 h during porcine endotoxemia:association with changes in circulation and organ dysfunction[J].PLoS One,2013,8(1):e53221.
[2]López-Collazo E,del Fresno C.Pathophysiology of endotoxin tolerance:mechanisms and clinical consequences[J].Crit Care,2013,17(6):242-253.
[3]Bessede A,Gargaro M,Pallotta MT,Matino D,Servillo G,Brunacci C,Bicciato S,Mazza EM,Macchiarulo A,Vacca C,Iannitti R,Tissi L,Volpi C,Belladonna ML,Orabona C,Bianchi R,Lanz TV,Platten M,Della Fazia MA,Piobbico D,Zelante T,Funakoshi H,Nakamura T,Gilot D,Denison MS,Guillemin GJ,Duhadaway JB,Prendergast GC,Metz R,Geffard M,Boon L,Pirro M,Iorio A,Veyret B,Romani L,Grohmann U,Fallarino F,Puccetti P.Aryl hydrocarbon receptor control of a disease tolerance defence pathway[J].Nature,2014,511(758):184-190.
[4]Zhang HJ,Qu JM,Shao CZ,Zhang J,He LX,Yuan ZH.Aspergillus fumigatus conidia upregulates NOD2 protein expression both in vitro and in vivo[J].Acta Pharmacol Sin,2008,29(10):1202-1208.
[5]Li ZZ,Tao LL,Zhang J,Zhang HJ,Qu JM.Role of NOD2 in regulating the immune response to Aspergillus fumigatus[J].Inflamm Res,2012,61(6):643-648.
[6]Antosz H,Osiak M.NOD1 and NOD2 receptors:integral members of the innate and adaptive immunity system[J].Acta Biochim Pol,2013,60(3):351-360.
[7]Boyle JP,Parkhouse R,Monie TP.Insights into the molecular basis of the NOD2 signalling pathway[J].Open Biol,2014,4(12):140178-140190.
[8]Farzi A,Reichmann F,Meinitzer A,Mayerhofer R,Jain P,Hassan AM,Fröhlich EE,Wagner K,Painsipp E,Rinner B,Holzer P.Synergistic effects of NOD1 or NOD2 and TLR4 activation on mouse sickness behavior in relation to immune and brain activity markers[J].Brain Behav Immun,2015,44:106-120.
[9]Pauleau AL,Murray PJ.Role of NOD2 in the response of macrophages to Toll-like receptor agonists[J].Mol Cell Biol,2003,23(21):7531-7539.
[10]Kim H,Zhao QJ,Zheng H,Li X,Zhang T,Ma XJ.A novel crosstalk between TLR4- and NOD2-mediated signaling in the regulation of intestinal inflammation[J].Sci Rep,2015,5(5):12018-12034.
[11]Lee KH,Biswas A,Liu YJ,Kobayashi KS.Proteasomal degradation of NOD2 protein mediates tolerance to bacterial cell wall components[J].J Biol Chem,2012,287(47):39800-39811.
[12]Cavaillon JM,Adib-Conquy M.Bench-to-bedside review:endotoxin tolerance as a model of leukocyte reprogramming in sepsis[J].Crit Care,2006,10(5):233.
[13]Bohannon JK,Hernandez A,Enkhbaatar P,Adams WL,Sherwood ER.The immunobiology of Toll-like receptor 4 agonists:from endotoxin tolerance to immunoadjuvants[J].Shock,2013,40(6):451-462.
[14]Wu J,Zhang Y,Xin Z,Wu X.The crosstalk between TLR2 and NOD2 in Aspergillus fumigatus keratitis[J].Mol Immunol,2015,64(2):235-243.
[15]Selvanantham T,Escalante NK,Cruz Tleugabulova M,Fiévé S,Girardin SE,Philpott DJ,Mallevaey T.NOD1 and NOD2 enhance TLR-mediated invariant NKT cell activation during bacterial infection[J].J Immunol,2013,191(11):5646-5654.
[16]Rosenstiel P,Fantini M,Bräutigam K,Kühbacher T,Waetzig GH,Seegert D,Schreiber S.TNF-alpha and IFN-gamma regulate the expression of the NOD2(CARD15)gene in human intestinal epithelial cells[J].Gastroenterology,2003,124(4):1001-1009.
Effect of endotoxin tolerance on nucleotide-binding oligomerization domain containing 2 signaling pathway
ZHANG Huijun1,WANG Baoqing1,QU Jieming2
1.Department of Pulmonary Medicine,Zhongshan Hospital,Fudan University,Shanghai 200032,China;2.Department of Pulmonary Medicine,Ruijin Hospital,Shanghai Jiao Tong University School of Medicine,Shanghai 200025,China
Abstract:To investigate the potential effect of endotoxin tolerance on nucleotide-binding oligomerization domain containing 2(NOD2)signaling pathway,murine macrophage RAW264.7 cells were pretreated with lipopolysaccharide(LPS,100 ng/mL)or phosphate buffered saline(PBS)for 20 h to establish endotoxin tolerance group and control group respectively.Both groups were subjected to the treatment with LPS(1 000 ng/mL)or heat-killed Aspergillus(HAf).The mRNA levels of NOD2,receptor-interacting protein 2(RIP2)and tumor necrosis factor α(TNF-α)were measured at 0,2,6,12,24 h after stimulation by real-time quantitative polymerase chain reaction(PCR).The concentrations of secreted TNF-α and interleukin 8(IL-8)were also quantified by enzyme-linked immunosorbent assay(ELISA).The collective results showed that neither LPS nor HAf had any significant effect on NOD2,RIP2,and TNF-α transcription or TNF-α and IL-8 secretion in the endotoxin tolerance group.On the contrary,a clear up-regulation was detected in the control group upon either LPS or HAf treatment,concomitant with a peak at 12 h after stimulation.These data indicate that the NOD2 signaling pathway might be suppressed under endotoxin tolerance conditions.
Key words:Endotoxin tolerance;Lipopolysaccharide;Nucleotide-binding oligomerization domain containing 2;Aspergillus
基金项目:教育部高等学校博士学科点-新教师基金资助(20090071120029)
通信作者:瞿介明
Corresponding author.QU Jieming,E-mail:jmqu0906@163.com
(收稿日期:2015-11-18)

