葡萄VvMSA基因的克隆及表达特性分析
张岁芳,朱 丹,马 倩,侯丽霞,尹鹏飞,刘 新
(青岛农业大学生命科学学院,山东省高校植物生物技术重点实验室,山东青岛 266109)
葡萄VvMSA基因的克隆及表达特性分析
张岁芳,朱 丹,马 倩,侯丽霞,尹鹏飞,刘 新
(青岛农业大学生命科学学院,山东省高校植物生物技术重点实验室,山东青岛 266109)
为了解VvMSA基因的功能,以抗性葡萄品种Vidal Blanc组培苗为试材,克隆得到VvMSA基因,对其序列进行了生物信息学分析,并利用实时定量PCR分析了其组织表达特性和多种非生物胁迫和信号应答表达特性。结果表明,VvMSA基因片段大小为450 bp,编码149个氨基酸序列。生物信息学分析结果显示,VvMSA蛋白分子量约为16.703 kDa,等电点为5.68,不稳定系数为41.71,推测为不稳定蛋白。VvMSA含有65个氨基酸组成的ABA/WDS保守结构域。在进化上属于单独一个分支,它和已报道过的番茄LeASR1分别属于同一个祖先进化出的2个分支。实时荧光定量PCR分析显示,VvMSA在葡萄不同组织中均有表达,花中表达量最高。多种逆境胁迫因子如盐、干旱和低温等能诱导VvMSA不同程度的上调表达,盐胁迫3 h时诱导表达量最高。同时,VvMSA受逆境胁迫信号分子NO和H2S不同程度诱导表达上调,而SA则抑制VvMSA表达。激素ABA、GA3、IAA和ET均能不同程度诱导VvMSA表达上调,并且VvMSA盐处理下的表达模式与ABA诱导的类似。综合以上结果推断VvMSA可能通过调控ABA信号途径来调节葡萄对盐胁迫应答。
葡萄;VvMSA;基因克隆;表达分析
葡萄(Vitis vinifera L.)属于葡萄科葡萄属,落叶藤本植物,其果实属于浆果,葡萄皮薄而多汁,酸甜味美,营养丰富。葡萄浆果具有优良的酿酒特性和较高的食用价值,此外,还可以制干、制汁、制罐头等。我国的主栽葡萄品种为欧亚种,其抗逆性差。近年来由于葡萄基因组测序完成,利用分子生物学手段研究葡萄品质、生长发育以及抗逆分子机理也成为焦点,如参与葡萄抵御低温过程的VvIPK2[1]和VvBAP1[2]、葡萄灰霉病菌Flipper转座子的研究[3]、VvFT/TFL在山葡萄开花中的表达[4]等。
ASR(Abscisic acid,stress,ripening-induced)基因是近年来植物中发现的一类受到脱落酸 (Abscisic acid,ABA)、逆境(干旱、盐、冷害、有限光照等)以及成熟诱导的基因[5-7]。自Iusem等1993年首次从番茄中分离了番茄ASR1后,该基因作为植物应答一系列胁迫的潜在关键调控子,开始被人们所关注[8-10]。随后,陆续从番茄中得到了其他ASR基因序列。至今,已经有很多双子叶和单子叶植物ASR基因被克隆出来[11],包括荔枝[12]、烟草[13]、大豆[14]、甘蔗[15]、葡萄[16]和香蕉[17]等,但其命名较为混乱,例如,在葡萄中命名为VvMSA,火炬松中命名为LP3。
研究表明,几乎所有已知的ASR都包含2个高度保守的区域。第1区域是一个短的N端伸展结构,含6~7个组氨酸残基,可能构成一个锌结合位点,具体功能尚未研究透彻[18];第2个区域是一个长的C端核定位信号区域[19],对应80个氨基酸。这个区域高度保守,含有1个ABA/WDS(Abscisicacid/water deficit stress)保守结构域。且ASR蛋白分子量小,富含His、Glu和Lys,具有很强的亲水性。不同物种中,ASR家族基因的数目具有较大差别,目前已知:玉米中有9个家族成员[20],是已知成员数最多的物种。番茄中有5个成员[21],香蕉中至少有4个成员[22],而葡萄中只有1个成员[16]。但是,在模式植物拟南芥中,没有ASR家族成员[23]。研究发现,同一个ASR家族的不同成员可在不同器官中表达,其表达特性有所差异。如:ASR在杏、甜瓜和柚的果实中表达[24],在松树根部、番茄、水稻和玉米的叶片、马铃薯块茎以及百合花粉中表达[25]。番茄ASR1蛋白有类似于分子伴侣的活性[26],对干旱胁迫敏感,而番茄ASR2蛋白则可能参与韧皮部伴胞细胞的新陈代谢[27]。但目前尚未系统研究葡萄中该基因的表达特性,探明葡萄ASR基因的组织表达特性和诱导表达特性,将为葡萄优质抗逆品种的选育提供理论基础。
1 材料和方法
1.1 试验材料
试验材料为葡萄抗性品种Vidal Blanc,使用其一年生枝条的新梢为供试外植体,经外植体的消毒处理后接种于生根培养基上,于正常光照培养条件下获得无菌组培苗,并通过扩繁获得大量所需的植物试材,具体消毒和培养方法见文献[2]。
1.2 材料处理
取生长4周龄优质高抗葡萄品种Vidal Blanc的组培苗,分别用NaCl(150 mmol/L)、4℃、甘露醇(Mannitol 200 mmol/L)、水杨酸(Salicylic acid,SA 1 mmol/L)、一氧化氮(Nitric oxide,NO)供体硝普钠(Sodium nitroprusside,SNP 0.1 mmol/L)、硫化氢(Hydrogen sulfide,H2S)供体硫氢化钠(Sodium hydrosulfide,NaHS 0.1 mmol/L)、过氧化氢(Hydrogen peroxide,H2O20.1%)、乙烯(Ethylene,ET)前体1-氨基环丙烷-1-羧酸(1-am inocyclopropanecarboxylic acid,ACC 100μmol/L)、脱落酸(Abscisic acid,ABA 100μmol/L)、赤霉素(Gibberellin,GA3100μmol/L)、生长素(Auxin,IAA 50 mmol/L)处理,处理0,3,6,9,12,24 h后,取叶片液氮速冻用于提取总RNA,研究基因相对表达量[2]。
取Vidal Blanc盆栽苗一年生枝条的根、卷须、茎、幼叶、功能叶、花芽、花、幼果、转色期果实和成熟果实,提取总RNA,反转为cDNA。实时荧光定量PCR检测VvMSA相对表达量变化,研究VvMSA基因组织表达特异性。
1.3 试验方法
1.3.1 总RNA的提取和cDNA合成 使用CTAB法提取葡萄总RNA[1],使用TaKaRa反转录试剂盒合成cDNA。
1.3.2 VvMSA基因的克隆 根据品种白玉霓VvMSA同源序列,使用引物设计软件(Primer 5.0)设计特异性引物:Sense:5′-GCTCTAGACTCTCTC GTTTCTACAGCTAATTTGATC-3′,包含XbaⅠ酶切位点(下划线)Anti-sense:5′-GGGGTACCCTAGAAAAG ATGGTGATGCTTCTTTCC-3′,包含KpnⅠ酶切位点(下划线)。由上海桑尼生物工程有限公司合成。PCR反应条件:94℃5 min;94℃30 s,60℃30 s;72℃45 s;72℃10 m in,4℃保存,其中变性、退火、延伸为30个循环。使用TaKaRa胶回收试剂盒回收PCR产物,与pMD19-T载体连接,转化,挑取阳性克隆送上海桑尼生物工程有限公司测序。
1.3.3 VvMSA序列生物信息学分析 使用软件DNAStar对目的氨基酸序列进行了理化性质分析;通过MEGA5.0软件分析了VvMSA蛋白与其他植物ASR家族蛋白的同源性。使用在线分析软件NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)和ProtScale(http://web.web.expasy.org/protscale)对VvMSA氨基酸序列分别进行磷酸化位点和疏水性/亲水性分析[28]。
1.3.4 VvMSA基因表达特性分析 使用实时荧光定量PCR检测VvMSA基因相对表达量变化。根据VvMSA基因序列设计定量引物:Sense:5′-CACAA GTCGGAGAAAGACC-3′,Anti-sense:5′-GAGACCCA GGAAACAAGAC-3′;Actin sense:5′-AATGAGAGAT GGCTGGAAGAG-3′,Anti-sense:5′-TACGAGCAAGA GCTGGAAA-3′。实时荧光定量PCR条件为:95℃60 s;95℃10 s;56℃20 s;72℃20 s,40个循环。Melt曲线从72~99℃,第1步维持45 s,以后每升高1℃维持5 s。每个样品3次重复。Actin为内参,使用2-ΔΔCt法[29]计算VvMSA相对表达量。所有试验结果均为3次重复的平均值±标准误差。
2 结果与分析
2.1 VvMSA基因克隆
从抗性葡萄品种Vidal Blanc的cDNA模板中扩增得到目的基因VvMSA,如图1-A所示:在约500 bp处有一条清晰的条带。将VvMSA PCR产物回收连接pMD19-T载体,提取重组质粒,经酶切鉴定(图1-B),将鉴定正确的转化子送交测序。由测序可知,VvMSA基因全长序列450 bp,编码149个氨基酸。由DNAStar软件分析结果可知,与GenBank中所公布的白玉霓品种的基因序列一致性为98.67%,其中GenBank中所提交的基因序列第61位的G、179位的C、231位的A、240位的A、336位的C、345位的T在扩增目的片段中分别为T、G、C、C、T、G。2个品种之间氨基酸序列一致性为98.66%,其中第21位和第60位的氨基酸在品种白玉霓中分别是S和G,而在品种Vidal Blanc中均为A。

图1 VvMSA基因CDS序列扩增(A)和重组质粒的酶切鉴定(B)Fig.1 PCR am p lification p roduction of VvMSA CDS and restriction d igestion analysis of recom binan t p lasm ids
2.2 VvM SA的生物信息学分析
2.2.1 VvMSA蛋白的序列分析 ProtParam软件分析结果表明,VvMSA的分子式组成为C773H1083N213O237S1,氨基酸数为149,分子量约为16.703 kDa,等电点为5.68,不稳定系数为41.71(40以下为稳定蛋白),推测为不稳定蛋白。该蛋白中丙氨酸、谷氨酸、组氨酸、赖氨酸、天冬氨酸含量相对较多,而精氨酸、天冬酰胺、异亮氨酸和甲硫氨酸含量相对较少,蛋白中不包含半胱氨酸、谷氨酰胺和色氨酸。Conserved Domains软件分析葡萄VvMSA保守结构域的结果显示,在VvMSA中存在由65个氨基酸组成的ABA/WDS保守结构域(图2-A)。
利用ClustalX对氨基酸序列进行同源性比对发现,葡萄VvMSA与多种植物具有同源性,含有共同保守结构域ABA/WDS,VvMSA和番茄LeASR1以及甜橙CsASR相似性较高为81.2%和82.6%,桃PpASR次之为79.7%。利用MEGA5.0进行进化树分析,结果表明,其在进化上属于单独一个分支,和番茄LeASR1是由同一个祖先进化出的2个分支,此后,又与LeASR2、StDS2、LeASR3、NtASR、FaASR、PpASR、McASR在进化上产生分支(图2-B)。
2.2.2 VvMSA氨基酸序列的磷酸化修饰预测 蛋白质磷酸化是生物体内的一种调节方式,在信号转导过程中起重要作用。目前,研究的主要磷酸化部位有:丝氨酸、苏氨酸和酪氨酸结合位点。利用在线软件NetPhos对VvMSA氨基酸序列分析后发现其存在3个丝氨酸、4个苏氨酸和4个酪氨酸的磷酸化位点(图3)。
2.2.3 VvMSA氨基酸序列疏水性/亲水性预测和分析 疏水/亲水间的平衡是蛋白质结构的重要特征,预测氨基酸序列的疏水性/亲水性对蛋白质的结构、功能的研究具有一定帮助。由ProtScale分析VvMSA氨基酸序列的亲/疏水性,可知VvMSA的N端为亲水结构,中部有2个疏水区域,C端也为亲水结构,且亲水能力较强。整个氨基酸表现出较强的亲水性(图4)。
2.3 VvMSA基因的表达特异性分析
2.3.1 VvMSA的组织表达特性分析 以葡萄品种Vidal Blanc为试材,荧光定量PCR分析VvMSA在不同组织器官中的表达特性。结果显示,在根、茎、幼叶、功能叶、卷须、花芽、梢尖、花、幼果、转色果和成熟果中均检测到VvMSA表达,但是相对表达量存在差异,花中VvMSA相对表达量最高(图5),推测VvMSA参与葡萄的开花进程。
2.3.2 几种逆境因子对VvMSA表达量的影响 经盐、4℃低温和甘露醇处理Vidal Blanc组培苗,实时荧光定量PCR检测VvMSA的相对表达量。由图6可知,甘露醇、盐和低温均可不同程度的诱导VvMSA的表达上调,其中盐诱导VvMSA表达最为明显。在处理后3 h相对表达量达到最大,约为对照的22倍。而低温和甘露醇诱导分别在6,12 h达到最大值。由此推测VvMSA可能参与葡萄抵御多种非生物胁迫逆境,特别是盐胁迫的过程。

图2 葡萄与其他物种中ASR氨基酸序列比对(A)和同源进化树(B)分析Fig.2 Am ino acid sequence alignm ent of ASR hom ologs in grapevine and other species
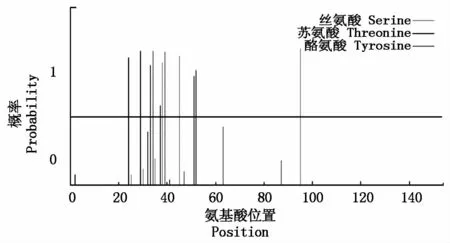
图3 VvM SA氨基酸序列的磷酸化修饰预测Fig.3 Phosphory lation p red iction of translated am ino acid sequence of VvM SA

图4 VvM SA氨基酸序列的疏水性/亲水性预测Fig.4 Analysis of VvM SA hyd rophobic/hyd rophilic nature

图5 VvMSA在葡萄不同组织中表达特性分析Fig.5 Characterization of VvMSA expression pattern in tissues of grape
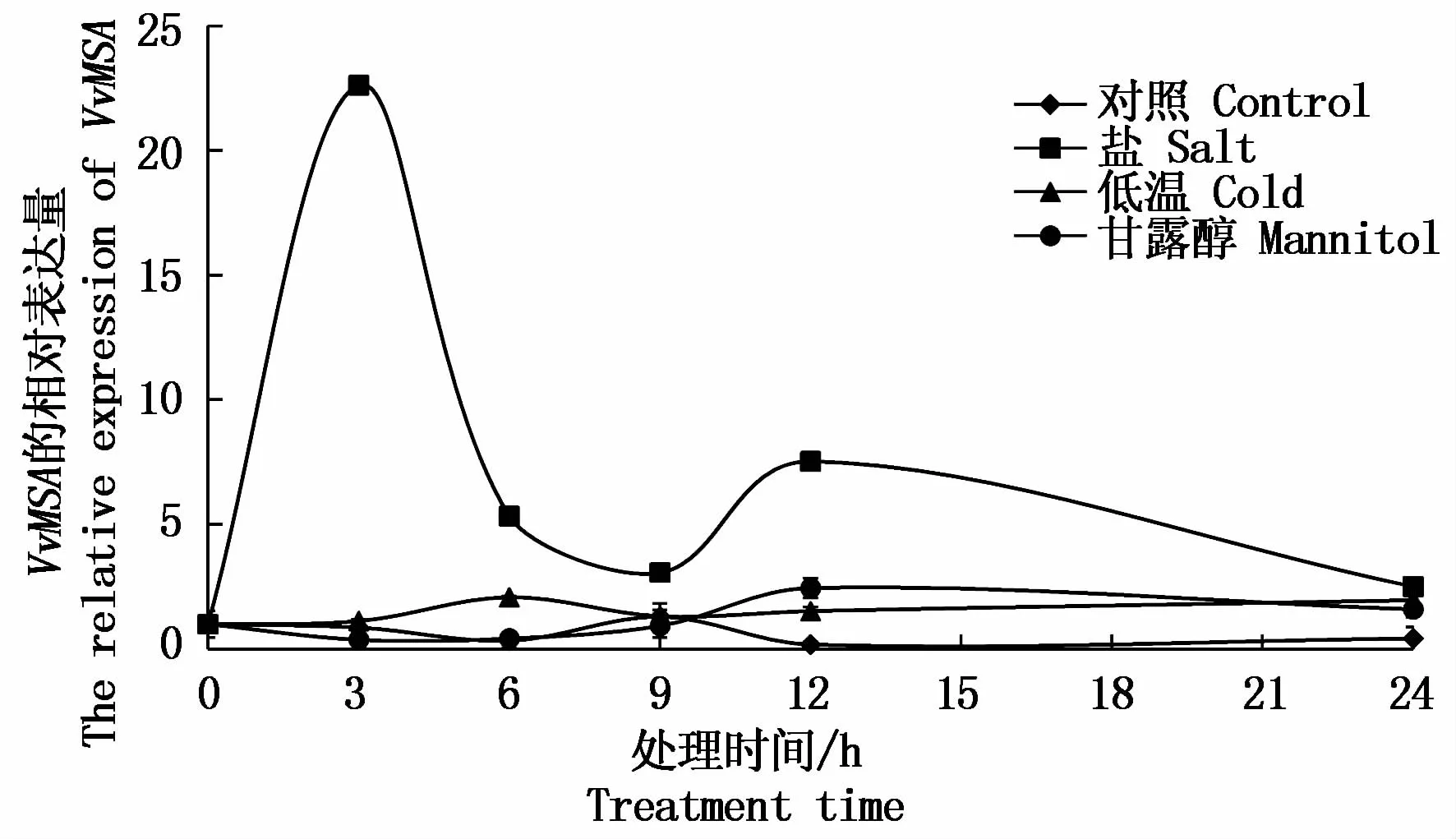
图6 几种逆境因子对葡萄叶片VvMSA相对表达量的影响Fig.6 Quantitative RT-PCR analysis of VvMSA exp ression in grape leaves under different abiotic som e stresses
2.3.3 几种逆境信号分子对VvMSA表达量的影响植物对逆境胁迫的响应是一个复杂的信号转导过程,本试验研究了多种逆境信号分子对VvMSA表达量的影响。从图7可以看出,逆境相关的信号物质H2S供体NaHS、NO供体SNP均可诱导Vidal Blanc叶片中VvMSA相对表达量的增加,并分别在12,3 h的相对表达量达到最大值;但H2O2对VvMSA相对表达量几乎没有影响,而SA对VvMSA的表达有一定的抑制效应。推测H2S和NO均可能参与VvMSA介导的葡萄抵御非生物胁迫的过程。

图7 几种逆境相关信号物质对葡萄叶片VvMSA相对表达量的影响Fig.7 Transcription analysis of VvMSA under the treatm ent of d ifferen t stress related signaling m olecules
2.3.4 几种激素对VvMSA表达量的影响 植物对激素的响应是一个复杂的过程,既可以影响果实成熟进程,也可以影响果实的品质。本试验研究了多种激素对VvMSA表达量的影响。结果发现,ABA可明显诱导Vidal Blanc叶片中VvMSA相对表达量上升,上升了4.4倍,并在3 h相对表达量达到最大;IAA和GA3均可诱导VvMSA的表达,但是上升幅度较小(图8),而ET对VvMSA的诱导在处理12 h后开始上升。推测,VvMSA参与了植物激素诱导葡萄成熟过程。

图8 几种激素对VvMSA相对表达量的影响Fig.8 Transcrip tion analysis of VvMSA under the treatm ent of different horm ones
3 讨论
ASR蛋白是一类能被逆境诱导的低分子量的植物特异蛋白,含有共同序列特征ABA/WDS序列标签。有报道NaCl和干旱处理后,番茄的ASR基因表达量上升,过表达ASR1基因增加了烟草对盐的耐受能力,转基因植株比对照植株更少积累了Na离子,同时还诱导一些逆境相关基因的表达[30]。水稻ASR基因OsASR1受盐、干旱和ABA诱导,将该基因在水稻中过表达,能够增强水稻对冷胁迫的抗性。OsASR1基因转入酵母后,酵母对NaCl、H2O2、水杨酸和高温等的耐受性有所上升。百合LLA23基因,在花粉成熟后期开始积累,其表达受SA和甘露醇的诱导[23]。ASR还参与了植物抵御金属离子胁迫和生物胁迫,如:铝胁迫时水稻ASR5基因表达上升,敲除ASR5后表现出铝敏感[31]。
葡萄中至今只发现了1个ASR蛋白,葡萄ASR基因VvMSA可以与葡萄己糖转运蛋白VvHT1结合,且正调控VvHT1。并且发现酿酒葡萄品种白玉霓VvMSA表达在幼果期、转色期和成熟期呈现出高低高的表达模式,同时VvMSA的表达还可受蔗糖诱导,且这种糖诱导可被ABA强烈增强[16]。已证实,ASR1定位于细胞质和核[32];原位杂交试验显示VvMSA在韧皮部特异性表达[33]。但目前尚不清楚其组织表达特性和诱导表达特性。本试验从抗性葡萄Vidal Blanc组培苗中克隆了VvMSA基因,与数据库中的白玉霓的VvMSA的基因序列一致性为98.67%,其中GenBank中所提交葡萄品种白玉霓的基因序列第61位的G、179位的C、231位的A、240位的A、336位的C、345位的T在扩增目的片段中分别为T、G、C、C、T、G;所编码的氨基酸序列一致性为98.66%,其中GenBank中所提交的氨基酸序列第21位为丝氨酸(Ser),第60位为甘氨酸(Gly),葡萄品种Vidal Blanc中对应位置均为丙氨酸(A la)。利用荧光定量PCR技术分析葡萄VvMSA的表达特性,结果显示,VvMSA在花中的表达量较高,在根、茎、功能叶以及在果实中均有表达。Cakir等[16]在2003年发现幼果中表达量较高,在转色期下降,随后在成熟期又增加,呈现出高低高的变化趋势。本试验进一步证明,该基因能响应于逆境胁迫以及逆境相关的信号分子和果实成熟相关激素,其中NaCl胁迫之后表达量上升,在3 h时约为对照22倍,H2S能够在12 h诱导VvMSA表达量达到最高,且葡萄成熟相关激素ABA也诱导了该基因表达上调,在3 h最高,上调了4.4倍。综合来看,VvMSA参与了葡萄抗逆和成熟过程以及花的发育过程。但是具体调控的分子机制尚不清楚,有待于进一步试验研究。
[1] 李希东,侯丽霞,刘 新,等.H2O2与葡萄VvIPK2基因表达及其低温胁迫响应的关系[J].园艺学报,2011,38(6):1052-1062.
[2] 张广科,肖培连,侯丽霞,等.葡萄VvBAP1基因的克隆及表达特性分析[J].植物生理学报,2014,50(6):829-834.
[3] 常佳迎,寇宏达,乔丹娜,等.葡萄灰霉病菌Flipper转座子扩增体系的建立和优化[J].华北农学报,2013,28(3):227-233.
[4] 徐维华,郑秋玲,刘万好,等.FT/TFL类基因在山葡萄雌雄花中的表达分析[J].华北农学报,2014,29(z1):50-53.
[5] Kawasaki S,Borchert C,Deyholos M,et al.Gene expression profiles during the initial phase of salt stress in rice[J].The Plant Cell,2001,13(4):889-905.
[6] Bovy A,De vos R,Kemper M,et al.High-flavonol tomatoes resulting from the heterologous expression of the maize transcription factor genes LC and C1[J].The Plant Cell,2002,14(10):2509-2526.
[7] Jha B,Agarwal P K,Reddy P S,et al.Identification of salt-induced genes from Salicornia brachiate,an extreme halophyte through expressed sequence tags analysis[J]. Genes and Genet Systems,2009,84(2):111-120.
[8] Carpentier S C,Vertommen A,Swennen R,et al.Sugar-Mediated acclimation:the importance of sucrose metabolism in meristems[J].Journal of Proteome Research,2010,9(10):5038-5046.
[9] Carrari F,Fernie A R,Iusem N D.Heard it through the grapevine ABA and sugar cross-talk:the ASR story[J]. Trends in Plant Science,2004,9(2):57-59.
[10] Maskin L,Frankel N,Gudesblat G A,et al.Dimerization and DNA-binding of ASR1,a small hydrophilic protein abundant in plant tissues suffering from water loss[J]. Biochemical and Biophysical Research Communications,2007,352(4):831-835.
[11] Frankel N,Carrari F,Hasson E,et al.Evolutionary history of the Asr gene family[J].Gene,2006,378:74-83.
[12] Liu Juhua,Jia Caihong,Dong Fengying,et al.Isolation of an abscisic acid senescence and ripening inducible gene from litchi and functional characterization under water stress[J].Planta,2013,237(4):1025-1036.
[13] Yang SH,Kim SH,Berberich T,et al.Identification and properties of a small protein that interactswith a tobacco bZIP-type transcription factor TBZF[J].Plant Biotech-nology,2012,29(4):395-399.
[14] Li R H,Liu G B,Wang H,et al.Effects of Fe3+and Zn2+on the structural and thermodynamic properties of a soybean ASR protein[J].Bioscience Biotechnology and Biochemistry,2013,77(3):475-481.
[15] Sugiharto B,Ermawati N,Mori H,et al.Identification and characterization of a gene encoding drought-inducible protein localizing in the bundle sheath cell of sugarcane[J]. Plant and Cell Physiology,2002,43(3):350-354.
[16] Cakir B,Agasse A,Gaillard C,et al.A grape ASR protein involved in sugar and abscisic acid signaling[J]. The Plant Cell,2003,15(9):2165-2180.
[17] Xu B Y,Su W,Liu J H,et al.Differentially expressed cDNAs at the early stage of banana ripening identified by suppression subtractive hybridization and cDNA microarray[J].Planta,2007,226(2):529-539.
[18] Chen R J,Dong J L,Liu S B,et al.Isolation of a novel abscisic acid stress ripening(OsASR)gene from rice and analysis of the response of this gene to abiotic stresses[J].African Journal of Biotechnology,2012,11(74):13873-13881.
[19] Jha B,Lal S,Tiwari V,et al.The SbASR-1 gene cloned from an extreme halophyte Salicornia brachiata enhances salt tolerance in transgenic tobacco[J].Marine Biotechnology,2012,14(6):782-792.
[20] Virlouvet L,Jacquemot M P,Gerentes D A,et al.The ZmASR1 protein influences Branched-chain amino acid biosynthesis and maintains kernel yield in maize under water-limited conditions[J].Plant Physiology,2011,157(2):917-936.
[21] Moretti M B,Maskin L,Gudesblat G,et al.ASR1,a stress-induced tomato protein,protects yeast from osmotic stress[J].Physiologia Plantarum,2006,127(1):111-118.
[22] Henry IM,Carpentier SC,Pampurova S,et al.Structure and regulation of the Asr gene fam ily in banana[J]. Planta,2011,234(4):785-798.
[23] Yang C Y,Chen Y C,Jauh G Y,et al.A lily ASR protein involves abscisic acid signaling and confers drought and salt resistance in Arabidopsis[J].Plant Physiology,2005,139(2):836-846.
[24] Hong SH,Kim I J,Yang D C,et al.Characterization of an abscisic acid responsive gene homologue from Cucumismelo[J].Journal of Experimental Botany,2002,53(378):2271-2272.
[25] Wang C S,Liau Y,Huang J C,et al.Characterization of a desiccation-related protein in lily pollen during development and stress[J].Plant and Cell Physiology,1998,39(12):1307-1314.
[26] Konrad Z,Bar-zvi D.Synergism between the chaperonelike activity of the stress regulated ASR1 protein and the osmolyte glycine-betaine[J].Planta,2008,227(6):1213-1219.
[27] Maskin L,Maldonado S,Iusem N D.Tomato leaf spatial expression of stress-induced Asr genes[J].Molecular Biology Reports,2008,35(4):501-505.
[28] 侯丽霞,王文杰,刘 新.葡萄VvWRKY71转录因子的生物信息学分析[J].中国农学通报,2013,29(31):123-128.
[29] Livak K J,Schmittgen T D.Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25(4):402-408.
[30] Kalifa Y,Perlson E,Gilad A,et al.Over-expression of the water and salt stress-regulated Asr1 gene confers an increased salt tolerance[J].Plant Cell and Environment,2004,27(12):1459-1468.
[31] Arenhart R A,Margis R,Margis-pinheiro M.The rice ASR5 protein a putative role in the response to Aluminum photosynthesis disturbance[J].Plant Signal&Behavior,2012,7(10):1263-1266.
[32] Ricardi M M,Guaimas F F,Gonzalez R M,et al.Nuclear import and dimerization of tomato ASR1,awater stressinducible protein exclusive to plants[J].PLoS One,2012,7(8):e41008.
[33] Saumonneau A,Laloi M,Lallemand M,et al.Dissection of the transcriptional regulation of grape ASR and response to glucose and abscisic acid[J].Journal of Experimental Botany,2012,63(3):1495-1510.
Gene Cloning and Expression Analysis of VvMSA in Vitis vinifera
ZHANG Suifang,ZHU Dan,MA Qian,HOU Lixia,YIN Pengfei,LIU Xin
(College of Life Science,Qingdao Agricultural University,Key Lab of Plant Biotechnology in Universities of Shandong Province,Qingdao 266109,China)
To investigate the function of VvMSA,the full-length cDNA of VvMSA was cloned from Vitis vinifera cultivar Vidal Blanc tissue culture seedlings.Bioinformatic analysis and quantitative Real-time PCR was used to analyze its characteristics.The results showed that VvMSA amplified fragment size of450 bp encoding 149 amino acids with molecular weight 16.703 kDa,isoelectric point 5.68.VvMSA was an unstable hydrophilic protein and contained a conserved domain ABA/WDS encoding by 65 amino acids.VvMSA and the known homolog LeASR1 in tomato belongs to different sub-fam ilies.Real-time PCR analysis showed that the VvMSA was expressed in all tested tissues with the highest expression in flower.VvMSA was induced by salt,drought and cold stress in different levels,and highest expression level was showed after 3 h salt treatment.In addition,VvMSA was also induced by nitric oxide(NO),hydrogen sulfide(H2S),abscisicacid(ABA)gibberellin(GA3),auxin(IAA)and ethylene(ET),while salicylic acid(SA)inhibited its expression.The expression pattern of VvMSA by salt treatment was sim ilar with the expression pattern by ABA treatment.In total,these results suggested that the VvMSA was involved in salt resistance by ABA signaling.
Vitis vinifera;VvMSA;Gene clone;Expression analysis
Q78;S663.03 文献标识码:A 文章编号:1000-7091(2016)03-0058-07
10.7668/hbnxb.2016.03.009
2016-02-16
国家自然科学基金项目(31401844;31572107;31540090);山东省科技攻关项目(2013GNC11016);山东省高等学校科技计划基金项目(J14LE12);青岛农业大学高层次人才科研基金项目(111339)
张岁芳(1990-),女,山东菏泽人,在读硕士,主要从事葡萄分子生物学研究。
刘 新(1966-),女,山东莱阳人,教授,博士,主要从事植物逆境生理学和分子生物学研究。

