基于bchY的内蒙古2个盐碱湖中不产氧光合细菌多样性的分析
宝力德,冀锦华,刘柯澜,冯福应
(内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018)
基于bchY的内蒙古2个盐碱湖中不产氧光合细菌多样性的分析
宝力德,冀锦华,刘柯澜,冯福应
(内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018)
为进一步了解和认识APB及其在盐碱湖中的生态功能及其作用机制,通过构建和分析不产氧光合细菌bchY基因克隆文库,揭示其中不产氧光合细菌的多样性、群落结构及其与生存环境的关系。样品采自内蒙古浑善达克沙地盐碱度较高的扎格斯台和达格淖2个湖的水样,提取了样品总DNA。以bchY作为检测APB的通用标记,用PCR扩增方法构建了其bchY文库,并对扩增产物进行了测序与系统发育分析。结果表明,达格淖湖和扎各斯台湖均为富营养化盐碱湖,且两湖盐度相差很大。利用bchY文库中核酸序列对应的氨基酸序列进行分析,两文库覆盖度均达93.0%以上,代表性较强,共得到108条bchY编码的氨基酸序列,以cutoff=0.03和0.12分别在种和属水平进行同源性和系统发育分析,在cutoff=0.03分为17个OTUs。两湖的多样性指数(Shannon-Weaver和Simpson)和均匀度指数(Evenness)较接近,其种群多样性程度和均匀程度比较相似,但二者的Chao1都不太高,说明两湖APB的多样性较低,种群不丰富。达格淖湖的Margalef指数较高,说明前者物种数目比后者多。两湖的不产氧光合细菌均属Alphaproteobacteria纲,最优势菌群均为Roseibacterium elongatum。同源性及系统发育性分析表明,达格淖湖和扎各斯台湖中不产氧光合细菌的主要类型为AAPB-like类群、多样性低。
盐碱湖;不产氧光合细菌(APB);bchY基因;cutoff值;OTUs;系统发育分析;多样性;基因克隆文库
不产氧光合细菌(Anoxygenic phototrophic bacteria,APB)多样性高,APB广泛分布于自然界的海洋、湖泊和土壤中[1],对生物地球化学循环的作用举足轻重[2-5],具有降解污染物(如农药等)的功能,可作为类胡萝卜素、维生素和辅酶Q等生物活性物质或其他工业原料如聚羟基丁酯酸(生物塑料原料)等的生产来源[6-9]。多样性的研究可为认识和利用微生物资源提供基础[10]。pufM基因被广泛应用于APB多样性分析[11]。可是,pufM引物只覆盖了含有光反应中心RC2,含光反应中心RC1类型的细菌如Chlorobi和Heliobacteria等并不包括在内,而bchY引物同时覆盖含RC1和RC2的细菌[12]。盐碱湖具有较高的生产力[13],是微生物的宝库[14]。APB多样性分析目前主要集中在海洋,而对盐碱湖的相关研究还很少[15]。
有5个细菌门包含APB,Proteobacteria(紫色细菌)、Chlorobi(绿色硫细菌)、Chloroflexi(绿色非硫细菌)、Acidobacteria(Chloracidobacterium thermophilum)和Firm icutes(日光杆菌)[16]。本研究通过构建bchY文库来研究内蒙古浑善达克沙地达格淖和扎各斯台盐碱湖中APB的多样性,为更全面地了解和认识APB的生态和资源分布提供基础。
1 材料和方法
1.1 试验材料
试验样品采自内蒙古浑善达克沙地盐碱度较高的扎格斯台和达格淖2个湖的水样,采样时间为2010年5月。用自制简便采样器分别于水深0~20 cm处采样后混合,混合后的样品置于已灭菌的塑料瓶中,现场测定水样的pH值。采集的样品置于低温保温箱中迅速运至实验室处理。采集的样品一部分用于测定水体的硝态氮(NO3-N)、铵态氮(NH3-N)、总磷(TP)、盐度和碳酸根(CO)含量以确定湖中的环境和水质状况,另一部分用于APB群落结构分析。先用10μm孔径的滤膜(美国Millipore公司,直径45 mm)预过滤以除去杂质和多数真核生物,再过滤到0.22μm的滤膜上,过滤水样约150μL,将过滤好的滤膜用锡箔纸包好,经液氮速冻后放入-70℃保存备用分析[17]。
1.2 试验方法
1.2.1 环境参数测定 水样的盐度和pH值现场测定,硝态氮(NO3-N)、铵态氮(NH3-N)、总磷(TP)、盐度和碳酸根(CO)含量经预处理后24 h内测定。
1.2.2 样品总DNA提取 水样经预处理后,用冻融和酶解结合的提取方法,参考Ausubel等[18]的方法进行样品总DNA的提取,所得DNA用0.8%琼脂糖凝胶电泳检测。
1.2.3 PCR扩增及bchY文库构建 由于引物bchY可以作为检测APB的通用标记,本试验选用bchY引物bchY_fwd:5′-CCNCARACNATGTGYCCNGCNT TYGG-3′和bchY_rev:5′-GGRTCNRCNGGRAANA TYTCNCC-3′对湖样总DNA进行PCR扩增[17]。反应体系:2.0μL 10×PCR Buffer(含15 mmol/L MgCl2),1.6μL dNTPs(2.5 mmol/L),引物(20 μmol/L)各0.5μL,0.3μL r Taq聚合酶(5 U/μL),样品DNA 2.0μL,无菌水12.9μL。反应条件使用热启动和Touch-down PCR程序:97℃5 m in;80℃热启动后加酶;94℃45 s,40~50℃30 s,72℃1 min,Touch-down 20个循环(-0.5℃/个循环);94℃45 s,48℃30 s,72℃1 m in,10个循环;72℃10 m in。扩增产物用1.0%琼脂糖凝胶电泳检测,使用琼脂糖凝胶DNA回收试剂盒(中科瑞泰有限公司)进行胶回收。
把回收的产物连接到pEASYTM-T1克隆载体,转入Trans1-T1感受态细胞,涂布培养,并用M13引物对克隆进行阳性鉴定。
1.2.4 测序与系统发育分析 从构建好的文库中各随机挑选90个阳性克隆送往上海生物工程有限公司(Sangon)进行测序。测序后的序列用软件Mallard 1.02检测并去除可能的嵌合体(Chimeria),再把剩余序列用软件DNAMAN翻译成氨基酸序列后用DOTUR在种水平置信度进行操作分类单元(Operational taxonom ic units,OTUs)的聚类分析,以进行两湖bchY文库多样性分析。
把两文库的bchY核酸序列对应的氨基酸序列一起进行OTUs分类后,在属的水平各OTU选取1条代表序列通过BlastP程序找出其在GenBank数据库中的最相似氨基酸序列,与相似度最低的氨基酸序列共同作为参比序列。用Jones-Taylor-Thornton距离矩阵模型计算进化距离,以邻接法(Neighbor-Joiningmethod,NJ)用软件MEGA 6.0构建系统发育树,重复验证数为1 000[19]。得到的序列均已提交至GenBank,登录号为KP462748-KP462855。
1.2.5 bchY核酸序列编码氨基酸序列聚类时cutoff值的确定 在NCBI数据库中通过搜索bchY找到bchY氨基酸序列并下载,共191条bchY氨基酸序列,统计其分类信息及其登录号。用Clustal X7.0进行多重比对分析,然后把共有的序列用软件MEGA 6.0[19]分析距离矩阵,计算种内和属内的平均距离,作为bchY氨基酸序列在种和属水平进行聚类的cutoff值。
1.2.6 多样性指数及均匀度指数分析 多样性指数和均匀度指数反映某群落中物种多少及个体分布情况。根据Hill等[20]的方法对得到的OTUs分类结果进行群落多样性相关指标的统计学分析,计算以下参数:覆盖度(Coverage)、多样性指数(Shannon-Weaver和Simpson)、均匀度指数(Evenness和Chao1值)和Margalef多样性指数。
Shannon-Weaver指数(H′)和Simpson指数(D)反映物种多样性,前者是一个综合了物种丰度和各物种相对比例的多样性指数;后者代表某种生物在群落中所占的优势程度,公式分别为:

覆盖率(Coverage)用于评估构建的文库对环境微生物多样性的体现程度,计算公式为:C=1-nl/N,nl为仅包含1个克隆的OTUs数,N同上。
均匀度指数Evenness和Chao1值反映群落中不同物种多度分布的均匀程度,计算公式分别为:E=H′/Hmax;S=S+(a2/2b)。其中Hmax为最大Shannon指数,大小为log2(S),S同上,S代表预测的OTUs总数,a为只含1个克隆子的OTUs个数,b为含2个克隆子的OTUs个数。
Margalef指数能反映物种的丰富度,公式为:dMa=(S-1)/ln N,N、S同上所指[21]。
2 结果与分析
2.1 环境参数
对两湖的环境参数(表1)分析表明,2个湖的pH值均高于9.0,无机盐含量均大于3.5 g/L;且其总氮和总磷含量均超过国际上对富营养化定义的标准(TP>0.11 mg/L,TN>1.2 mg/L),说明达格淖湖和扎各斯台湖均属富营养化盐碱湖。两湖盐度相差很大。
2.2 bchY氨基酸序列种属水平聚类cutoff值的确定
通过对得到的bchY氨基酸序列进行多重序列比对并用MEGA 6.0[19]分析序列的距离矩阵后,统计得到种和属内的平均距离为0.03,0.12(表2),作为bchY氨基酸序列在种和属水平进行聚类的cutoff值。利用bchY文库中核酸序列对应的氨基酸序列进行分析,两文库覆盖度均达93%以上,代表性较强,共得到108条bchY编码的氨基酸序列,以cutoff=0.03和0.12分别在种和属水平进行同源性和系统发育分析,在cutoff=0.03分为17个OTUs.

表1 达格淖和扎各斯台盐碱湖环境参数Tab.1 Environm ent param eters of Dagenao and Zagesitai Lakes

表2 纯培养不产氧光合细菌bchY氨基酸序列的统计结果Tab.2 Databases of all bchY am ino acid sequences of APB from cultures
2.3 文库多样性指数分析
分别对两湖样品进行了bchY基因克隆文库的构建。经去除嵌合体分析后,2个文库分别得到65,43条可用序列,用软件DNAMAN翻译成氨基酸序列后,再以cutoff值为0.03在种水平将其分别划分为12,9个OTUs(表3)。经过分析两湖文库中bchY多样性,发现两湖的多样性指数(Shannon-Weaver和Simpson)和均匀度指数(Evenness)都非常接近,表明两湖中种群多样性程度和均匀程度较为相似,但二者的Chao1都不太高,说明两湖中两湖APB的多样性较低,种群不丰富。达格淖湖的Margalef指数较高,说明前者物种数目比后者多。
图1为两湖bchY基因文库的稀释曲线(Rarefaction curve),可以看出样品的稀释曲线均趋于平缓,并且两湖的覆盖度为93.8%,93.0%,说明得到的文库序列有很好的代表性,能够很好地反映两湖中APB的多样性。
2.4 两文库中bchY编码氨基酸序列同源性及系统发育分析
本研究把2个文库得到的108条bchY序列进行OTUs分类,在cutoff=0.03水平上从每个OTU中选取一条代表序列,通过BlastP程序分析其在GenBank数据库中最同源序列以及编码蛋白(表3)。由于代表序列与其他处于同一OTU中的序列同源性分析结果基本一致,因此,每个OTU只选择一条代表序列翻译成氨基酸序列后进行同源性(在cutoff=0.03)和系统发育分析(在cutoff=0.12)。

表3 两湖样中bchY序列多样性指数分析Tab.3 Diversity index analysis of bchY sequences in two lakes
利用BlastP分析序列的同源性时发现,达格淖湖和扎各斯台湖文库中分别有61,35条bchY序列编码的氨基酸序列与Roseibacterium elongatum DSM 19469编码的脱植酸叶绿素还原酶亚基(Chlorophyllide reductase subunit,BchY)同源,约各占两湖文库序列的94%,81%,可见2个文库中Roseibacterium为最主要的APB类群。扎各斯台文库中有6条(代表序列为b161、b81、b13、b44,约占14%)序列与Loktanella vestfoldensis最接近,而达格淖文库中只有a66与之同源。达格淖湖和扎各斯台湖文库中分别有3条bchY氨基酸序列a8、a119、a125和1条序列b12与Alphaproteobacterium Q-1编码的脱植酸叶绿素还原酶的52.5 kDa的蛋白链同源。扎各斯台湖文库中有1条bchY氨基酸序列b12与Citromicrobium bathyomarinum同源。达格淖和扎各斯台文库各有2条氨基酸序列(a96、a31和b35、b70)分别与红杆菌属的Rhodobacter sp.SW2和Rhodobacter sp.CACIA14H1同源。同源性整体比较发现,两文库中bchY编码的氨基酸与Loktanella vestfoldensis的同源性最高,均在95%以上。与Roseibacterium elongatum DSM 19469编码的脱植酸叶绿素还原酶亚基(Chlorophyllide reductase subunit,BchY)同源性在88%~91%。达格淖文库中a96、a31编码的氨基酸序列与Rhodobacter sp.SW 2的同源性较高,为93%。
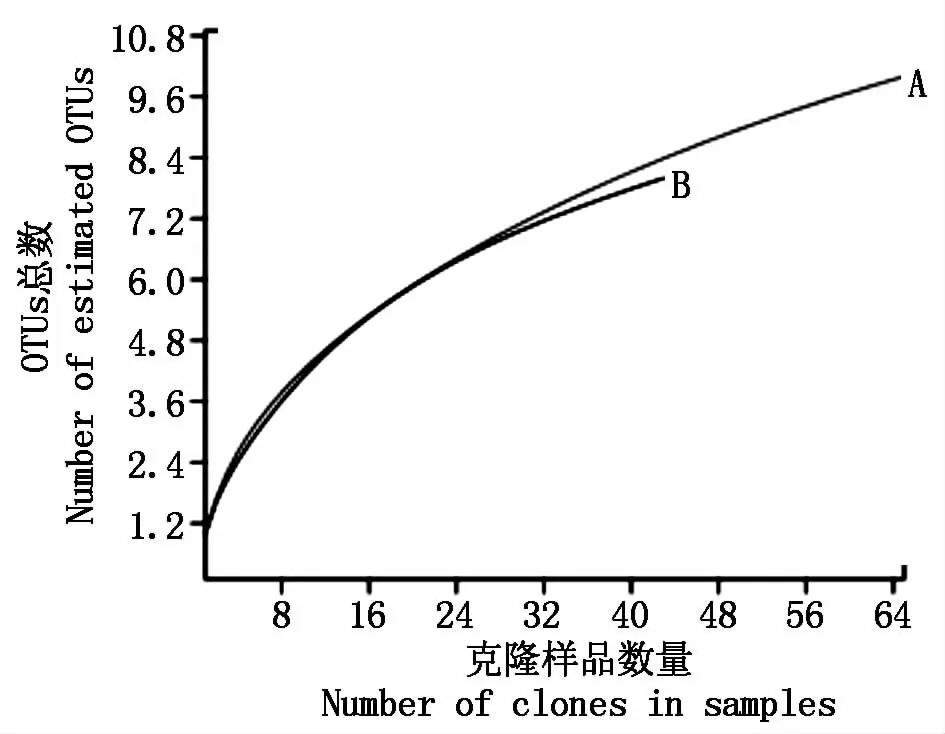
图1 两湖bchY基因克隆文库稀释曲线Fig.1 The rarefaction cu rve of bchY gene clone library of two lakes
对两湖bchY文库中在氨基酸序列cutoff=0.12(属)水平的代表OTU序列构建系统发育树(图2)。对其分析发现,两湖文库中所有bchY核酸序列编码的氨基酸序列均属于Alphaproteobacteria纲。其中,a92、a 64、a 37、a 54、a 169、a 24、a 83、b70属于Unknown Group;达格淖文库中以a85和a125为代表的bchY序列编码的氨基酸序列分别与Roseibacterium elongatum DSM 19469和Alpha proteobacterium Q-1聚在同一进化分支,且序列编码脱植酸叶绿素还原酶,说明这类序列与细菌叶绿素合成有关[22-23]。扎各斯台文库中以b200和b44为代表的氨基酸序列分别与Citrom icrobium bathyomarinum和Loktanella vestfoldensis聚在同一进化分支。b81、a66、b13、b161、b44代表的核酸序列编码的氨基酸序列均属于Loktanella属,根据最新含细菌叶绿素a好氧细菌的分类系统[24]以及Yutin等[12]的研究,Roseibacterium属和Citrom icrobium属均属于含细菌叶绿素a好氧细菌,即好养不产氧光合细菌(AAPB类群),Loktanella vestfoldensis属于厌氧不产氧光合细菌中的紫色硫细菌或紫色非硫细菌[12],结合表4,在两湖文库中,不产氧光合细菌中的AAPB占主导地位,厌氧不产氧光合细菌处于居中优势。
以上结果表明两湖的不产氧光合细菌均属Alphaproteobacteria纲,最优势菌群均为Roseibacterium elongatum。同源性及系统发育性分析表明,达格淖和扎各斯台湖中不产氧光合细菌的主要类型为AAPB-like类群、多样性低。
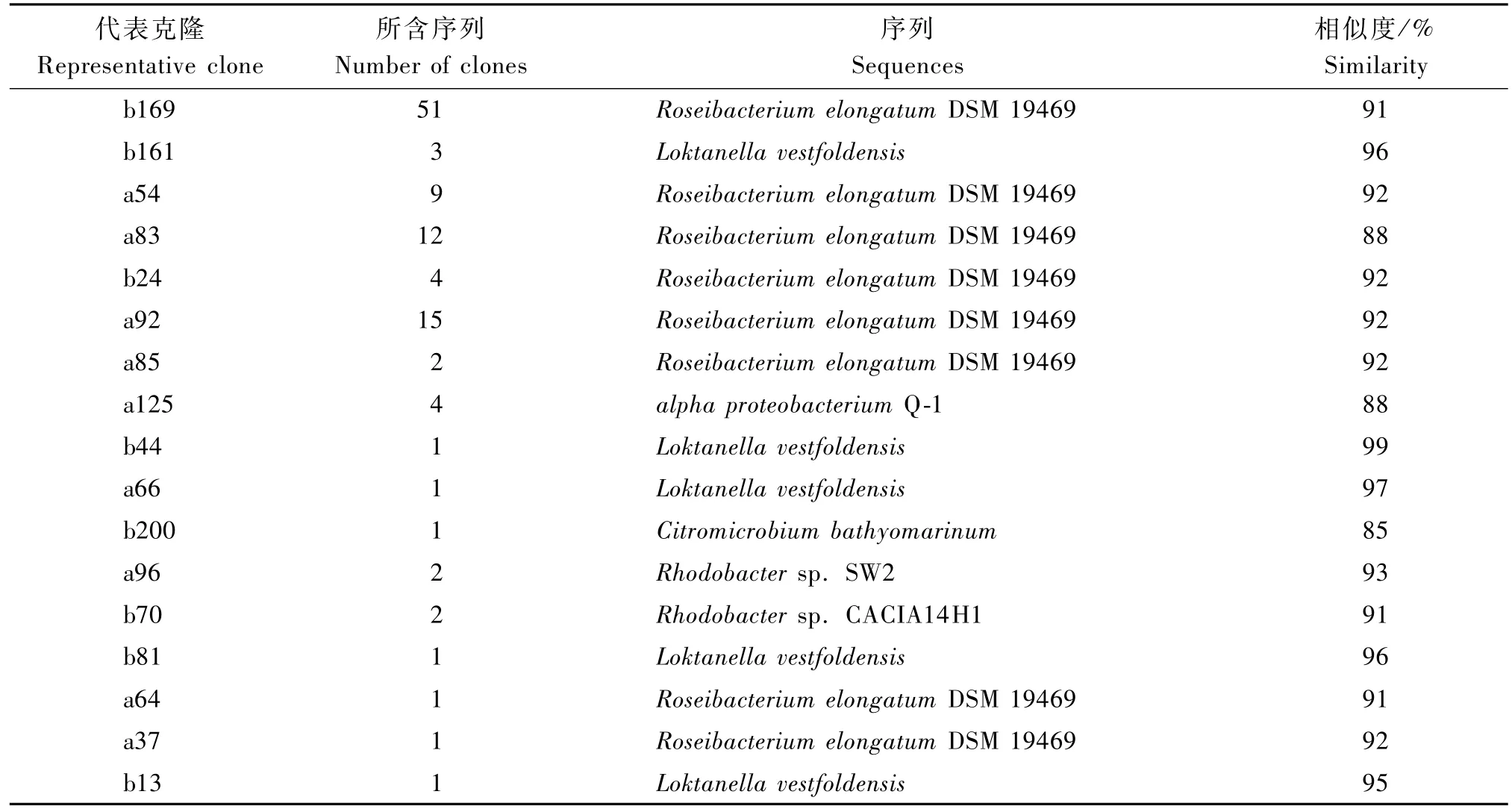
表4 达格淖湖和扎各斯台湖不产氧光合细菌bchY氨基酸序列同源性分析Tab.4 Sim ilarity analysis of Anoxygenic phototrophic bacteria bchY am ino acids sequences of Dagenao Lake and Zagesitai Lake

图2 达格淖湖和扎各斯台湖bchY核酸序列的编码氨基酸序列系统发育树Fig.2 Neighbor-joining phylogenetic tree of am ino acid sequences encoded by bchY nucleotide sequences in Dagenao Lake and Zagesitai Lake
3 讨论
3.1 两湖环境参数
达格淖湖和扎各斯台湖的pH值都高于9.0,无机盐含量均大于3.5 g/L,属于盐碱湖,另外根据国际上对湖泊富营养化定义的标准(TP>0.11 mg/L,TN>1.2 mg/L),因此,可以把2个湖划在富营养化盐碱湖的范畴。这主要与两湖所处地理位置以及湖中微生物的群落结构有关,两湖位于浑善达克沙地,该沙地是内蒙古中部和东部的四大沙地之一[25],降雨量逐年减少,夏季蒸腾作用加强,是致使2个湖泊成为盐碱湖的主要原因。另外两湖中不产氧光合细菌能够通过固氮和固碳作用增加湖水中的氮、碳含量,进而增加湖水中碳源和氮源含量,导致了两湖的富营养化,这与张彦茹[26]得出达格淖湖和扎各斯台湖中主要优势类群为Cyanobacteria和Alphaproteobacteria的结果一致。两湖的其他环境参数基本相近,只有盐度相差较大,这可能与采样的地点选择有关。本研究中对两湖不产氧光合细菌多样性研究对两湖富营养化的治理提供了一定的理论依据。
3.2 两湖文库多样性指数分析
Koblí ek[27]、Yutin[12]和杨彩霞[28]等均做了有关bchY序列的系统发育分析,但并没有给出确切的不产氧光合细菌在种属水平进行聚类的cutoff值。关于bchY文库中核酸序列编码氨基酸序列在种和属水平进行OTUs分类所设定的cutoff值定在0.03(种水平)和0.12(属水平),本研究是通过下载数据库中所有bchY氨基酸序列,并去除不能进行分类的环境克隆和进化距离大于1.0的序列之后,用软件MEGA 6.0计算种和属分类单元内序列间的平均距离后得到的。
通过分析本研究中两湖文库的多样性指数,两文库中序列能代表并反映两湖中APB的多样性,但两湖中不产氧光合细菌多样性不丰富,这与杨彩霞[28]研究接近富营养化的乌梁素海bchY多样性和Salka等[29]对德国湖泊以及Jiang等[15]研究碱性西藏湖泊得到的结论相似,而与Berman等[30]对淡水湖Lake Kinneret的研究结果相反。结合孙鑫鑫等[31]对乌梁素海富营养化湖区浮游细菌多样性研究以及冯胜等[32]对太湖中细菌群落结构对水体富营养化的响应研究,原因可能为两湖中不产氧光合细菌受富营养化等因素的影响而较低。达格淖湖的Margalef指数较高,说明前者物种数目比后者多,可能原因是分析两湖不产氧光合细菌多样性时所用序列为文库中bchY核酸序列编码的氨基酸序列或扎各斯台湖文库中bchY序列经去除嵌合体后可用的较少,以致其代表的物种少于达格淖湖。
3.3 两湖文库bchY编码氨基酸序列系统发育分析与类群组成
本研究利用两湖文库中bchY核酸序列编码的氨基酸序列而没有用bchY核酸序列进行两湖中不产氧光合细菌多样性的分析,主要是因为bchY为功能基因,与核酸序列相比,其编码的氨基酸序列在APB进化过程中变化较小,且其功能随着核酸序列的突变有可能不会改变,利用bchY编码的氨基酸序列进行同源性分析和系统发育分析更为可信。
对两湖文库中bchY编码的氨基酸序列的同源性进行分析,发现两湖中不产氧光合细菌种类相似,只有Citromicrobium bathyomarinum和Alpha proteobacterium Q-1分别分布于扎各斯台湖和达格淖湖。其中达格淖湖和扎各斯台湖文库中分别有61,35条bchY序列(各占总序列的94%,81%)编码的氨基酸序列与Roseibacterium elongatum DSM 19469编码的脱植酸叶绿素还原酶亚基(Chlorophyllide reductase subunit,BchY)同源,与b200(Citrom icrobium属)一起归为AAPB-like亚群,可见两湖中的APB主要类群为AAPB-like类群。其余类群包括Loktanella vestfoldensis(厌氧不产氧光合细菌类群)、Alpha proteobacterium Q-1均为劣势类群,但所有这些类群都属于Alphaproteobacteria纲。这与Salka等[29]和Waidner等[33]的研究结果以及Maˇsín等[34]认为AAPB大量存在于寡营养和恒存性的水体中的结论不太一致,但与Hojerova等[35]认为AAPs在更加富营养化的环境中繁殖更加一致。原因一方面是本研究利用氨基酸序列进行OTUs的分类并进行同源性分析,结果可能会与利用核酸序列进行分析的结果有差异性,另一方面可能是在具体试验如从文库中随机挑选克隆子等方面有偏好性或菌群结构地理分布不同以及湖水水质情况等其他原因,其具体原因还有待进一步分析。
两文库中约有90%bchY序列对应的氨基酸序列与脱植酸叶绿素还原酶亚基和酶链(Chlorophyllide reductase subunit&Chlorophyllide reductase 52.5 kDa chain)同源,说明两湖中约有90%的不产氧光合细菌可以产生细菌叶绿素,能够进行光合作用[21-22]。且有研究发现,许多光合细菌在含有光合基因的同时含有固氮铁蛋白基因nif[36],由于APB的固氮和产氢作用是同时进行的,因此,不产氧光合细菌在利用光合作用进行生长的同时能进行固氮和产氢作用。而且当富营养化产生的浮游生物死亡沉入水底后被腐败菌分解产生有毒物质,严重污染水质,APB能够利用这些有毒的胺类、H2S、有机酸等有机化合物[37-38]作为光合作用的供氢体、碳源和氮源,有较强的分解去除有机物的生理特性,对湖水的污染有预防作用。但与Boeuf等[39]对北极深海中光合细菌的多样性及其对海洋的重要意义的研究相比,本研究中不产氧光合细菌的群落结构及其与盐碱湖达格淖湖和扎各斯台湖环境和水质情况之间的生态关系还需进一步的研究。
[1] Caliz J,Casamayor E O.Environmental controls and composition of anoxygenic photoheterotrophs in ultraoligotrophic high-altitude lakes(Central pyrenees)[J].Environmental Microbiology Reports,2014,6(2):145-151.
[2] Hülsen T,Batstone D J,Keller J.Phototrophic bacteria for nutrient recovery from domestic wastewater[J].Water Research,2014,50(3):18-26.
[3] Rudra M P P,Nalvolthula R,Ramchander M.Biohydrogen production by photosytnhetic bacteria isolated from oil contaminated soil of nacharam,Hyderabad,India[J].International Journal of Chem Tech Research,2014,6(11):4629-4632.
[4] Prashanthi Y,Swetha G,Kudle K P,et al.Influcence of light intensity and metal ions on the photoproduction of hydrogen by the purple non sulphur bacterium[J].International Journal of Research in Environmental Science and Technology,2014,4(2):50-53.
[5] Manisha D R,Rudra M P,Merugu R.Effect of cultural conditions on hydrogen production by phototrophic bacteria isolated from water logged soils in Rourkele,India[J].International Journal of Research in Biotechnology and Biochem istry,2014,4(2):40-44.
[6] Sieracki M E,Gilg I C,Their E C,et al.Distribution of planktonic aerobic anoxygenic photoheterotrophic bacteria in the northwest Atlantic[J].Limnol Oceanogr,2006,51(1):38-46.
[7] Edwardson C F,Planer-Friedrich B,Hollibaugh J T. Transformation of monothioarsenate by haloalkaliphilic,anoxygenic photosynthetic purp le sulfur bacteria[J]. FEMSM icrobiology Ecology,2014,90(3):858-868.
[8] Sireesha R M,Kalyani S,Shivaranjani M,et al.Structural and compositional analysis of PHB depolymerases from the anoxygenic phototrophic bacterium Rhodobacter sphaeroides using computational tools[J].Advanced Engineering and Applied Sciences:An International Journal,2014,4(3):40-43.
[9] Wang X,Wang Y,Cheng X,et al.Formation characteristics of an anoxygenic photosynthetic bacterial biofilm in a photorotating biological contactor for azo dye wastewater treatment[J].Journal of Chemical Technology&Biotechnology,2015,90(1):176-184.
[10] 阎章才,东秀珠.微生物的多样性和应用前景[J].微生物学通报,2001,28:96-102.
[11] Martinez-Garcia M,Swan B K,Poulton N J.Highthroughput single-cell sequencing identifies photoheterotrophs and chemoautotrophs in freshwater bacterioplankton[J].International Society for M icrobial Ecology,2012,6:113-123.
[12] Yutin N,Suzuki M T,Rosenberg M,et al.BchY-based degenerate primers target all types of anoxygenic photosynthetic bacteria in a single PCR[J].Applied and Environmental Microbiology,2009,75(23):7556-7559.
[13] Jones B E,Grant W D,Duckworth A W,et al.M icrobial diversity of soda lakes[J].Extremophiles 1998,2:191-200.
[14] Lizama C,Monteoliva-Saánchez M,Prado B,et al.Taxonomic study of extreme halophilic archaea isolated from the″Salar de Atacama″,Chile[J].Syst Appl M icrobiol,2001,24:464-474.
[15] Jiang H,Dong H,Yu B,et al.Abundance and diversity of aerobic anoxygenic phototrophic bacteria in saline lakes on the Tibetan plateau[J].FEMSMicrobiology E-cology,2009,67(2):268-278.
[16] Xiong J,Bauer C E.Comp lex evolution of photosynthesis[J].Annu Rev Plant Biol,2002,53(4):503-521.
[17] 赵吉睿,巩瑞红,李畅游,等.三种碳源对乌梁素海好氧不产氧光合细菌群落结构的影响[J].湖泊科学,2014,26(1):113-120.
[18] Ausubel F M,Brent R,Kingston R E,et al.Short protocols in molecular biology:a compendium ofmethods from Current protocols in molecular biology[M].New York:W iley Press,2002.
[19] Tamura K,Stecher G,Peterson D,et al.MEGA6:molecular evolutionary genetics analysis version 6.0[J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[20] Hill T C,Walsh K A,Harris JA,et al.Using ecological diversity measures with bacterial communities[J].FEMS M icrobiology Ecology,2003,43(1):1-11.
[21] 何一平,曾永辉,袁 博,等.基于pufM基因的乌梁素海富营养化湖区好氧不产氧光合细菌系统发育多样性分析[J].微生物学通报,2010,37(8):1138-1145.
[22] Noisangiam R,Nuntagij A,Pongsilp N,et al.Heavy metal tolerant Metalliresistens boonkerdii gen.nov.,sp. nov.,a new genus in the family Bradyrhizobiaceae isolated from soil in Thailand[J].Systematic and Applied M icrobiology,2010,33(7):374-382.
[23] Burke D H,Hearst JE,Sidow A.Early evolution of photosynthesis:clues from nitrogenase and chlorophyll iron proteins[J].Proceedings of The National Academy of Sciences of The United States of America,1993,90(15):7134-7138.
[24] 杨素萍,林志华,崔小华,等.不产氧光合细菌的分类学进展[J].微生物学报,2008,48(11):1562-1566.
[25] 杜 颖,赵宇龙,赵吉睿,等.浑善达克沙地夏冬季浅色型生物土壤结皮中古菌的系统发育多样性分析[J].微生物学通报,2014,41(10):1976-1984.
[26] 张彦茹.内蒙古浑善达克盐碱湖细菌多样性分析[D].呼和浩特:内蒙古农业大学,2011.
[27] Koblí ek M,MoulisováV,MuroňováM,et al.Horizontal transfers of two types of puf operons among phototrophic members of the Roseobacter clade[J].Folia Microbiologica,2015,60(1):37-43.
[28] 杨彩霞.乌梁素海底泥厌氧不产氧光合细菌的富集培养后细菌多样性&一株盐碱湖细菌的分离、培养及分类鉴定[D].呼和浩特:内蒙古农业大学,2011.
[29] Salka I,Cuperova Z,Masin M,et al.Rhodoferax-related pufM gene cluster dominates the aerobic anoxygenic phototrophic communities in German freshwater lakes[J]. Environmental Microbiology,2011,13(11):2865-2875.
[30] Berman T,Yacobi Y Z,Eckert W,et al.Heterotrophic and anoxygenic photosynthetic bacteria[J].Springer Netherlands,2014,6:259-271.
[31] 孙鑫鑫,刘惠荣,冯福应,等.乌梁素海富营养化湖区浮游细菌多样性及系统发育分析[J].生物多样性,2009,17(5):490-498.
[32] 冯 胜,秦伯强,高 光.细菌群落结构对水体富营养化的响应[J].环境科学学报,2007,27(11):1823-1829.
[33] Waidner L A,Kirchman D L.Diversity and distribution of ecotypes of the aerobic anoxygenic phototrophy gene pufM in the Delaware estuary[J].Applied and Environmental Microbiology,2008,74:4012-4021.
[34] Maˇsín M,ˇCuperováZ,HojerováE,et al.Distribution of aerobic anoxygenic phototrophic bacteria in glacial lakes of northern Europe[J].Aquatic M icrobial Ecology,2012,66(1):77-86.
[35] Hojerova E,Masin M,Brunet C,et al.Distribution and growth of aerobic anoxygenic phototrophs in the Mediterranean Sea[J].Environmental Microbiology,2011,13(10):2717-2725.
[36] Cantera J J,Kawasaki H,Seki T.The nitrogen-fixing gene(nifH)of Rhodopseudomonas palustris:a case of lateral gene transfer[J].Microbiology,2004,150:2237-2246.
[37] Ramchander Merugu Y P,Sarojini T,Baghu N.Bioremediation of waste waters by the anoxygenic photosynthetic bacterium[J].International Journal of Research in Environmental Science and Technology,2014,4(1):16-19.
[38] 刘慧玲,张红莲,李细钊.光合细菌Ⅰ的分离及其对水体中亚硝酸盐降解的研究[J].水产科学,2005,24(6):32-33.
[39] Boeuf D,Humily F,Jeanthon C.Diversity of Arctic pelagic Bacteria with an emphasis on photoheterotrophs:a review[J].Biogeosciences,2014,11(12):3309-3322.
Diversity of Anoxygenic Photosynthetic Bacterial and Environm ent Adaptation Relationship in Dagenao and Zagesitai Haloalkaline Lakes in Desert Hunshandake
BAO Lide,JI Jinhua,LIU Kelan,FENG Fuying
(College of Life Sciences,Inner Mongolia Agricultural University,Huhhot 010018,China)
Reports about research on the diversity of Anoxygenic phototrophic bacteria(APB)in haloalkaline lakes are too rarely.This experiment constructed and analyzed Anoxygenic phototrophic bacteria bchY gene library of Dagenao Lake and Zagesitai Lake to reveal the diversity and community structure of APB in two lakes and their relation with living environment for the sake of understanding APB and their ecology function and its mechanism.The water samples were collected from the Dagenao Lake and Zagesitai Lake which have higher salinity in Hunshandake desert in Inner Mongolia,and their total DNA were extracted.Their bchY libraries were constructed by PCR amp lification method using bchY as standard marker for the detection of APB,the amplification products were sequenced and the phylogenetic analysis has been carried out.The results showed that Dagenao Lake and Zagesitai Lake were Eutrophical haloalkaline lakes and the salinity of two lakes was obviously different.Analysis of the amino acid sequences encoded by bchY nucleotide sequences in two libraries discovered that the coverages of two lakes were over 93%and strongly representative.108 amino acid sequences encoded by bchY were obtained from the two libraries totally and these sequences were divided into 17 operational taxonom ic units(OTUs)with the cutoff value of 0.03and analyzed the similarity and phylotype composition under the genus(0.12)and species(0.03)lever.The diversity index and evenness index of two lakeswere too approaching,therefore the diversity and evenness of species in two lakes were very similar,while their Chao1 values were law,indicated that the diversities of APB in two lakes were relatively low and the species were not too abundant.The Margalef index of Dagenao Lake was more higher,which indicated that the number of species in Dagenao Lake wasmore than Zagesitai Lake.In both libraries all of APB belonged to A lphaproteo bacteria class,and the predom inant OTUs was Roseibacterium elongatum,diversity of APB in two lakes were similar and lower.Analysis of the similarity and phylotype composition revealed that themain type of APB was AAPB-like group,and the diversity of APB was lower.This study provided theoretical foundation and basis for understanding APB and their ecological role and function.
Haloalkaline lake;Anoxygenic phototrophic bacteria(APB);bchY gene;Cutoff value;OTUs;Analysis of phylotype composition;Diversity;Gene library
Q938.1 文献标识码:A 文章编号:1000-7091(2016)03-0147-08
10.7668/hbnxb.2016.03.022
2016-01-10
国家自然科学基金项目(30760004)
宝力德(1961-),男,内蒙古西乌珠穆沁人,副教授,博士,主要从事生物化学与分子生物学研究。
冯福应(1973-),男,内蒙古包头人,教授,博士,主要从事微生物资源与应用研究。

