淀粉微球及磁性淀粉微球的制备研究*
杨小玲,赵 琴
(咸阳师范学院 化学与化工学院,陕西 咸阳 712000)
淀粉微球及磁性淀粉微球的制备研究*
杨小玲,赵琴
(咸阳师范学院 化学与化工学院,陕西 咸阳 712000)
以普通玉米淀粉为原料,先采用预处理玉米淀粉降低淀粉黏度和结晶度,然后利用反相悬浮聚合法,以预处理玉米淀粉和β-环糊精为原料,在引发剂、交联剂、乳化剂的作用下交联成球,并分别采用包裹法及静态吸附法制备磁性淀粉微球。实验结果表明,当酶解玉米淀粉为1.0g,β-环糊精为0.5g,W/O体积比为1∶3.5,反应温度为50℃,反应时间为5h,环氧氯丙烷为5mL,且MBAA用量为0.3g,乳化剂用量为1.74g,引发剂用量为0.4g时,得到的淀粉微球表面光滑,粒径均匀,分散性较好。热分析结果表明,静态吸附法得到的磁性微球的磁含量较包裹法的高,为246.92mg/g。
反相悬浮聚合法;静态吸附法;磁性淀粉微球
前言
淀粉是一种天然高分子物质,其分子中含有大量羟基。淀粉微球是淀粉经改性处理得到的一种人造衍生物,其反应原理是在引发剂作用下,羟基与交联剂进行适度交联后制得的一种微球。
天然淀粉颗粒结构中包含结晶区和不定型区,外层是结构紧密的结晶区,交联剂很难进入内层结构松散的无定形区,因此反应只能在表面进行。对淀粉进行预处理,能够破坏颗粒结晶结构,提高淀粉反应活性[1~4],如酶解、醇解等[5,6]。磁性高分子微球是将有机高分子与磁性粒子通过一定方式相结合的具有一定磁性功能高分子微球,在生物医药、固定化酶、靶向给药等领域具有广阔的应用前景[7]。目前,磁性微球的制备方法主要有:物理法(静态吸附法、高能球磨磁化法等),化学法(包埋磁化法、悬浮聚合磁化法、共沉淀磁化法等)[7,8]。
本文以普通玉米淀粉为原料,选取酶解和醇解两种方式分别对淀粉预处理,然后采用反相悬浮聚合法制备淀粉微球,并采用两种方法(静态吸附法和反向悬浮聚合一步法[9,10])制备磁性微球,对其结构进行表征。
1 实验部分
1.1原料及试剂
玉米淀粉,食用级,市售;β-环糊精,分析纯,上海山浦化工有限公司;氢氧化钠,天津市大陆化学试剂厂;N,N′-亚甲基双丙烯酰胺(MDAA)分析纯,天津市科密欧化学试剂开发中心;司盘80(Span-60),工业纯,莱阳市化工实验厂;吐温60(Tween-60),工业纯,上海山浦化工有限公司;糖化酶,天津市博迪化工有限公司;α-淀粉酶,天津市红岩试剂厂。
1.2仪器
IRPrestige-21型傅里叶变换红外光谱仪,日本岛津公司;Q50型热失重分析仪和Q100型差示扫描量热仪,美国TA公司;LS230粒度分析仪。
1.3淀粉预处理
醇解:将95%乙醇和水按照体积比为1∶1溶解淀粉,制成浓度为25%的淀粉乳,在80~85℃,回流搅拌0.5h,静置,倾去上清液,沉淀用乙醇和水分别清洗两次,干燥、粉碎,并过100目分样筛。
酶解:以刚配制好的pH值为6的乙酸-乙酸钠缓冲液为溶剂(预热至50℃),以玉米淀粉或醇解淀粉为溶质,分别配制25%的淀粉乳;待淀粉乳液室温冷却后,加入1∶5的α-淀粉酶与糖化酶,反应35min;抽滤/离心,分别用95%乙醇溶液和水溶液洗涤2~3次,干燥、粉碎,并过100目分样筛。
1.4淀粉微球的制备
称取1.0g处理过的淀粉和0.5gβ-环糊精,用10mLpH值为8~9的NaOH溶液溶解得淀粉乳。依次加入一定量过硫酸铵和N,N′-亚甲基双丙基酰胺,作为水相待用;量取35mL液体石蜡到三颈瓶中,加入适量的Span60和Tween60(Span60和Tween60的质量比为5∶1),搅拌均匀即得油相;将水相倒入油相中,继续加热搅拌0.5h后,依次滴加一定量亚硫酸氢钠和5mL环氧氯丙烷,再加入定量偶氮二异丁腈和少量无水硫酸钠,反应5h后,得到白色乳液,静置,离心分离,倒去上层油相,依次用乙酸乙酯、无水乙醇和蒸馏水洗涤产物,真空干燥。
1.5磁性淀粉微球的制备
(1)静态吸附法
将氯化铁和氯化亚铁按物质的量比2∶1配制成0.5mol/L的溶液,加入适量的淀粉微球(按质量比为10%),然后滴加氨水至pH值为9以上,在30℃左右,回流搅拌2h,静置,用乙醇沉淀,离心,倒去上层液体,用蒸馏水洗涤三次,真空干燥。
(2)一步法
Fe3O4的制备:将氯化铁和氯化亚铁按物质的量比2∶1配制成0.5mol/L的溶液,然后滴加氨水至pH值为9以上,在30℃左右,回流搅拌2h,静置,用乙醇沉淀,离心,倒去上层液体,用蒸馏水洗涤三次,真空干燥,得磁性微球。
Fe3O4的包裹:用少量聚乙二醇400溶解上述Fe3O4,搅拌均匀后倒入250mL三颈瓶中,在50℃下进行超声震荡30min。加到淀粉乳中成水相,以下步骤与微球制备相同,得磁性微球。
1.6测试或表征
(1)结构表征:将样品制成KBr压片,进行红外扫描,记录500~4000cm-1范围的红外光谱图。
(2)热性能:采用热失重分析TGA法和差示扫描量热DSC法进行表征(N2气氛,升温速率20K/min)。
(3)微球粒径测试:用LS230粒度分析仪测定微球水合状态下的粒径分布。
2 结果与讨论
2.1预处理方式的选择
本文选择两种方式(酶解、醇解)处理玉米淀粉,据文献报道,两种方式均可以减小淀粉结晶度,酶解还可以扩大淀粉孔隙率,提高淀粉比表面积及反应效率。实验发现,醇解后淀粉黏度大,产物易结块;酶解处理后的淀粉分散性好,制得的微球球形规则,粒径均匀,产率较高。因此,以下实验将采用酶解淀粉进行微球制备研究。
2.2红外光谱分析
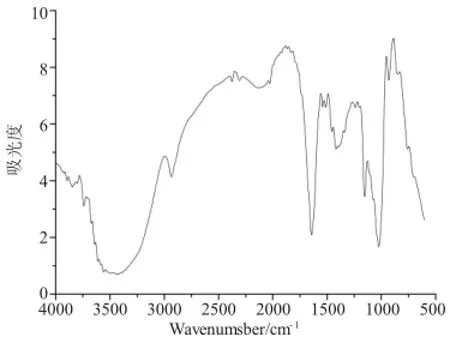
图1 淀粉微球的红外图谱Fig.1 The IR spectrum of starch microsphere
图1表明,淀粉微球在3400cm-1附近出现强而宽的吸收峰归属于-OH伸缩振动吸收峰,微球在2930cm-1处吸收峰归属于淀粉葡萄糖单元中C-H伸缩振动,微球生成并未使吸收峰发生明显改变;1078cm-1和1153cm-1处吸收峰归属为C-O不对称伸缩振动和对称伸缩振动,及C-C和O-H的弯曲振动叠加;在1644cm-1处的吸收峰为酰胺Ⅰ带和淀粉中水的H-O-H弯曲吸收峰叠加;1540cm-1处出现酰胺Ⅱ带吸收峰,上述分析表明,淀粉与MBAA发生交联得到的淀粉微球结构中有羟基、酰胺基等基团存在。
2.3粒径分布
据文献报道,原玉米淀粉的平均粒径为7.22μ m。从图2可见,测试结果与文献报道基本一致。由图3可见,微球粒径分布基本均匀,淀粉微球粒径分布在1~3μm,粒度分布范围较窄;平均粒径1.26μ m,粒径减小,主要是因为预处理时淀粉降解导致的。
2.4磁性淀粉微球的热分析
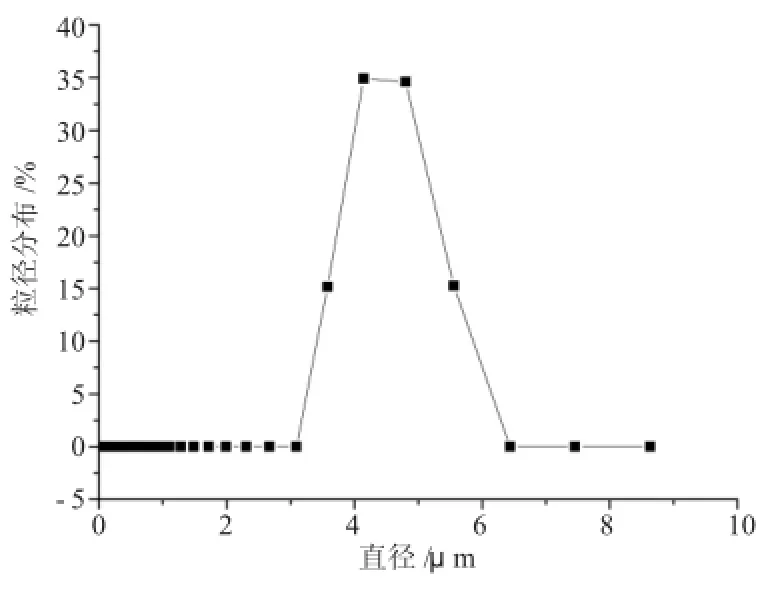
图2 玉米淀粉表面积粒径Fig.2 The surface area particle size of corn starch

图3 淀粉微球的粒径分布Fig.3 The particle size distribution of starch microsphere
从DSC曲线来分析包裹法和静态吸附法制备的磁性淀粉微球的磁载率发现二者在100℃附近均有一个大的吸收峰,为淀粉中水分蒸发产生的吸热峰,200~280℃间的吸热峰主要归因于淀粉的玻璃化转变温度及开始降解之后淀粉发生分解和碳化炭化;与TG失重曲线相一致,从室温到100℃缓慢失重阶段,淀粉失水,200~300℃失重阶段为淀粉长链大分子断裂为小分子的降解过程,300~600℃阶段的曲线斜率较大,为淀粉分解碳化的过程,之后趋于平衡,为剩余的磁体。二者不同的是,静态吸附法中,淀粉微球在交联聚合时产生空间网状结构存在大量孔隙,淀粉和磁流体间通过静电作用、氢键作用结合,磁含量较高,为246.92mg/g;包裹法中,淀粉和磁流体间在交联时产生键合作用,及其之间存在的静电作用、氢键作用及空间位阻,影响了淀粉交联度,因此微球的空间孔隙率小,磁含量较低,为205.86mg/g。

图4 包裹法制备的磁性淀粉微球的TG曲线Fig.4 The Tg curve of magnetic starch microsphere made by coating method
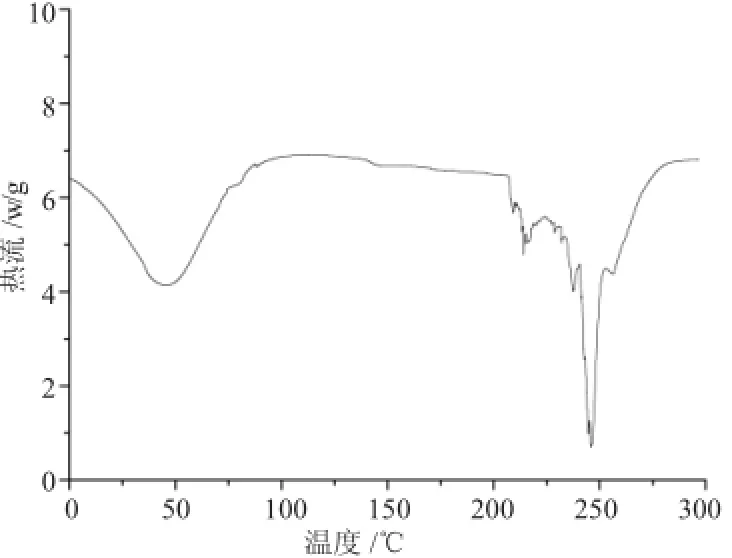
图5 包裹法制备的磁性淀粉微球的DSC曲线Fig.5 The DSC curve of magnetic starch microsphere made by coating method

图6 静态吸附法制备的磁性淀粉微球的TG曲线Fig.6 The TG curve of magnetic starch microsphere made by static adsorption method

图7静态吸附法制备的磁性淀粉微球的DSC曲线Fig.7 The DSC curve of magnetic starch microsphere made by static adsorption method
3结论
采用酶解预处理玉米淀粉,降低了淀粉结晶度,提高了淀粉利用率。然后利用反相悬浮聚合法制备淀粉微球,最佳合成条件如下:当酶解玉米淀粉为1.0g,β-环糊精为0.5g,W/O体积比为1∶3.5,反应温度为50℃,反应时间为5h,环氧氯丙烷为5mL,且MBAA用量为0.3g,乳化剂用量为1.74g,引发剂用量为0.4g,得到的淀粉微球表面光滑,粒径均匀,分散性较好。通过热重分析测定磁性淀粉微球中磁含量,静态吸附法得到的磁性微球磁含量较包裹法的高,为246.92mg/g。
[1]赵永青,张本山,陈福泉.酶解-热醇协同处理制备淀粉基吸附材料华南理工大学学报:自然科学版,2010,38(12):100~104.
[2]王斌,张本山,刘培玲.乙醇溶剂保护法制备非晶颗粒态玉米淀粉[J].食品与发酵工业,2007,33(3):75~77.
[3]王艳.中长链脂肪酸淀粉酯的酶法合成及其性质研究[D].哈尔滨:哈尔滨商业大学,2013:7~8.
[4]陆杨.低粘度辛烯基唬拍酸淀粉醋的性质研究[D].成都:四川农业大学,2007.
[5]王斌.非晶颗粒态淀粉的制备及性质研究[D].广州:华南理工大学,2007.
[6]张超.玉米多孔淀粉的酶法制备及其作为吸附剂的应用研究[D].无锡:江南大学,2012.
[7]王艳丽.磁性淀粉的制备、性质及应用研究[D].郑州:河南工业大学,2009.
[8]谢新玲,罗冯笑,童张法,等.反相乳液法制备磁性木薯淀粉微球的研究[J].食品工业,2014,35(1):152~155.
[9]陈凯敏.功能性纳米粒子的制备及其与蛋白质的相互作用研究[D].上海:华东理工大学,2011:12~20.
[10]罗冯笑.木薯淀粉微球的制备及其结构与性能研究[D].南宁:广西大学,2013.
Study on the Synthesis of Starch Microspheres and Magnetic Starch Microspheres
YANG Xiao-ling and ZHAO Qin
(College of Chemistry and Chemical Industry,Xianyang Normal University,Xianyang 712000,China)
Firstly,the corn starch was pretreated to reduce the viscosity and crystallinity;and then the starch microspheres were prepared by inverse suspension polymerization method with initiator,cross-linking agent,emulsifier and composite starch(pretreated starch and β-cyclodextrin)as the raw material;at last,the magnetic starch microspheres were obtained by two methods,which were coating method and static adsorption method. The results showed that when the enzymolysis corn starch was 1.0g,β-cyclodextrin was 0.5g,volume ratio of W/O was 1∶3.5,reaction temperature and time was 50℃respectively,epichlorohydrin was 5mL,MBAA was 0.3g,emulsifier was 1.74g and initiator was 0.4g,the obtained starch microsphere would have a smooth surface,uniform particle size and good dispersion.The thermal analysis result showed that the magnetic content of the microspheres made by static adsorption method was higher than the one made by coating method which was 246.92mg/g.
Inverse suspension polymerization;static adsorption method;magnetic starch microspheres
TS236
A
1001-0017(2016)02-0091-04
2015-12-22*基金项目:陕西省教育厅项目(编号:15JK1782)和咸阳师范学院专项科研基金项目(编号:13XSYK019)
杨小玲(1976-),女,陕西西安人,高级工程师,硕士研究生,研究方向为天然高分子改性。

