毕赤酵母X33/pGAPZαA-MLcc1产漆酶的高密度发酵
黄亮,刘逸寒,刘晓光,李玉,路福平*(.工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,国家工业酶工程实验室,天津科技大学生物工程学院,天津300457;2.天津农学院农学与资源环境学院,天津300384)
毕赤酵母X33/pGAPZαA-MLcc1产漆酶的高密度发酵
黄亮1,2,刘逸寒1,刘晓光1,李玉1,路福平*1
(1.工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,国家工业酶工程实验室,天津科技大学生物工程学院,天津300457;2.天津农学院农学与资源环境学院,天津300384)
在5 L的发酵罐中进行了重组毕赤酵母X33/pGAPZα A-MLcc1表达重组漆酶的发酵试验,漆酶活性的变化趋势与菌体干质量变化趋势相一致,当菌体增长进入稳定期46 h左右时,产酶达至高峰47.2 U/L。进一步研究了工程菌在5 L容积发酵罐中的高密度发酵工艺,并获得了高水平表达漆酶的优化策略:在补料阶段采用溶氧反馈控制方式,并且保持溶氧水平在15~30 g/dL,发酵过程中通过在线补加氨水和盐酸来调整pH恒定在5。通过高密度发酵可获得最高酶活力达216.3 U/L,是分批发酵获得最高酶活力的4.6倍。
毕赤酵母;漆酶;高密度发酵
漆酶具有特异的催化性能和宽泛的底物范围,从而在国民经济的多个领域如纺织业废水处理、纸张和纸浆的低污染生产、芳香族化合物转化,生物传感器、生物燃料电池的制造,以及饮料加工、食药用菌生产、食品保护等均有广阔的应用前景,但漆酶的低产量、高温易失活等又使其应用不能深入推广[1]。
白腐菌是真菌中漆酶主要的生产者,但培养过程周期较长,容易被污染而不利于工业化生产,解决酶源问题的一个重要方法就是通过漆酶的异源表达实现漆酶生产低成本的目标[2-4]。作者在前期的研究工作中,设计定点突变位点获得了突变基因MLcc1,构建了重组表达载体pGAPZα A-MLcc1,并在毕赤酵母中成功实现了表达。在前期摇瓶培养研究中,考察了培养基组成、温度及pH值对重组漆酶表达量的影响。然而即使分批发酵处于较优的培养基组成及理化条件,最终获得的细胞量和重组漆酶的产量依然较低。在此基础上,本文作者设计了不同的调控策略,通过高密度发酵以期获得重组酵母发酵产酶的最佳条件。
1 材料与方法
1.1材料
1.1.1菌株毕赤酵母工程菌TJL22(X33/pGAPZα
A-MLcc1),由作者所在实验室构建。
1.1.2培养基
1)YEPD培养基:蛋白胨20 g/L,葡萄糖20 g/ L,酵母提取物10 g/L;固体培养基加20 g琼脂粉,用蒸馏水配制。
2)YPG培养基:酵母膏1 g/L、蛋白胨2 g/L、甘油3 g/L,用蒸馏水配制。
3)BMGY培养基:YNB 13.4 g/L,蛋白胨20 g/ L,酵母提取物10 g/L;甘油10 mL/L,100 mmol/L磷酸钾缓冲液(pH 6),生物素4×10-4,用蒸馏水配制。
4)BSM培养基:体积分数85%H3PO426.7 mL/ L,CaSO40.93 g/L,K2SO418.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油40.0 g/L。
5)补料用培养基:葡萄糖30 g/dL,PTM43 mL/ L,硫酸铜0.1 g/dL。
1.1.3试剂及溶液
1)pH 6.0的磷酸钾缓冲液:1 mol/L K2HPO4132 mL,1 mol/L KH2PO4868 mL,pH 6.0,湿热灭菌,4℃保存。
2)PTM1微量元素液:CuSO4·5H2O 6.0 g/dL,NaI 0.08 g/dL,MnSO4·H2O 3.0 g/dL,NaMoO4·2H2O 0.2 g/dL,H3BO30.02 g/dL,CoCl20.5 g/dL,ZnCl220.0 g/dL,FeSO4·7H2O 65.0 g/dL,生物素0.2 g/dL,H2SO45.0 mL/L,用0.22 μm的滤膜过滤除菌,室温保存。
3)PTM4微量元素液:CuSO4·5H2O 2.0 g/dL,NaI 0.08 g/dL,MnSO4·H2O 3.0 g/dL,NaMoO4·2H2O 0.2 g/dL,H3BO30.02 g/dL,CaSO4·2H2O 0.5 g/dL,CoCl20.5 g/dL,ZnCl27.0 g/dL,FeSO4·7H2O 22.0 g/ dL,生物素0.2 g/dL,H2SO41.0 mL/L,用0.22 um的滤膜过滤除菌,室温保存。
1.1.4发酵设备5 L的离位灭菌发酵罐(型号BIOTECH-5BG),上海保兴生物设备工程有限公司制品。发酵液溶氧在线检测,温度和pH可自动控制。
1.2方法
1.2.1培养方法
1)种子培养:从新鲜YEPD平板上挑取单菌落接种到50 mL YPG培养基中,30℃200 r/min振荡培养过夜,250 mL的摇瓶装液量50 mL。
2)发酵罐培养:装料前校准发酵罐的pH电极及溶氧电极。加入3 L含0.4 mmol/L铜离子的BMGY培养基,于121℃高压灭菌30 min,校正溶氧(DO)至0 g/dL。待发酵罐内培养液冷却到30℃时,用质量分数25%氨水(过滤除菌)调节pH值。添加PTM1微量元素液12 mL;接入10 g/dL的摇瓶菌种后,通过自控系统调节温度在设定的范围内;搅拌转速400~800 r/min,通气量控制在4~12 L/(L· min),罐压0.2~0.3 MPa,校正DO至100 g/dL。由于毕赤酵母在发酵过程中会产生有机酸而导致pH值逐渐降低,所以整个发酵培养pH通过质量分数20%氨水和1 mol/L盐酸进行调节;培养到一定时间后通过添加补料培养基来实现高密度培养。
3)高密度培养:初始培养基配方为添加含0.4 mmol/L铜离子及3 mL/L PTM4微量元素液的改进BSM培养基(补充磷酸钾缓冲液1 g/dL以控制pH,补充蛋白胨3 g/dL以控制蛋白酶对目的蛋白质的降解),5 L的发酵罐装液1 L。第一阶段是菌体生长阶段,实施温度和pH控制,通过调整搅拌转速和通气量控制DO在20 g/dL以上,至溶氧快速反弹表示第一阶段结束。第二阶段是补料培养阶段,实施温度和pH控制,通过不同流加方式并调整搅拌转速和通气量控制菌体的生长。
1.2.2分析方法
1)菌体干质量:取4 mL发酵液置于空管质量为W0的5 mL的离心管中,8 000 r/min离心10 min,取上清液用于蛋白质分析及酶活力测定,沉淀于65℃烘箱烘干至恒质量为W1,计算公式
W=250×(W1-W0)。
2)漆酶酶活力的测定(ABTS法[5]):3 mL反应混合液中含0.5 mmol/L的ABTS 0.2 mL,pH 4.6的0.1 mol/L醋酸钠缓冲液2.7 mL和0.1 mL适当稀释的酶液,30℃反应3 min,于420 nm处测定吸光度。(ABTS在420 nm处的摩尔消光系数ε420=36 000 L/ (mol·cm)。在测定中以含灭活酶液的反应混合液为对照,酶活力单位定义为:1 min内催化氧化1 μmol底物的酶量为1个酶活力单位。
3)还原糖浓度测定:3,5-二硝基水杨酸法。
2 结果与讨论
2.1工程菌种子生长曲线的测定
待种子液培养至一定浑浊度后,每隔一定时间取样,测定种子液的干质量和pH值。绘制细胞干质量—时间、pH—时间曲线,见图1。由图可知,培养至48 h时,工程菌对数生长期结束,这与原始出发菌株生长曲线相一致(数据略)。在整个培养过程中pH值先下降,到对数期后保持在3~4之间。
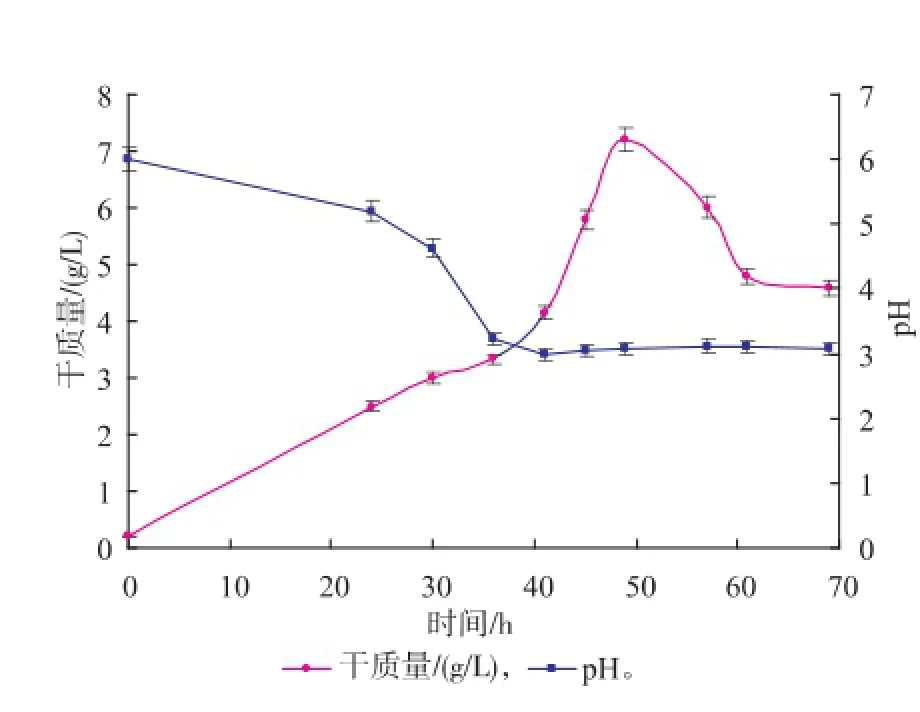
图1 X33/pGAPZα A-MLcc1的生长曲线及pH值曲线Fig.1 Growth and pH curves of X33/pGAPZα A-MLcc1
2.2工程菌的5 L容积发酵罐培养试验
在发酵罐中进行毕赤酵母的高密度发酵,外源蛋白质表达水平可比普通摇瓶高出数10倍,最重要的原因是摇瓶发酵的通气不理想,氧气供应不足,影响了毕赤酵母菌体的高密度生长,造成表达量偏低。为考察获得的重组菌株应用于工业化发酵生产漆酶的潜力,试验在摇瓶发酵基础上进行5 L的发酵罐培养:以BMGY改进培养基(甘油1 g/dL,蛋白胨1 g/dL)为初始发酵培养基,同时添加铜离子至终浓度0.5 mmol/L;培养温度为25℃,发酵罐转速为400 r/min,通气量控制在4 L/min。以体积分数10%的接种量进行发酵罐试验,发酵开始后每隔4~8 h取样一次,离心发酵液进行菌体生物量和漆酶活力的监测,结果如图2所示。

图2 X33/pGAPZα A-MLcc1的产酶曲线及干质量变化曲线Fig.2 Time courses of dry cell weight and enzyme activity in batch culture
发酵16 h之前菌体处于生长期,16~36 h菌体进入分裂生殖期,36 h左右重组菌开始进入生长及产酶的稳定期,这一时期大概10 h左右。比较菌体干质量的变化曲线与漆酶活力的监测曲线可以得出,重组菌产生的胞外漆酶活力与菌体干质量的增长在对数期均呈现有较大幅度的提高,当菌体进一步生长进入稳定期,发酵时间46 h时,漆酶产量达至峰值为47.2 U/L。随着发酵的延长,菌体量仍有所增长,但漆酶活力已开始下降。
2.3工程菌的高密度发酵
通过摇床至发酵罐的放大培养,漆酶活力得到了一定的提高,但远达不到工业化生产的目的,研究中进一步对工程菌实施高密度培养策略,期望能为漆酶的规模化生产提供一定的依据。发酵初始培养基以BSM培养基为基础进行适当的改进(添加1 g/dL蛋白胨及一定pH值的磷酸缓冲液),并通过在发酵过程中不同pH、搅拌转速及补料方式的考察,确定较优的高密度发酵条件。
2.3.1补料方式对重组工程菌发酵产漆酶的影响设计了恒速饱和流加方式、葡萄糖反馈控制流加方式及溶氧反馈流加方式,考察不同流加策略对重组工程菌发酵产漆酶的影响,具体实施方式如下:
1)恒速饱和流加方式,在补料阶段以100 mL/h的体积流量添加补料培养基,连续补料2 L;
2)葡萄糖反馈控制流加方式,至甘油耗尽时补料维持残糖质量浓度为3~6 g/L;
3)溶氧反馈流加方式,在补料阶段根据溶氧的变化进行补料培养基的添加,通过变速补料保持DO一直处于20~60 g/dL。发酵过程中漆酶的酶活力监测曲线见图3—5。
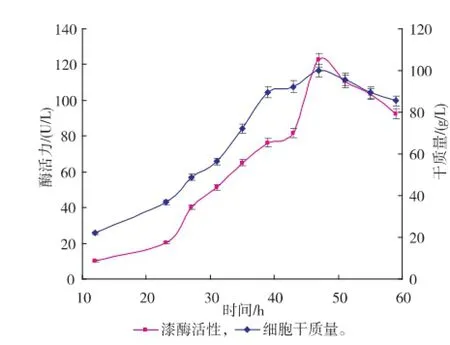
图3 恒速饱和流加方式下的X33/pGAPZα A-MLcc1的产酶曲线及干质量变化曲线Fig.3 Time courses of dry cell weight and laccase activity in fed-batch culture using constant feeding
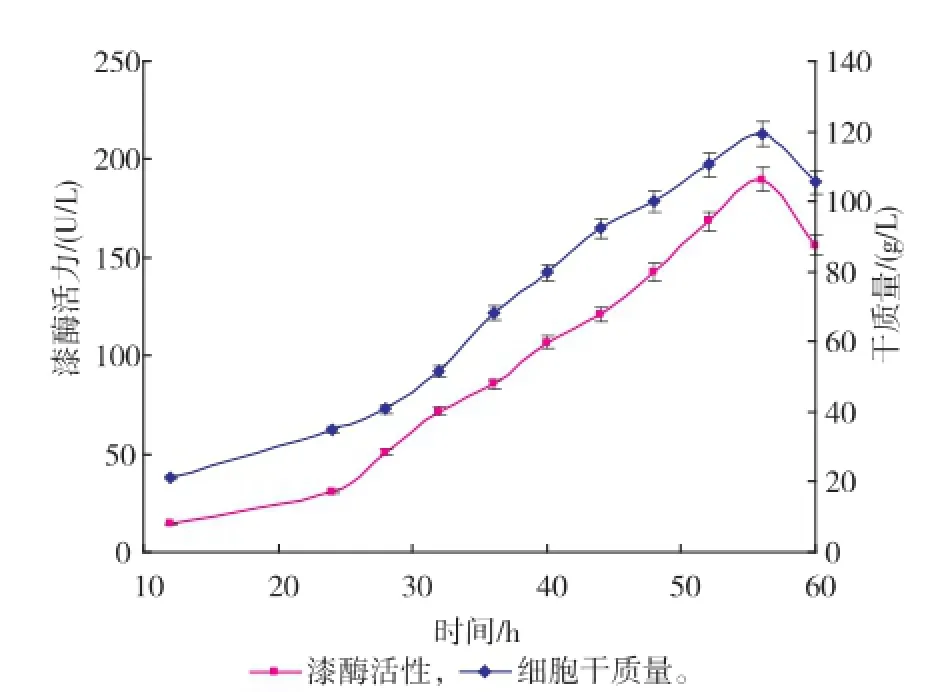
图4 葡萄糖反馈控制流加方式下的X33/pGAPZα AMLcc1的产酶曲线及干质量变化曲线Fig.4 Time courses of dry cell weight and laccase activity in fed-batch culture using glucose concentration feed-back control strategy

图5 溶氧反馈流加方式下的X33/pGAPZα A-MLcc1的产酶曲线及干质量变化曲线Fig.5 Time courses of dry cell weight and laccase activity in fed-batch culture using DO feed-back control strategy
由图可以看出,漆酶酶活力的增加和细胞干质量的提高呈正相关,也表明了本研究中的漆酶基因是组成型表达,不需要更换甲醇再进行诱导,故发酵产酶研究可通过菌体的密度增加实现。但补料阶段方式的不同,获得的酶活力高低及菌体干质量的增长也有差别,其中溶氧反馈控制模式获得的酶活力最高。恒速饱和流加方式可以最大限度地满足重组菌生长的营养需求,以致于菌体在补料初期快速增长,代谢的加快也使得菌体的衰老期提前,导致产酶后劲不足。葡萄糖反馈控制模式能很好地限制菌体在几乎不受有害代谢物影响的情况下增长,使得菌体在补料阶段呈较好的指数型生长,但后期营养物的比例失调及有害代谢物的累积,菌体最终走向衰亡;菌体限制性的生长也使得组成型表达的漆酶活力不能够快速提升,最终达至最高点189.8 U/L后即随着干质量一起下降。溶氧反馈模式通过菌体的实时生长情况进行补料,既保证了菌体养分的供应,又能在一定程度上促进漆酶的组成型表达;漆酶的酶活力虽然在补料过程中被稀释而表现出轻微下降情况,但在总体培养环境上优于前两者控制模式,最终可收获194.1 U/L的酶活力。在此模式下,每次降低溶氧需要补料200~500 mL,使得每次补料后漆酶被稀释而酶活呈现短时下降的趋势;漆酶在后期(尤其是在酶活力达至最高点后)存在降势,此时补料量持续增加仍不能维持设计的溶氧水平,菌体的高密度培养状态被打破,通过检测得出此时蛋白酶活力较高(数据未列出),菌体进入衰亡期。
2.3.2pH值对重组工程菌发酵产漆酶的影响pH值可通过抑制菌体中某些酶的活性,影响微生物细胞膜的通透性及改变培养基中某些组分和中间代谢产物的离解等,对菌体生长和目的蛋白质分泌表达的影响较大。毕赤酵母在pH 3~8的范围内均可生长,当pH低于2.2时菌体会停止生长,当pH值超过8,菌体生长和表达外源蛋白质也会很不理想。尽管毕赤酵母生长的pH值范围较宽,但是具体到不同的重组工程菌,则各有不同的最适生长pH值。另外,对于同一菌株,其生长和表达的最适pH值往往不同[6]。试验选取pH值为4、5、6、7,发酵过程中pH的酸碱性调控是通过在线补加氨水和盐酸来调整,以溶氧反馈控制补料方式实施高密度发酵,考察工程菌分泌表达的最适pH值。不同pH值下的重组菌高密度发酵获得的最高酶活力见图6。
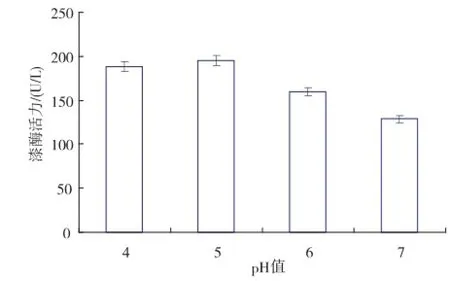
图6 pH值对重组菌发酵产漆酶的影响Fig.6 Effects of pH values on the yields of laccase from recombinant stain fermentation
在基因工程菌分泌表达外源蛋白质过程中,重组漆酶对pH值存在一定的敏感性,容易受到蛋白水解酶的降解,选择合适的pH值可以使菌体高效表达目的蛋白质又能抑制蛋白酶的水解。从图6得知,通过高密度发酵,酶活力水平较之分批发酵有了很大的提高,均达至100 U/L以上;在恒定pH为5的条件下,可通过高密度发酵获得最高酶活力约200 U/L,是摇瓶发酵获得最高酶活力的5倍(数据略)。
2.3.3不同溶氧控制水平对重组工程菌发酵产漆酶的影响发酵基质中DO对于好氧微生物的生长以及发酵产物量的提高非常重要。提高发酵罐内溶氧水平的方式主要有:增加通气量、加大罐压、增加搅拌转速,甚至直接通入纯氧。毕赤酵母是好氧微生物,它的生长代谢过程需要氧的参与,但溶解氧的质量浓度过高或过低都会影响毕赤酵母的代谢,使后期的生长变得极为缓慢,从而影响到蛋白质的表达。试验中通过补料阶段不同溶氧控制水平,研究溶氧对重组菌产漆酶的影响,期间获得的最大细胞干质量及最高漆酶酶活力结果见图7。

图7 DO对重组工程菌发酵产漆酶的影响Fig.7 Effects of various DO values on the yields of laccase from recombinant stain fermentation
毕赤酵母在生长初期就需要保证足量的氧供应,一般在菌体前期生长阶段,发酵罐内溶氧水平保持在较高水平(30 g/dL以上),在发酵过程中溶氧逐渐下降,当低于30 g/dL时即提高转速并加大通气量,使其不低于30 g/dL;当出现溶氧突然陡直上升时,开始进行补料,控制DO低于45 g/dL,因为细胞在高溶氧条件下容易发生氧中毒,不利于菌体的生长,导致外源蛋白质表达量不高。由图7可以看出,溶氧水平控制在15~30 g/dL之间可以获得最高的酶活力216.3 U/L。溶氧过低(0~15 g/dL)时菌体受到氧的限制呼吸作用减弱,故而影响到了漆酶的表达。溶氧在30~45 g/dL时可以获得最高的菌体干质量,但漆酶的表达水平并没有达到最高,可见漆酶组成型表达过程中还有诸多影响因素,导致漆酶的表达不能达到和菌体增加呈完全正相关;溶氧控制在45~60 g/dL时,细胞干质量及漆酶酶活力水平均不是太高,可见氧毒害作用已经开始影响到菌体的生长了。本试验结果与张建勇等[7]的研究结果相一致。可见,保持溶氧在有利于外源蛋白质高效表达的范围,对于高密度发酵来说非常重要。
3 结语
pGAPZ是一类新型的酵母组成型表达质粒,其启动子可与表达载体一起整合到基因组中,可有效地避免其融合的外源基因的丢失,具有带动外源基因高效、连续表达的潜力。目前该表达系统已经应用于多种酵母菌株,获得了异源蛋白质表达并逐步深入和优化,高密度发酵其突出的简便可行性及多种优异特性正受到越来越多研究者的关注。由于pGAP在工程菌发酵产外源蛋白质时仅需通过简单的发酵工艺而不需要AOX启动子引导的外源蛋白质表达诱导阶段,避免了诱导物甲醇等可能引起的“二次污染”及不安全因素[8],因此是后期工程菌在工业化规模表达外源蛋白质的首选。
对基因工程菌X33/pGAPZα A-MLcc1进行了5 L容积发酵罐的高密度培养,通过在补料阶段采用溶氧反馈控制方式获得了漆酶的胞外高表达。通过高密度发酵可获得漆酶的最高酶活力达216.3 U/L,是分批发酵获得的最高酶活力的4.6倍,采用组成型表达模式可在较短时间内获得漆酶表达峰值,简化了工艺,对漆酶的工业化应用具有参考意义。
[1]高玉千,张利明,张世敏,等.真菌漆酶高级结构研究进展[J].食品与生物技术学报,2011,30(2):166-171. GAO Yuqian,ZHANG Liming,ZHANG Shimin,et al.Research progress of fungal laccase structure[J].Journal of Food Science and Biotechnology,2011,30(2):166-171.(in Chinese)
[2]Giardina P,Annio R,Martirani L,et al.Cloning and sequencing of a laccase gene from the lignin-degrading basidiomyccte Pleurotus ostreatus[J].Appl Environ Microbiol,1995,61(6):2408-2413.
[3]郭梅,蒲军,杜连祥,等.杂色云芝漆酶基因(Lccl)的克隆及在甲醇毕赤酵母中的表达[J].菌物学报,2005,24(2):221-226. GUO Mei,PU Jun,DU Lianxiang,et al.Coloning of cDNA encoding laccase(Lccl)from Coriolus versicolor and expression of the gene in Pichia methanolica[J].Mycosystema,2005,24(2):221-226.(in Chinese)
[4]马文寅,蔡宇杰,廖祥儒,等.一种真菌漆酶的克隆与序列分析[J].食品与生物技术学报,2012,31(1):40-46. MA Wenyin,CAI Yujie,LIAO Xiangru,et al.Cloning and sequencing analysis of a laccase gene from fungus[J].Journal of Food Science and Biotechnology,2012,31(1):40-46.(in Chinese)
[5]Liu X,Gillespie M,Ozel A D,et al.Electrochemical properties and temperature dependence of a recombinant laccase from Thermus thermophilus[J].Anal Bioanal Chem,2011,399(1):361-366.
[6]王学强,程相朝,刘一尘,等.重组鸡IL-18与新城疫HN基因融合蛋白在毕赤酵母中表达条件的优化[J].河南科技大学学报:自然科学版,2010,31(2):73-77. JIAN Yun,CUI Shujun,GU Likun,et al.Optimation of condition for expression of recombinant ChMIL18-HN in Pichia pastoris [J].Journal of Henan University of Science&Technology:Natural Science,2010,31(2):73-77.(in Chinese)
[7]张建勇,王晓港,王水莲,等.溶氧对重组毕赤酵母高密度发酵生产腺苷蛋氨酸的影响[J].齐鲁药事,2007,26(7):428-430. ZHANG Jianyong,WANG Xiaogang,WANG Shuilian,et al.Effects of the dissolved oxygen on producing S-adenosyl-L-methionine by High-density fermentation of recombinant Pichia pastori[J].Qilu Pharmaceutical Affairs,2007,26(7):428-430.(in Chinese)
[8]娄瑞娟,罗利龙,张霞,等.巴斯德毕赤酵母表达系统的研究进展和前景展望[J].生物学杂志,2010,27(5):73-76. LOU Ruijuan,LUO Lilong,ZHANG Xia,et al.Research progress and prospects on Pichia pastoris[J].Journal of Biology,2010,27(5):73-76.(in Chinese)
Study of High Cell-Density Fermentation of Laccase Produced by Pichia pastoris X33/pGAPZαA-MLcc1
HUANG Liang1,2,LIU Yihan1,LIU Xiaoguang1,LI Yu1,LU Fuping*1
(1.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin Key Laboratory of Industrial Microbiology,National Engineering Laboratory for Industrial Enzymes,The College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;2.College of Agronomy and Resources Environmental,Tianjin Agricultural University,Tianjin 300384,China)
The expression of laccase gene by Pichia pastoris X33/pGAPZα A-MLcc1 was investigated in a 5 L fermenter.The change trend of laccase activity was consistent with the change trend dry cell weight.The extracellular laccase activity reached the highest value of 47.2 U/L when the yeast X33 entered the stationary phage at 46 h.High-density fermentation in a 5 L fermenter was further investigated and the optimized method for high-level expression was obtained as follows:by adopting dissolved oxygen(DO)feed-back feeding strategy and maintaining DO at 15%to 30%at feeding stage,as well as adding ammonia solution and hydrochloride to maintain pH value at 5 in the fermentation stage,the laccase activity reached 216.3 U/L,which was 4.6 times higher than that of fed batch fermentation.
Picha pastoris;laccase;high cell-density fermentation
Q 815
A
1673—1689(2016)03—0324—06
2014-12-01
天津市科技支撑计划项目(14ZCZDSY00014);天津市科技特派员项目(15JCTPJC56500)。
黄亮(1983-),男,江苏沐阳人,工学硕士,副教授,主要从事微生物发酵及食用菌相关研究。E-mail:huangliang@tjau.edu.cn
路福平(1967—),男,山西运城人,工学博士,教授,主要从事酶与应用微生物研究。E-mail:lfp@tust.tjau.edu.cn

