糟醅堆积过程中微生物种群的变化规律
山其木格,梁慧珍,张长霞,张林奇,谭旭,梁丽泉,李长文(天津市天士力控股集团健保食品研究所,天津300402)
糟醅堆积过程中微生物种群的变化规律
山其木格,梁慧珍*,张长霞,张林奇,谭旭,梁丽泉,李长文
(天津市天士力控股集团健保食品研究所,天津300402)
糟醅堆积发酵是酱香型白酒生产工艺中一个重要的环节,对白酒品质、产量有很大的影响。采用PCR-DGGE生物技术研究酱香型白酒酿造中所有的糟醅堆积过程,对堆积糟醅中的微生物种群变化进行跟踪,揭示微生物种群在各个轮次糟醅堆积过程的变换规律。从整体看,堆积发酵过程细菌种类多于真菌种类,下沙期间堆积糟醅的微生物种类很少,糙沙阶段微生物种类开始逐渐增多,二轮次堆积时微生物种类最丰富,且在整个酿酒年度的末期,堆积糟醅微生物多样性有减少现象。
堆积发酵;微生物种群变化;糟醅
酱香型白酒是我国主要的白酒香型之一,属大曲酒类。典型的酱香白酒特点为酱香突出、幽雅细腻、酒体醇厚、回味悠长、空杯留香持久。酱香型白酒的生产以一年为一个生产周期,经过2次投料,9次蒸煮,8轮发酵,7次取酒。酱香型白酒“四高两长”的生产工艺是其品质风格特点的源泉,其中之一即高温堆积,某种程度上可说没有堆积就没有酱香酒[1-2]。
在酱香白酒生产中,由于采用的是高温制曲,导致在大曲制作过程中几乎所有的酵母菌都被杀死。经过后来的堆积过程,糟醅网罗空气中微生物尤其是酵母菌。堆积也是微生物发酵产生各种酶类,并在多种微生物及其酶类共同作用下生成酒体中的香味物质及其前体物质的过程。因此堆积也称为“二次制曲”。在堆积过程中温度由内向外不断升高,最终堆积糟醅顶温升至50℃左右,糟醅表面产生一层白色斑点,并产生明显的酒香味,略有酱香时即可入池发酵。此外,经过高温堆积也抑制或淘汰了一部分杂菌,驯化了耐高温酵母,更有利于耐高温细菌的繁殖与作用,有利于糖化发酵,促进酱香风味的形成,为窖内发酵创造了条件[3]。可见,堆积发酵对出酒率和产酒品质都有很大的影响。从图1的酱香型白酒工艺流程可以看出,在整个酿酒年度中有8次糟醅堆积过程,分别在下沙、糙沙、一轮次、二轮次、三轮次、四轮次、五轮次及六轮次期间进行,待七轮次酒蒸馏之后丢糟。酱香白酒酿造过程中,各轮次堆积时的气候、温湿度及原料状态等条件不同,各个轮次基酒的特点也各不相同,因此针对各轮次堆积过程的菌种多样性进行分析具有重要的意义。
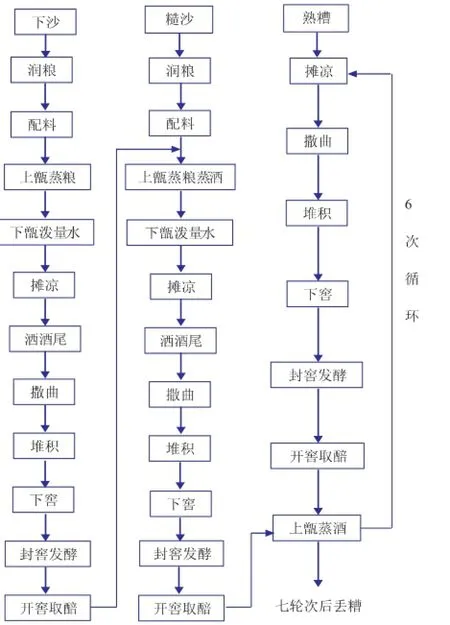
图1 酱香型白酒工艺流程Fig.1 Moutai-flavor liquor production process
近10年来,关于酱香型白酒微生物的研究一直未曾间断,主要集中于从酒曲、糟醅、窖泥中分离特殊功能微生物,并研究其生理生化特性及对白酒品质的改良功能。这些研究主要以传统微生物实验技术、采用划线分离及形态鉴定,采用分子生物学鉴定的报道较为少见[4]。黄永光等人在“酱香白酒堆积发酵过程酒醅中的酵母菌的分析研究”一文中对堆积发酵过程酒醅中的酵母菌进行分离、形态学初筛和PCR产物扩增及26S rDNA定性鉴定分析,并对其中所获取的部分优选菌株的发酵性能及其发酵代谢风味成分贡献进行了研究[5]。利用PCRDGGE技术研究糟醅堆积过程中的微生物多样性,克服了常规平板培养方法的一些缺点,在分析复杂微生态演替规律的研究中具有较大的应用价值。
本课题研究中主要采用PCR-DGGE生物技术,针对酱香型白酒酿造中所有的糟醅堆积过程,对堆积糟醅中的微生物种群变化进行跟踪,从而揭示微生物种群在各个轮次糟醅堆积过程的变换规律。
1 材料与方法
1.1样品
糟醅样品取自贵州国台酒业有限公司酿酒车间。首先对堆积糟醅各个部位进行温度测量,挑选出温度上升较明显、微生物活动较活跃的位点,即100 cm高40 cm深处作为取样检测的固定位点,并在糟醅堆积的各个阶段进行取样分析。
1.2试剂和仪器
TaqDNA聚合酶、dNTP,购自TaKaRa公司;土壤总DNA提取试剂盒,购自OMEGA公司;PCR仪MyCyclerTMThermal Cycler,DGGE图谱DCodeTM通用突变检测系统,Discovery Series凝胶成像系统,Quantity One分析软件,均购自美国Bio-Rad公司;DYY-6C琼脂糖电泳装置,购自北京六一仪器厂。
1.3实验方法
1.3.1总DNA的提取糟醅样品取样后,冷冻密封保存于冰箱-20℃,尽快提取样品总DNA。将糟醅样品加入PBS缓冲液(pH 7.4)中,摇床振荡,分步离心,收集菌体。使用土壤总DNA提取试剂盒,根据说明书的指示,进行各轮次堆积糟醅样品中微生物总DNA的提取。
1.3.2PCR扩增以糟醅样品总DNA为模板,利用巢式PCR技术,扩增出16S rDNA V3可变区,供糟醅样品细菌群落分析[6]。应用通用引物16S1(5′-AGAGTTTGATCMTGGCTCAG-3′)和16S2(5′-TACGGYTACCTTGTTACGACTT-3′),进行第一步扩增,得到16S PCR产物;再以16S PCR产物为模板,利用第二步扩增引物R518(5′-ATTACCGCGGCT GCTGG-3′)和338F(5′-ACTCCTACGGGAGGCAGC AG-3′),扩增得到细菌16S rDNA V3可变区片段。与此同时,以糟醅总DNA为模板,利用巢式PCR技术,扩增出真菌FR1/FF390区,供糟醅样品真菌群落分析。应用通用引物Geo11(5′-ACCTTGTTACGACTTTTACTTCC-3′)和GeoA2(5′-CCAGTAGTCATATGCTTGTCTC-3′)进行第一步扩增,得到18S PCR产物;再以18S PCR产物为模板,利用第二步扩增引物FR1(5′-AICCATTCAATCG GTAIT-3′)和FF390(5′-CGATAAC GAACGAGAC CT-3′)扩增得到真菌FR1/FF390区。在引物338F和FR1中分别引入GC发夹,以便在DGGE中有效分离。PCR反应条件为:94℃,4 min;94℃变性30 s,50~55℃退火30 s;72℃延伸60 s,30个循环;72℃,10 min。用1 g/dL琼脂糖凝胶电泳对PCR产物进行检测。
1.3.3变性梯度凝胶电泳及图像分析堆积糟醅样品的细菌16S rDNA V3可变区和真菌FR1/ FF390区通过DGGE分析研究微生物群落的构成[7]。根据经验,对细菌和真菌分析采用不同浓度、不同梯度的DGGE方法。对于细菌16S rDNA V3可变区,丙烯酰胺凝胶浓度为10 g/dL,变性梯度范围为30%~60%(100%变性梯度包含体积分数40%甲酰胺和7 mol/L尿素);对于真菌FR1/FF390区,丙烯酰胺凝胶浓度为8 g/dL,变性梯度范围为20%~50%。PCR产物电泳上样量均为50 μL,电泳采用DCodeTM通用突变检测系统。首先在20 V电压预电泳20 min,随后调整至100 V,电泳10 h。电泳结束后,进行SYBR Green I染色液染色,通过紫外凝胶成像仪捕获图像。利用分析软件Quantity One,读取图谱上条带的光密度值,完成匹配比对后,采用UPGAMA算法进行聚类分析,并生成DGGE图谱相似性分析图[8]。
1.3.4序列分析DGGE结束后,对其主要优势条带进行切胶回收。用R518/338F和FR1/FF390引物分别进行再扩增后纯化,参考pUCm-T载体说明书进行转化、克隆。挑取阳性克隆子交由BGI公司进行序列测定。将所测得的序列在美国国家生物技术信息中心(NCBI)网页(http://www.ncbi.nlm.nih.gov)通过BLAST进行比对,寻找与目的序列同源性最高的菌种的序列,从而确定优势菌种。
2 结果与分析
2.1糟醅细菌DGGE分析
在巢式PCR中,应用16S1/16S2引物进行第一步扩增,得到大小约为1 500 bp的产物(见图2 (a)),应用R518/338F-GC引物进行第二步扩增,得到大小约为240 bp的产物(见图2(b)),结果均与期望一致。

图2 堆积糟醅细菌16S rDNA和16S V3可变区鉴定图Fig.2 16SrDNA and highly variable V3 region of 16S rDNA of bacteria in stacked fermentation
经过对糟醅堆积的各个阶段即下沙、糙沙、一轮次、二轮次、三轮次、四轮次、五轮次及六轮次糟醅堆积过程中细菌多样性的跟踪检测,发现下沙期间糟醅堆积中细菌种类较少,糙沙期间细菌种类开始增多,二轮次期间细菌多样性最丰富,三轮次至四轮次堆积糟醅样品的细菌多样性大致相同,五轮次至六轮次细菌种类稍有减少,细菌鉴定详细情况见图3及采用UPGAMA算法进行的聚类分析图4。

图3 堆积糟醅细菌16S V3可变区DGGE图及识别图Fig.3 DGGE fingerprints of 16S V3 region of bacteria in stacked fermentation and its identification chart
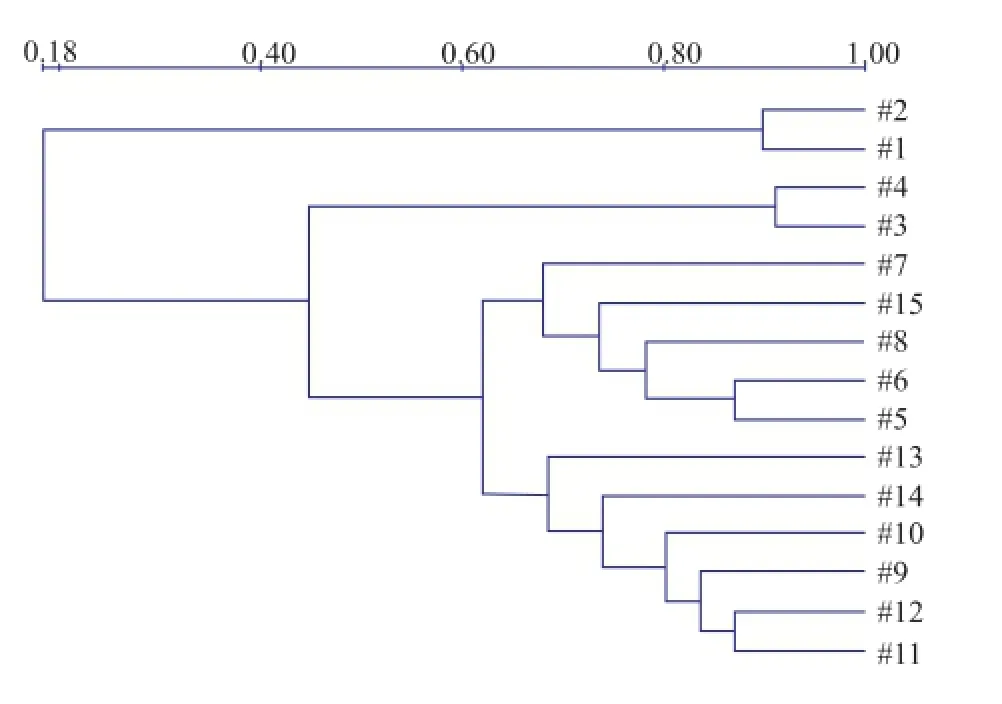
图4 堆积糟醅细菌16S V3可变区样品相似性分析图Fig.4 UPGAMAanalysisshowingthephylogenic relationshipofthebacteriainstacked fermentation
2.2糟醅真菌DGGE分析
在巢式PCR中,应用Geo11/GeoA2引物进行第一步扩增,得到大小约为1 800 bp的产物(见图5),应用FF390/FR1-GC引物进行第二步扩增,得到大小约为390 bp的产物(见图6),结果均与期望一致。

图5 堆积糟醅真菌18S rDNA鉴定图Fig.5 18S rDNA of fungi in stacked fermentation

图6 糟醅真菌FR1/FF390区鉴定图Fig.6 FR1/FF390 region of fungi in stacked fermentation
经过对各个阶段糟醅堆积过程中真菌多样性的跟踪检测,发现堆积糟醅真菌多样性较少,没有细菌种类丰富。下沙期间糟醅堆积中真菌种类很少,之后逐渐增多;二轮次期间真菌多样性较丰富,并在二轮次至六轮次期间,堆积糟醅的真菌多样性几乎没有变化。真菌鉴定详细情况见图7及采用UPGAMA算法进行的聚类分析图8。

图7 堆积糟醅真菌FR1/FF390区DGGE图及识别图Fig.7 DGGE fingerprints of FR1/FF390 region of fungi in stacked fermentation and its identification chart
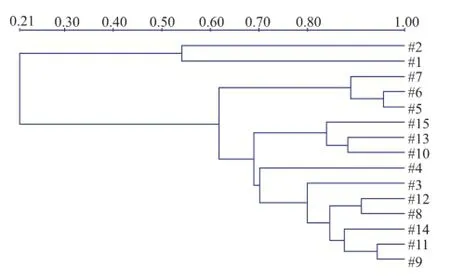
图8 堆积糟醅真菌FR1/FF390区样品相似性分析图Fig.8 UPGAMAanalysisshowingthephylogenic relationship of the fungi in stacked fermentation
3 讨论
对酱香型白酒生产中各个轮次堆积发酵过程的优势微生物变换情况作了比较详细的分析,为今后白酒生产的生物优化技术、发酵控制技术等提供了理论依据和参考。酱香型白酒酿造中,在下沙、糙沙、一轮次、二轮次、三轮次、四轮次、五轮次及六轮次等阶段均有糟醅堆积的过程。各轮次堆积时的气候、温湿度及原料状态等条件不同,各个轮次基酒的特点也各不相同。因此本课题研究中针对各轮次堆积过程的菌种多样性进行跟踪,观察在各轮次堆积糟醅中微生物多样性的交替变换情况。经分析发现,下沙期间糟醅的细菌种类很少,只有耐酸乳杆菌、乳酸片球菌和巴氏醋杆菌。糙沙堆积期间,细菌多样性明显增加,多增了面包乳杆菌、芽孢杆菌属及Virgibacillus属的细菌。一轮次堆积时多增Tsukamurella spumae、Acetobacter nitrogenifigens、Thermoactinomyces sanguinis等细菌。二轮次堆积时细菌多样性最为丰富,多增苜蓿中华根瘤菌和直杆糖多孢菌。三轮次至四轮次堆积过程中细菌多样性几乎类似;五轮次至六轮次堆积期间细菌多样性稍有减少。细菌16S rDNA V3可变区DGGE图谱识别图显示了各个轮次堆积糟醅细菌种类与细菌多样性最为丰富的二轮次堆积糟醅细菌种类的对比结果。从图3和图4中,可以发现下沙期间细菌种类最少,其同源性少于8%;糙沙期间细菌种类开始增多,同源性在50%左右。一轮次堆积开始细菌种类同源性普遍达到70%以上。堆积过程中的真菌,其多样性不及细菌丰富。下沙堆积期间真菌种类最少,只有白地霉和Pichia fermentans;糙沙堆积期间真菌种类稍有增加,多增嗜酒假丝酵母、亚硝酸对粟酒裂殖酵母菌和酿酒酵母等;二轮次开始堆积糟醅的真菌种类趋于稳定,大致包含嗜酒假丝酵母、Pichia fermentans、亚硝酸对粟酒裂殖酵母菌和酿酒酵母等。真菌FR1/FF390区DGGE图谱识别图显示了各个轮次堆积糟醅真菌种类与真菌多样性最为丰富的二轮次堆积糟醅真菌种类的对比结果。从图7和图8中,可以发现下沙期间真菌种类最少,其同源性在15%以下;糙沙期间真菌种类开始增加,同源性可达70%;二轮次至六轮次真菌种类较稳定,同源性大致可保持在80%以上。酿酒年度的初期糟醅堆积中,细菌及真菌多样性均少,加之底物是生粮,因此一轮次基酒具有生沙香突出、有生粮味的特点。随着微生物多样性的逐步增多,可发酵出更多更丰富的呈味物质,使得三、四、五轮次的基酒变得酱香较为突出、醇和,成为酱香型白酒勾调中的大宗酒,可见微生物在酱香型白酒发酵过程中承担着重要的角色。
4 结语
白酒酿造过程是微生物发酵的过程,也是呈味物质的产生过程。酱香型白酒酿造过程中微生物主要来自大曲和堆积过程网罗空气和环境中的微生物。其中,糟醅堆积不仅是扩大微生物数量为入窖发酵创造条件,也是酱香型白酒的香味成分或香味前体物质产生的过程。掌握堆积过程中微生物的种群变化,对于控制白酒发酵有着很重要的意义。今后要进一步探索酱香型白酒发酵机理,弄清楚各个呈味物质的生成过程,这有待白酒研究人员做更深入、更精细的微生物代谢研究。
[1]唐玉明,任道群,姚万春,等.酱香型酒糟醅堆积过程温度和微生物区系变化及其规律性[J].酿酒科技,2007(5):54-58. TANG Yuming,REN Daoqun,YAO Wanchun,et al.The change rules of temeprature and microflora during the stacking of maotai-flavor fermenting grains[J].Liquor-Making Science and Technology,2007(5):54-58.(in Chinese)
[2]冯雨.酱香型白酒的堆积发酵[J].酿酒科技,2013(2):80-81. FENG Yu.Study on stacked fermentation of Jiang-flavor liquor[J].Liquor-Making Science and Technology,2013(2):80-81. (in Chinese)
[3]王贵军,沈才洪,张洪远,等.酱香型白酒糟醅堆积与窖内发酵工艺研究[J].酿酒科技,2011(5):36-41. WANG Guijun,SHEN Caihong,ZHANG Hongyuan,et al.Investigation on accumulation&in-pit fermentation of distiller's grains of maotai-flavor liquor[J].Liquor-Making Science and Technology,2011(5):36-41.(in Chinese)
[4]李丽,赵盈盈,曾娟,等.传统固态发酵白酒的酿酒微生物区系研究概括[J].酿酒科技,2014(5):79-83. LI Li,ZHAO Yingying,ZENG Juan,et al.A review of the research on microflora in liquor-making by traditional solid fermentation[J].Liquor-Making Science and Technology,2014(5):79-83.(in Chinese)
[5]黄永光,谌永前,吴广黔,等.酱香白酒堆积发酵过程酒醅中酵母菌的分析研究[J].酿酒科技,2013(6):8-13. HUANG Yongguang,CHEN Yongqian,WU Guangqian,et al.Analysis of yeast strains in fermented grains during stacking fermentation of Jiang-flavor liquor[J].Liquor-Making Science and Technology,2013(6):8-13.(in Chinese)
[6]张文学,乔宗伟,胡承,等.PCR技术对浓香型白酒糟醅细菌群落的解析[J].四川大学学报:工程科学版,2005,37(5):82-87. ZHANG Wenxue,QIAO Zongwei,HU Cheng,et al.Analysis of bacterial community in fermented grains during the production of Chinese strong aromatic spirits by PCR technique[J].Journal of Sichuan University:Engineering Science Edition,2005,37 (5):82-87.(in Chinese)
[7]张文学,乔宗伟,胡承,等.浓香型白酒糟醅中真菌菌群的多样性分析[J].四川大学学报:工程科学版,2006,38(5):97-101. ZHANG Wenxue,QIAO Zongwei,HU Cheng,et al.Fungal diversity of fermented grains during the production of Chinese strong aromatic spirits[J].Journal of Sichuan University:Engineering Science Edition,2006,38(5):97-101.(in Chinese)
[8]李家民,邹永芳,王海英,等.DGGE法初步解析浓香型白酒糟醅微生物群落结构[J].酿酒科技,2013(2):34-37. LI Jiamin,ZOU Yongfang,WANG Haiying,et al.Preliminary analysis of microbial communities structure in nong-flavor fermented grains in tuopai distillery by DGGE technology[J].Liquor-Making Science and Technology,2013(2):34-37.(in Chinese)
谷氨酸生产过程资源高效利用及降污技术
谷氨酸是生物发酵产业的主导产品,我国的总产量占全球75%以上,其生产技术对我国氨基酸发酵技术产生重大的影响。然而谷氨酸发酵生产中多环节产污问题一直制约着行业的发展,其生产废水表现为高COD、高NH3-N、高盐、低pH“三高一低”的特征,一度成为我国高重污染行业的象征。
江南大学、菱花集团有限公司等的科研人员通过系统科学的理论研究、中试、产业化和推广应用,解决了谷氨酸生产链中因产污较重而长期困扰发酵行业发展的重大技术难题。如:
CN200810023516.2涉及一种低物耗少废水的谷氨酸提取新工艺,特征是谷氨酸发酵液进入等电结晶罐等电结晶,等电结晶后经离心分离得到谷氨酸结晶和等电母液,将等电母液通过菌体分离得到菌体蛋白质和等电清母液,再将等电清母液一部分蒸发得到浓缩清母液,另一部分留存为二次结晶谷氨酸溶解用,浓缩清母液经二次结晶,得到二次结晶谷氨酸晶体,用水、等电清母液和硫酸使二次结晶谷氨酸晶体溶解,经溶解得到的含有谷氨酸的稀硫酸溶液送回等电结晶罐,调节下一批发酵液等电结晶。该发明能降低硫酸和液氨的消耗;由于采用二次结晶工艺,可提高谷氨酸提取收率;谷氨酸结晶质量最好,无需“变晶”。CN200810244726.4涉及一种高质量低物耗少废水的谷氨酸提取方法,特征是将谷氨酸发酵液通过菌体分离得到副产物菌体蛋白质和清发酵液;清发酵液进入等电结晶罐等电结晶使谷氨酸结晶析出;等电结晶后经离心分离得到产品谷氨酸结晶和等电母液;将上述等电母液分成两部分,一部分等电母液进入蒸发器蒸发得到浓缩清母液,另一部分作为溶解二次结晶谷氨酸用;浓缩清母液二次结晶;二次结晶的谷氨酸晶体进入溶解罐,使谷氨酸结晶溶解;经溶解得到含有谷氨酸的稀硫酸溶液送回等电结晶罐,调节下一批发酵液等电结晶。CN200910162051.3公开了一种利用发酵谷氨酸提取废液生产复合肥的方法,包括如下步骤:在40~150℃的温度条件下,对发酵谷氨酸提取废液进行蒸发浓缩处理,使所得浓缩浆料中固形物的质量分数达到40%~99%;对所述浓缩浆料进行冷却处理,使其温度达到20~120℃;对步骤b所得物料中依次进行造粒处理和冷却固化成型处理,得到所述复合肥。该发明所述方法,可以克服现有技术中环保性差和回收资源利用率低等缺陷,以实现环保性好、产品性能好、适用面广和回收资源利用率高的优点。CN200810156676.4涉及一种从高浓高杂溶液中回收谷氨酸的生产工艺,特征是先将谷氨酸等电母液通过絮凝或膜分离的方法,分离得到副产物菌体蛋白质和等电清母液;将分离得到的等电清母液部分或全部送入蒸发器蒸发浓缩为浓缩液,向蒸发浓缩液中添加晶形为α-形的谷氨酸晶种育晶;浓缩液育晶后继续浓缩,同时将剩余的等电清母液流加到蒸发器中,蒸发浓缩后的浓缩液再次育晶分离得到谷氨酸;二次育晶分离得到的育晶母液可继续结晶硫酸铵,或喷雾干燥生产复合肥。CN201010286887.7公开了一种谷氨酸连续等电结晶的方法,包括如下步骤:将等电液和发酵液按照一定比例混合,同时加入硫酸或离交高流分或酸性水解液,维持混合液的pH值在3.0~3.2之间;步骤a所得混合液连续回流到连续结晶罐中,使过饱和的谷氨酸分子在已有的谷氨酸晶体表面结晶析出;步骤b所述谷氨酸结晶析出后的等电液,部分回到步骤a,部分携带大颗粒谷氨酸结晶从连续等电罐中排出,再经过冷却、沉降、分离后得到优质谷氨酸结晶产品。该发明可以克服现有技术中操作困难、结晶质量差和提取收率低等缺陷,以实现操作简便、产品质量好、提取收率高和处理能力大等优点。CN201010598953.4公开了一种将玉米浸泡水用于温敏型发酵工艺生产谷氨酸的方法,是用玉米浸泡水代替温敏型发酵工艺中的玉米浆制备发酵培养基,发酵生产谷氨酸。该工艺技术操作方便,节水节能,有利于降低谷氨酸的发酵成本,适于在生产中全面推广。该发明不仅可节省配料用的一次水,也大大节省玉米浸泡水进一步蒸发浓缩所消耗的能源,解决了利用玉米浸泡水生产玉米浆(粉)所造成的坏境污染和能源消耗问题,同时其产酸率和糖酸转化率也有所提高。CN201310660707.0提供了一种氨取代氢氧化钠调节谷氨酸提取配料的pH的方法及装置。与现有技术相比所产生的有益效果是:氨代替氢氧化钠后,大幅降低了生产成本;料液中的铵根离子在被带式分离排出后与谷氨酸上游生产中产生的硫酸根离子结合生产硫酸铵,有效提高了硫酸铵的产量,增加了效益。
对大宗微生物发酵产品谷氨酸而言,分析废水产生的环节、原因及废水的水质特点,研发以“无废低耗工艺”为核心的清洁生产技术和资源高效利用技术,将是行业研究人员的努力方向。
(江南大学图书馆张群)
Changes of Microbial Diversity in Stacked Fermentation for the Production of Moutai Flavor Liquor
SHAN Qimuge,LIANG Huizhen*,ZHANG Changxia,ZHANG Linqi,
TAN Xu,LIANG Liquan,LI Changwen
(Tianjin Tasly Holding Group Division of Nutraceutical Products,Tianjin 300402,China)
Stacked fermentation is an important part in the production of Moutai flavor liquor and has a great impact on the yield and quality of liquor.The study used PCR-DGGE to reveal the change of microbial population in eight rounds of stacked fermentation during the production of Moutai flavor liquor.It was concluded that there was a certain rule in the change of microbial diversity:the bacterial species in stacked fermentation were more than fungal species during all rounds of stacked fermentation;for the first round,there were only a few microbial species;in the second round,the microbial diversity began to increase;when the fermentation came to the fourth round,the microbial diversity was most abundant;in the final round,the microbial diversity tended to decrease.
stacked fermentation,changes of microbial diversity,fermented grains
Q 815
A
1673—1689(2016)03—0330—06
2014-12-12
山其木格(1979—),女,新疆乌鲁木齐人,蒙古族,工学硕士,工程师,主要从事微生物发酵研究。E-mail:sqmg790309@163.com
梁慧珍(1968—),女,山东烟台人,工学硕士,高级工程师,主要从事微生物发酵研究。E-mail:misslianghuizhen@sina.com

