产碱性淀粉酶重组枯草芽孢杆菌的构建与发酵优化
王静丽,刘松,堵囯成*,2,陈坚,2(.江南大学工业生物技术教育部重点实验室,江苏无锡2422;2.食品科学与技术国家重点实验室,江南大学,江苏无锡2422)
产碱性淀粉酶重组枯草芽孢杆菌的构建与发酵优化
王静丽1,刘松1,堵囯成*1,2,陈坚1,2
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.食品科学与技术国家重点实验室,江南大学,江苏无锡214122)
碱性淀粉酶催化淀粉在碱性环境中高效降解,广泛应用于纺织退浆、洗涤、制药等领域。通过信号肽筛选,将来源于嗜碱单胞菌Alkalimonas amylolytica的碱性淀粉酶基因于枯草芽孢杆菌Bacillus subtilis WB600实现分泌表达,并优化了重组菌产酶的发酵条件。在最佳信号肽ywbN介导下,重组B.subtilis发酵51 h,胞外AmyK酶活最高达146.86 U/mL,且能在发酵上清液中检测到与AmyK理论相对分子质量(60 kDa)一致的蛋白质条带。通过单因素实验优化了发酵培养基(糊精32 g/L,蛋白胨12 g/L,酵母粉24 g/L,KH2PO42.32 g/L,K2HPO4·3H2O 16.43 g/L),并在发酵24 h后添加0.2 g/dL Na2CO3调节发酵液pH,发酵72 h胞外AmyK酶活达640.33 U/mL,较优化前提高了336%,是目前已报道重组B.subtilis产碱性淀粉酶的最高水平。研究结果为AmyK发酵生产的工业化提供了数据支撑。
碱性淀粉酶;信号肽;重组枯草芽孢杆菌;发酵优化;碳酸钠
α-淀粉酶(EC3.2.1.1)催化淀粉、糖原等分子中α-1,4-糖苷键水解,生成糊精、麦芽寡糖、麦芽糖和葡萄糖等产物[1-2]。在碱性条件下,能高效完成上述催化反应的α-淀粉酶即为碱性淀粉酶,一般产自嗜碱微生物,稳定pH范围为9.0~11.0[3-6]。碱性淀粉酶广泛应用于纺织退浆、洗涤剂添加、淀粉加工、医药生产等领域[7-8]。
通过发酵法高效生产碱性淀粉酶已成为国内外研究者关注的热点。日本学者Horikoshi[9]首次报道了产自嗜碱芽孢杆菌A-40-2的碱性淀粉酶,此后通过自然环境筛选、物理化学诱变获得碱性淀粉酶生产菌株的研究陆续报道,但产酶水平有限。随着分子生物学技术的发展,构建高产重组菌成为提高碱性淀粉酶产量的重要途径。Murakami[10-11]等分别将来源于芽孢杆菌Bacillus halodurans 38C-2-1和MS-2-5的碱性淀粉酶基因在大肠杆菌Escherichia coli中表达,胞内酶活达10 U/mL和52 U/mL,分别较野生菌提高45倍和104倍。Wang[1]等将来源于嗜碱单胞菌Alkalimonas amylolytica的碱性淀粉酶(AmyK)基因在E.coli表达,胞外酶活达116.75 U/mL。然而,重组菌产酶的总体水平并不高,有待进一步提升。
与其他原核微生物表达系统相比,枯草芽孢杆菌Bacillus subtilis系统具有诸多优势:仅有单层细胞外膜,分泌信号肽效率高,可将外源蛋白质直接分泌至培养基,提高下游纯化效率[12];广泛用于多种工业酶的生产,发酵技术成熟[13];非致病性,被列为国际公认的安全微生物(GRAS);遗传背景清楚,质粒和噬菌体载体类型丰富[14];密码子偏好性不明显[15]。
作者所在课题组前期研究中,将AmyK成功于毕赤酵母Pichia pastoris[16]表达,发酵120 h,酶活达600 U/mL,但生产强度较低,仅为5 U/(mL·h)。为进一步缩短AmyK发酵生产的周期,通过筛选信号肽,将AmyK在B.subtilis中表达,并对重组菌的发酵培养基和条件进行了优化。
1 材料与方法
1.1菌株和质粒
B.subtilis WB600,E.coli JM109,pET-22b(+)-amyK[16],E.coli-B.subtilis穿梭质粒pMA0911-SPs,均为作者所在实验室保藏;克隆质粒pMD18-T-simple,购于TaKaRa(大连)生物工程有限公司。
1.2培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10;pH 7.0。
TB培养基(g/L):蛋白胨12,酵母粉24,甘油4,KH2PO42.32,K2HPO4·3H2O 16.43;pH 7.0。
1.3方法
1.3.1AmyK表达载体的构建与转化以pET-22b (+)-amyK(含AmyK基因编码序列)为模板,PCR扩增得到AmyK基因,引物见表1。扩增条件为:95℃预变性5 min,98℃变性10 s,55℃退火15 s,72℃延伸2 min,30个循环。将扩增得到的AmyK基因片段与pMD18-T-simple连接,转化E.coli感受态细胞JM109。涂布平板,37℃培养过夜,提取质粒。
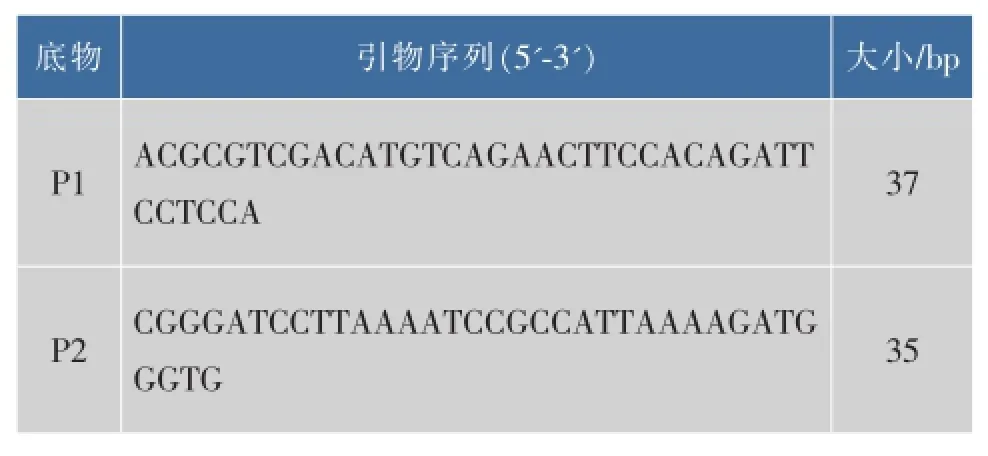
表1 引物序列Table 1 Sequences of primers
用Sal I和BamH I分别双酶切pMD18-T-simple/amyK和含有不同信号肽的E.coli-B.subtilis穿梭载体pMA0911-SPs,再用TaKaRa DNA Ligation Kit中的连接酶连接,连接过夜后转化E.coli感受态细胞JM109,通过菌落PCR验证筛选阳性克隆。挑选阳性克隆于含100 μg/mL氨苄青霉素的LB培养基中37℃培养过夜,提取质粒进行酶切验证及测序鉴定。序列测定由上海生工有限公司完成。采用化学转化法[17]转化重组质粒至B.subtilis WB600。在含有50 μg/mL卡那霉素(Km)平板上挑选阳性克隆,菌落PCR并酶切验证。构建成功的重组菌于-80℃甘油管保藏。
1.3.2重组质粒稳定性的测定
1)分离稳定性:挑取重组菌株单菌落,接种至5 mL不含Km的LB培养基中,于37℃培养12 h作为种子液,再按体积分数1%的接种量转种于另一LB培养基中培养24 h,即得传20代的菌液。将该菌液稀释至10-5~10-6,取100 μL涂布于LB平板上,待长出菌落后,从中挑取100个单菌落分别点种在无Km的LB平板和含Km的LB平板上,置于37℃培养12 h后统计平板上的单菌落数,作为传20代质粒分离稳定性的计算指标。如此每隔24 h按体积分数1%的接种量重新接种培养,直至传到100代,计算稳定性。
2)结构稳定性:分别取20代、60代、100代的菌液,提取质粒后用Sal I、BamH I双酶切,验证目的条带的存在。
详见文献[18]。
1.3.3AmyK的表达和检测取甘油管保藏菌株在含Km的固体LB平板上划线,于37℃恒温培养箱培养过夜,挑取活化后的单菌落接种至LB培养基培养,37℃、200 r/min条件下摇床培养12 h,以体积分数4%接种量接种至发酵培养基,同样条件下振荡培养72 h。取一定量发酵液,于4℃,12 000 r/min条件下离心10 min,取上清液(即粗酶液)测定AmyK酶活。
1.3.4淀粉酶活力测定碱性淀粉酶测定采用DNS法[19]。取0.5 mL可溶性淀粉,0.75 mL甘氨酸-氢氧化钠缓冲液(pH 9.5,20 mmol/L),50℃预热5 min后,加入0.1 mL适当稀释的粗酶液,50℃反应5 min。取1 mL反应液加入到1 mL DNS中,混匀,沸水浴15 min,冰浴冷却后定容至10 mL,540 nm下测定吸光值。根据标准曲线计算酶活。酶活单位的定义:碱性淀粉酶每分钟降解底物(可溶性淀粉)生成1 μmol还原糖(以葡萄糖计算)所需要的酶量为一个酶活力单位。
1.3.5菌体生物量的测定利用分光光度计检测经适当稀释的菌液在600 nm波长处的吸光度值,即OD600。
2 结果与分析
2.1产AmyK重组菌的构建与表达
参照方法1.3.1构建了分别含有信号肽ywbN、yncM、estA、yweA、amyX、nprE、vpr、yvgO的重组表达载体pMA0911M1、pMA0911J1、pMA0911V1、pMA 0911N1、pMA0911A1、pMA0911E1、pMA0911G1、pMA 0911L4。测序结果显示,AmyK基因序列完全正确。将重组表达载体分别转化B.subtilis WB600,构建重组菌株WB11M1、WB11J1、WB11V1、WB11N1、WB11A1、WB11E1、WB11G1、WB11L4,以不带有AmyK基因的空质粒pMA0911转化B. subtilis WB600,构成重组菌WB11作为空白对照菌株。不同重组菌于TB培养基37℃,200 r/min摇床培养72 h,结果见图1。由图1(a)可知,在信号肽ywbN的介导下,胞外胞内酶活最高,分别为146.86 U/mL、7.69 U/mL,分泌效率达95%,因此ywbN为AmyK分泌表达的最佳信号肽。为了进一步验证重组菌的发酵结果,对8株重组菌WB11M1、WB11J1、WB11V1、WB11N1、WB11A1、WB11E1、WB11G1、WB11L4和对照菌WB11的胞外上清液进行SDS-PAGE分析,结果见图1(b),只有WB11M1在60 kDa处有一条清晰的蛋白质条带,大小与AmyK相对分子质量相符合,与前面酶活测定结果一致。


图1 不同菌株胞内外酶活比较及胞外上清液SDS-PAGE分析Fig.1 AmyK production in recombinant strains and the SDS-PAGEanalysisofAmyKdistributionin culture supernatants
质粒稳定性分析显示,重组菌WB11M1连续传100代后,仍有80%细胞带有质粒,此外,酶切20代、60代、100代重组菌的质粒,目的条带均存在,说明pMA0911M1在重组菌中可稳定存在。
2.2重组菌WB11M1发酵条件优化
2.2.1碳源对重组菌生长和AmyK产量的影响按照碳源质量浓度相等的原则,将初始TB培养基中的甘油分别替换为1.2 g/dL的9种碳源(图2(a)),研究碳源种类对重组菌发酵的影响。以麦芽糖、木糖、可溶性淀粉、玉米淀粉、糊精为碳源时,菌体生长较好,OD600为20左右,发酵结束pH均为8以上。其他碳源条件下,重组菌OD600仅为10左右,发酵结束pH约为6,几乎不产AmyK。因此,碱性条件可能有利于重组菌产AmyK。糊精为最适产酶碳源,发酵72 h胞外酶活达295.52 U/mL,比初始培养基提高了101%。
在上述实验的基础上,优化糊精质量浓度提高AmyK产量(图2(b))。糊精质量浓度低于40 g/L时,菌体量和AmyK胞外酶活随糊精质量浓度的提高而增加。糊精初始质量浓度分别为40 g/L和32 g/ L时,OD600和AmyK胞外酶活达到最大值,分别为34.41,417.36 U/mL。因此,发酵培养基糊精的最佳质量浓度为32 g/L。发酵结束时,糊精初始质量浓度低于40 g/L的发酵液均呈明显碱性,而糊精初始质量浓度为44 g/L时,发酵液pH较接近7。糊精质量浓度过高引起发酵液pH的下降,可能是导致AmyK产量大幅下降的重要原因。
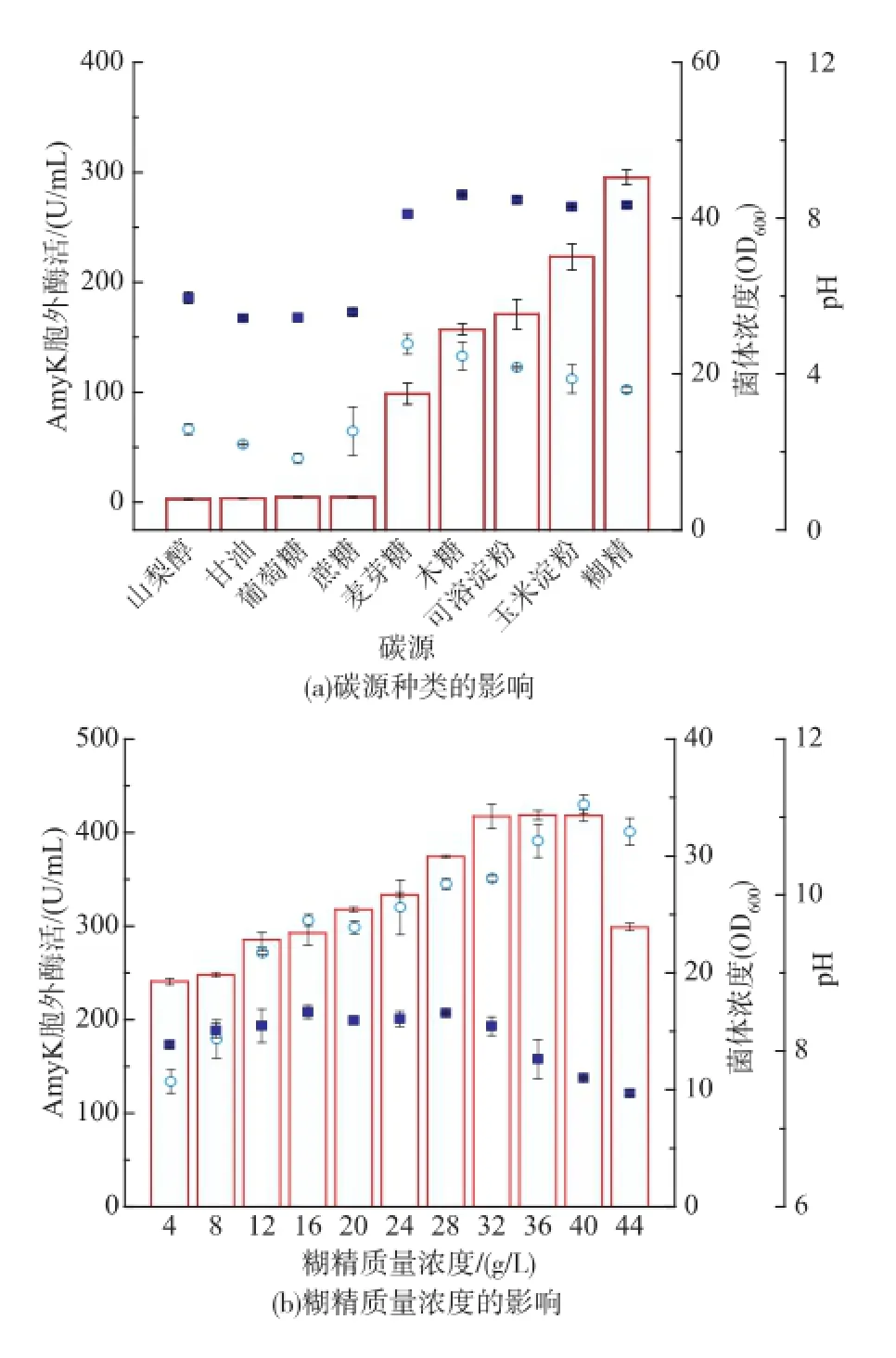
图2 碳源对菌体生长和产酶的影响Fig.2 Effect of carbon source on biomass,pH,and AmyK production
2.2.2氮源对重组菌生长和AmyK产量的影响以32 g/L的糊精为碳源,按照含氮质量浓度相等的原则,优化TB培养基中的氮源(图3(a))。重组菌对安琪酵母的利用效果最好,OD600达到52,蛋白胨、酵母粉其次,OD600为28.08。除以安琪酵母、玉米浆为氮源外,发酵结束pH为8左右。以蛋白胨、酵母粉为氮源,胞外AmyK酶活最高达390 U/mL。安琪酵母虽然适于菌体生长,但不能同时促进菌体产酶。以尿素、玉米浆为氮源时,菌体生长很差,酶活也很低。因此,蛋白胨、酵母粉为产AmyK最适氮源。保证蛋白胨、酵母粉质量的比例为1∶2,优化蛋白胨、酵母粉的质量浓度提高AmyK产量(图3 (b))。菌体量和AmyK酶活均随蛋白胨、酵母粉质量浓度的增加先增加后减小,当蛋白胨质量浓度20 g/L,酵母粉质量浓度40 g/L时,OD600最大达35.58;当蛋白胨质量浓度12 g/L,酵母粉质量浓度24 g/L时,胞外酶活最高达400 U/mL。发酵结束pH也随蛋白胨、酵母粉质量浓度的增加先升高后降低,当蛋白胨质量浓度8 g/L、酵母粉质量浓度16 g/ L时,pH最高8.6。因此,最适产酶氮源为蛋白胨质量浓度12 g/L,酵母粉质量浓度24 g/L。
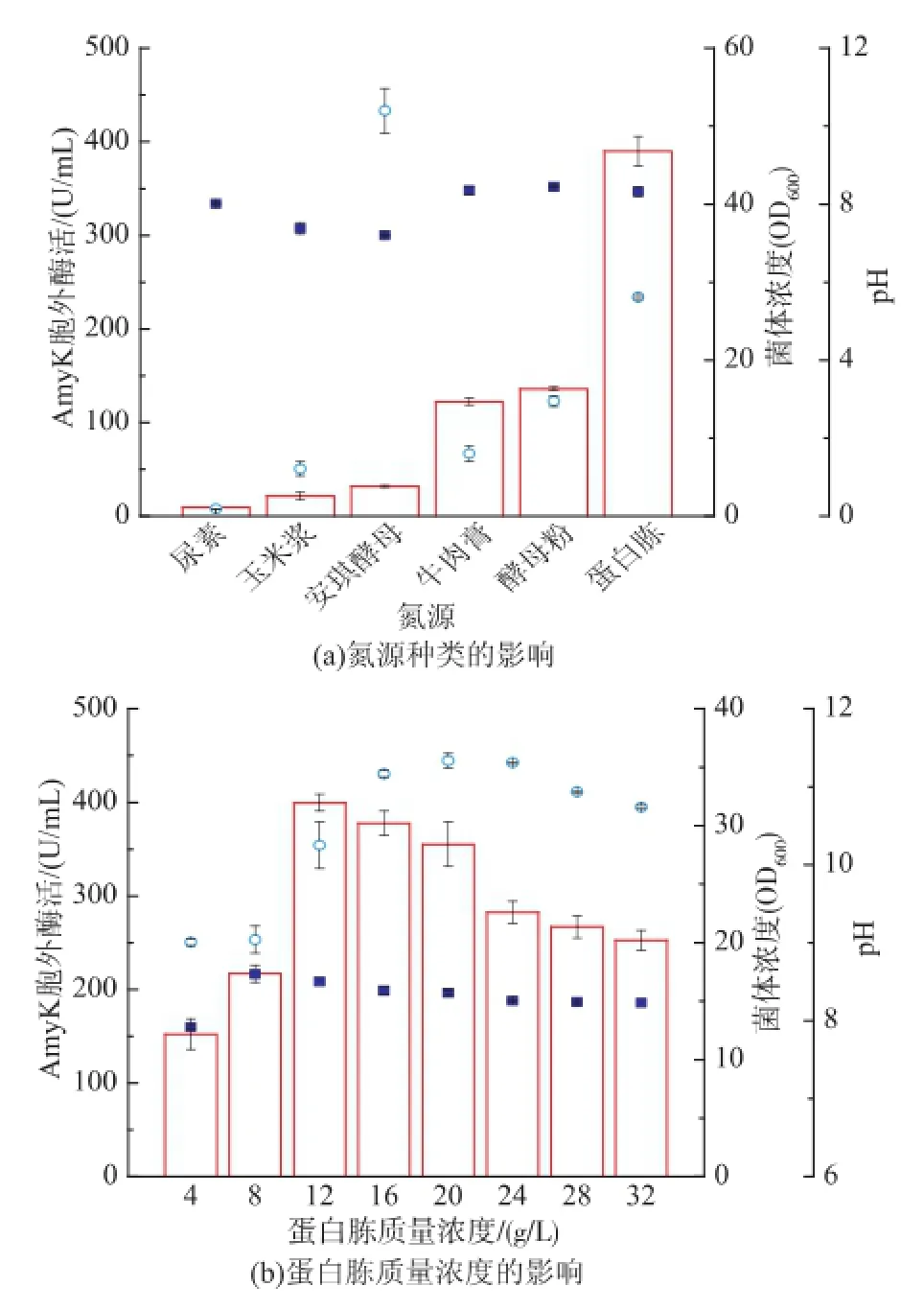
图3 氮源对菌体生长和产酶的影响Fig.3 Effect of nitrogen source on biomass,pH,and AmyK production
2.2.3碳酸钠对重组菌生长和AmyK产量的影响碳源种类优化结果表明,偏碱性的环境可能促进AmyK表达。因此,发酵过程中调控pH有望进一步提高AmyK的产量。目前,Na2CO3作为一种重要的pH调节剂已被广泛用于pH的调节[20-22]。预实验表明Na2CO3质量浓度高于0.6 g/dL时,发酵液pH高于9.3,因B.subtilis耐受碱能力差,生物量急剧下降而使AmyK产量很低(结果未显示)。因此,Na2CO3质量浓度选择0.1~0.6 g/dL,分别于发酵开始后12、18、24、30 h添加,结果见图4。于12 h添加Na2CO3,随着Na2CO3质量浓度增加,发酵结束pH先下降后缓慢上升,OD600无明显规律,添加Na2CO3未能提高AmyK产量。18 h添加效果同12 h。于24 h添加Na2CO3,随着Na2CO3质量浓度增加,发酵结束pH缓慢上升,OD600总体逐渐降低,Na2CO3质量浓度为0.6 g/dL时,OD600只有20左右;胞外AmyK酶活先增加后减小,Na2CO3质量浓度为0.2 g/dL时,胞外酶活最高达481.98 U/mL,较优化前提高15%。30 h添加效果同24 h,Na2CO3质量浓度为0.1 g/dL时,酶活最高达460.54 U/mL。根据发酵过程及结果发现,选择在菌体生长非常快的对数时期(12 h,18 h)添加Na2CO3、提高外部pH并不能提高AmyK的产量,而选择在菌体生长基本稳定的稳定期(24 h,30 h)添加Na2CO3却能有效提高AmyK的产量。
Manabe[21]等的研究也表明,外部pH上移可提高B.subtilis产淀粉酶。一般认为,其原因如下:在淀粉酶释放到培养基之前直接提高其折叠效率和/或稳定性;通过去质子及细胞壁丙氨酸缺失,增加细胞壁的负电性,间接稳定淀粉酶;膜结合丝氨酸蛋白酶HtrA、HtrB活力下降;外部pH上移激活或抑制了相关基因簇,由此引起的次级效应导致淀粉酶产量提高。


图4 碳酸钠浓度及添加时间对菌体生长和产酶的影响Fig.4 Effect of Na2CO3concentration and adding time on biomass,pH,and AmyK production
2.2.4接种量对重组菌生长和AmyK产量的影响
接种量直接决定接入发酵培养基的菌体量,因此对菌体生长有一定影响,进而会影响重组菌株的产酶量。研究中针对不同接种量对菌体生长和产酶的影响进行了探索,分析了接种量为体积分数2%、4%、8%、12%、16%时重组菌的发酵情况,结果见图5。随着接种量的增加,酶活先增加后减小,接种量为体积分数12%时,酶活最高达640.33 U/mL。
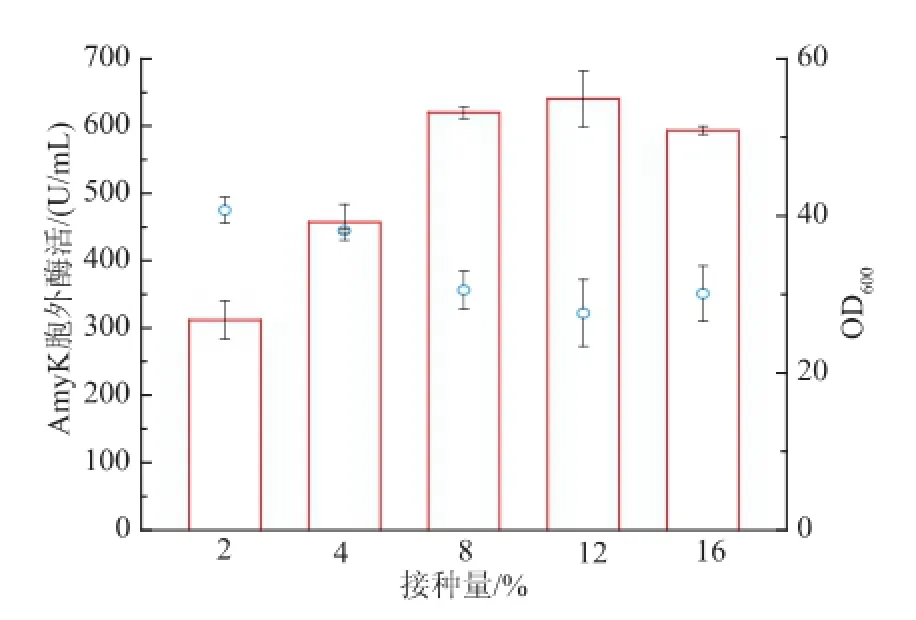
图5 接种量对菌体生长和产酶的影响Fig.5 Effect of inoculum size on biomass,and AmyK production
3 结语
碱性淀粉酶在碱性环境中可以保持稳定并高效催化降解淀粉,广泛应用于纺织退浆、洗涤剂添加、淀粉加工、医药生产等领域。不同的酶都有其分泌表达的最适信号肽,因此产酶重组枯草芽胞杆菌构建中对信号肽的选择应引起高度重视。此外,本课题组前期研究中将AmyK分别于E.coli和P. pastoris进行表达,前者酶活只有60 U/mL,后者发酵周期长达120 h[16]。因此,进行酶的异源表达时,宿主的选择对于达到高发酵水平和高生产强度尤为重要。研究中通过信号肽筛选,将来源于A. amylolytica的碱性淀粉酶基因在B.subtilis中成功实现胞外表达,并优化了发酵培养基成分和发酵液的pH。优化后碱性淀粉酶酶活最高达640.33 U/ mL,比优化前提高了336%,生产强度达到8.9 U/ (mL·h),比其在P.pastoris中提高了78%[16]。上述结果表明,B.subtilis是AmyK的理想表达宿主。此外,发酵过程中添加Na2CO3提高AmyK产量的策略,不仅为重组B.subtilis发酵罐上选择优化控制策略提供了有效依据,而且为其他酶类的发酵过程优化提供了重要参考。
[1]Wang N,Zhang Y H,Wang Q H,et al.Gene cloning and characterization of a novel alpha-amylase from alkaliphilic Alkalimonas amylolytica[J].Biotechnol J,2006,1(11):1258-1265.
[2]吴襟,彭平,沈文,等.嗜碱性芽胞杆菌碱性α淀粉酶的纯化和性质[J].中国生物化学与分子生物学报,2005,21(6):852-856. WU Jin,PENG Ping,SHEN Wen,et al.Purification and characterization of α-amylase from an alkaliphilic Bacillus sp.strain BG-CSN[J].Chin J Biochem Mol Biol,2005,21(6):852-856.(in Chinese)
[3]Burhan A,Nisa U,Gokhan C,et al.Enzymatic properties of a novel thermostable,thermophilic,alkaline and chelator resistantamylase from an alkaliphilic Bacillus sp.isolate ANT-6[J].Process Biochem,2003,38(10):1397-1403.
[4]Hagihara H,Igarashi K,Hayashi Y,et al.Novel alpha-amylase that is highly resistant to chelating reagents and chemical oxidants from the alkaliphilic Bacillus isolate KSM-K38[J].Appl Environ Microbiol,2001,67(4):1744-1750.
[5]Kuilderd H,Wu G.Applied technology-simultaneous desizing and scouring with enzymes-simultaneous fabric desizing and scouring,using alkaline alpha-amylase and an alkaline scouring enzyme,reduces water[J].AATCC Rev-Am Assoc Text Chem Color,2008,8(6):33-36.
[6]杨海泉,刘龙,李江华,等.碱性淀粉酶的发酵生产及其应用研究进展[J].生物工程学报,2012,28(4):432-439. YANG Haiquan,LIU Long,LI Jianghua,et al.Advances of alkaline amylase production and applications[J].Chin J Biotech,2012,28(4):432-439.(in Chinese)
[7]Hashim S O,Delgado O,Hatti-Kaul R,et al.Starch hydrolysing Bacillus halodurans isolates from a Kenyan soda lake[J]. Biotechnol Lett,2004,26(10):823-828.
[8]Malhotra R,Noorwez S M,Satyanarayana T.Production and partial characterization of thermostable and calcium-independent alpha-amylase of an extreme thermophile Bacillus thermooleovorans NP54[J].Lett Appl Microbiol,2000,31(5):378-384.
[9]Horikoshi K.Production of alkaline enzymes by alkalophilic microorganisms[J].Agri Biol Chem,1971,35(11):1783-1791.
[10]Murakami S,Nishimoto H,Toyama Y,et al.Purification and characterization of two alkaline,thermotolerant α-Amylases from Bacillus halodurans 38C-2-1 and expression of the cloned gene in Escherichia coli[J].Biosci Biotechnol Biochem,2007,71 (10):2393-2401.
[11]Murakami S,Nagasaki K,NishimotoH,etal.Purificationandcharacterizationof fivealkaline,thermotolerant,and maltotetraose-producing α-amylases from Bacillus halodurans MS-2-5,and production of recombinant enzymes in Escherichia coli[J].Enzyme Microb Technol,2008,43(4-5):321-328.
[12]Fu L L,Xu Z R,Li W F,et al.Protein secretion pathways in Bacillus subtilis:Implication for optimization of heterologous protein secretion[J].Biotechnol Adv,2007,25(1):1-12.
[13]Palva I.Molecular cloning of alpha-amylase gene from Bacillus amyloliquefaciens and its expression in B.subtilis[J].Gene,1982,19(1):81-87.
[14]Rey M W,Ramaiya P,Nelson B A,et al.Complete genome sequence of the industrial bacterium Bacillus licheniformis and comparisons with closely related Bacillus species[J].Genome Biol,2004,5(10):r77-12.
[15]Wong S L.Advances in the use of Bacillus Subtilis for the expression and secretion of heterologous proteins[J].Curr Opin Biotechnol,1995,6(5):517-522.
[16]Yang H Q,Liu L,Shin Hyun-dong,et al.Comparative analysis of heterologous expression,biochemical characterization optimal production of an alkaline α-amylase from alkaliphilic Alkalimonas amylolytica in Escherichia coli and Pichia pastoris[J]. Biotechnol Prog,2013,29(1):39-47.
[17]Reilly B E,Spizizen J.Bacteriophage deoxyribonucleate infection of competent Bacillus subtilis[J].J Bacteriol,1965,89:782-790.
[18]蒋岚,杨永华,龚毅,等.稀有密码子对proUK基因在大肠杆菌中高表达的影响[J].生物工程学报,1999,15(1):64-67. JIANG Lan,YANG Yonghua,GONG Yi,et al.The rare coden effects the overexpression of Human proUK Gene in Escherichia coli[J].Chin J Biotech,1999,15(1):64-67.(in Chinese)
[19]Fuwa H.A new method for microdetermination of amylase activity by the use of amylose as the substrate[J].J Biochem,1954,41:583-603.
[20]Galyuk E N,Lando D Y,Egorova V P,et al.Na2CO3influence on DNA double helix stability:Strong anion destabilizing effect[J]. J Biomol Struct Dyn,2003,20(6):801-809.
[21]Manabe K,Kageyama Y,Tohata M,et al.High external pH enables more efficient secretion of alkaline alpha-amylase AmyK38 by Bacillus subtilis[J].Microb Cell Fact,2012(11):74.
[22]Whang L M,Yang K H,Yang Y F,et al.Microbial ecology and performance of ammonia oxidizing bacteria(AOB)in biological processes treating petrochemical wastewater with high strength of ammonia:effect of Na2CO3addition[J].Water Sci Technol,2009,59(2):223-231.
Construction and Fermentation Optimization of a Recombinant Bacillus subtilis Producing Alkaline Amylase
WANG Jingli1,LIU Song1,DU Guocheng1,2,CHEN Jian1,2
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Alkaline amylase,which could efficiently hydrolyze starch under alkaline conditions,has been widely used in textile desizing field,detergent industry,and pharmaceutical production.In this study,alkaline amylase from Alkalimonas amylolytica(AmyK)was screened through signal peptide and expressed in Bacillus subtilis WB600.The fermentation condition of the recombinant strain was then optimized.The extracellular AmyK activity of the recombinant B.subtilis could reach a maximal level of 146.86 U/mL with 51 h fermentation mediated by ywbN signal peptide.There was a protein band observed in the culture supernatant which was consistent for the theoretical molecular weight of 60 kDa for AmyK.The fermentation medium was optimize via a single factor test and determined as dextrin of 32 g/L,tryptone of 12 g/L,yeast extract of 24 g/L,KH2PO4of 2.32 g/L,andK2HPO4·3H2O of 16.43 g/L with pH regulated by 0.2%w/v Na2CO3after 24 h fermentation.The AmyK activity reached to 640.33 U/mL after 72 h,increasing by 336%when compared with the initial medium,which was the highest yield of alkaline amylase for the reported recombinant B. subtilis strains.This study provided a experimental support for the commercial production of AmyK from fermentation.
alkalineamylase,signalpeptide,recombinantBacillus subtilis,fermentationoptimization,sodium carbonate
Q 813
A
1673—1689(2016)03—0296—07
2014-11-21
国家863计划项目(2012AA022202,2011AA100905);教育部长江学者和创新团队发展计划项目(IRT1135)。
堵国成(1965—),男,江苏常州人,工学博士,教授,博士研究生导师,主要从事发酵过程优化与控制、酶工程与技术、代谢工程技术的研究。E-mail:gcdu@jiangnan.edu.cn

