KLF7联合脂肪源性干细胞对小鼠坐骨神经缺损后轴突再生的影响
李文媛,王 莹,李智刚,闫 哲,杨春壮,李凯军,赵 微
KLF7联合脂肪源性干细胞对小鼠坐骨神经缺损后轴突再生的影响
李文媛1,王莹1,李智刚2,闫哲1,杨春壮1,李凯军1,赵微1
目的探讨核转录因子KLF7与脂肪源性干细胞(ADSC)联合应用对小鼠脱细胞同种异体神经支架(ANA)移植坐骨神经缺损后轴突再生和功能恢复的影响。方法成年C57BL/6小鼠随机分为脱细胞神经支架(ANA)组、ADSC组和KLF7+ADSC组,每组10只。坐骨神经功能指数(SFI)和电生理方法检测神经运动功能的恢复,Western bolt检测神经移植体内KLF7、TrkA和TrkB的蛋白表达。NF200免疫荧光法检测神经支架中轴突再生,并示踪PKH26标记的移植ADSC。结果与ADSC组比较,KLF7+ADSC组神经移植体内KLF7、TrkA和TrkB蛋白表达明显增高,NF200表达增强,PKH-26标记的ADSC数量显著增高(P<0.05)。与ANA组比较,ADSC组和KLF7+ADSC组电生理波幅增高、神经传导速度增快、延迟期缩短,SFI功能指数增高,其中KLF7+ADSC组神经恢复作用显著优于ADSC组(P<0.05)。结论KLF7联合ADSC移植对小鼠ANA修复坐骨神经缺损后轴突再生和功能恢复的作用优于ADSC组,其机制可能与KLF7高表达促进神经移植体内TrkA和TrkB表达,进而促进移植的ADSC存活有关。
KLF7;脂肪源性干细胞;脱细胞异体神经;TrkA;TrkB
由各种原因所导致的周围神经损伤为临床常见病,严重影响着人类的健康。近年来发现转录因子为中枢神经系统损伤后许多病理生理改变提供广泛的神经保护和治疗作用[1]。其中核转录因子KLF7(Krüppel-like Factor 7,KLF7)能够调控多种细胞的发育、增殖和分化[2]。KLF7基因敲除可导致中枢神经、视网膜和嗅觉神经损伤后轴突再生障碍[3,4],转录激活KLF7能够促进成人的皮质脊髓束轴突再生[5]。有研究表明KLF7还能够显著促进神经营养因子高亲和力受体酪氨酸激酶受体A(Tyrosine Kinase Receptor A,TrkA)和酪氨酸激酶受体B(Tyrosine Kinase Receptor B,TrkB)等表达[6],但其在周围神经再生的作用及其机制报道较少。
我们前期研究[7]已证实同种异体脱细胞异体神经(acellular nerve allograft,ANA)能够有效桥接坐骨神经缺损,但单独使用ANA运动功能恢复效果并不理想。本研究拟将脂肪源性干细胞(Adipose-derived stem cell,ADSC)作为种子细胞植入ANA桥接坐骨神经缺损,并联合腺相关病毒2(adeno-associated virus 2,AAV2)介导将KLF7基因转染至ANA治疗,探讨KLF7联合ADSC对坐骨神经缺损后轴突再生和功能恢复的影响,为坐骨神经损伤提供新的治疗方法。
1 材料和方法
1.1细胞培养参照前期研究方法[8]取小鼠腹部脂肪组织进行ADSC细胞分离、培养及传代,2 w后茜草素红染色鉴定ADSC向成骨诱导的细胞,经细胞鉴定后取第4代ADSC行PKH26(Sigma公司,美国)染色标记[7],进行体内移植实验。
1.2动物模型30只6~8 w C57BL/6小鼠(雄性15 只,雌性15 只),由中国医科大学实验动物中心提供,体质量18~22 g,按体质量随机分为:(1)ANA组:采用化学萃取脱细胞方法[7,8]制备CD1小鼠ANA,注入100 μl PBS于ANA,桥接长5 mm坐骨神经两断端间的缺损,n=10;(2)ADSC组:注入等剂量ADSC(1×106个/100 μl)于ANA桥接坐骨神经缺损,n=10;(3)KLF7+ADSC组:同ADSC组方法进行ANA桥接后,ANA给予微量注射器注射2 μl AAV2-KLF7(1×1011病毒颗粒,Vector BioLabs公司,美国),n=10。3组术后28 d麻醉取材。
1.3坐骨神经功能指数(Sciatic functional index,SFI)参照前期研究方法行SFI检测[6],术后28 d,制备一个塑料通道(8.5 cm宽,50 cm长),底部放置一张70 g白纸,黑色墨水蘸在小鼠双侧后足从通道一端行走至另一端,每个后足印在纸面3~4个足印,检测足趾宽度(TS)、足趾长度(PL)及中间足趾宽度(ITS)。SFI=-38.3[(EPL-NPL)/NPL]+109.5[(ETS-NTS)/NTS]+13.3[(EIT-NIT)/NIT]-8.8。
1.4电生理检测采用经颅磁刺激MEP(transcranial magnetic motor-evoked potentials,tcMMEP)方法[1],应用Magstim Model 200 磁刺激器(Magstim 公司,英国)和诱发电位仪(NIHON KOHDEN公司,日本)经颅磁刺激运动诱发电位观察小鼠坐骨神经损伤后发生神经传导潜伏期、传导速度及波幅改变,将电磁线圈置于颅骨激活皮质下组织诱发tcMMEP反应,探查电极置于腓肠肌肌腹,参考电极插入肌腱,接地电极插入尾巴。每只小鼠每侧均检测3次,每次间隔1 min,结果取平均值。
1.5Western blotting检测术后28 d,小鼠麻醉取ANA冲洗,剥离硬膜放置干冰保存,电泳分离蛋白样品(20 μg)后转膜、封闭,加入一抗:兔抗KLF7抗体(1∶200,sigma公司,美国)、兔抗TrkA抗体(1∶200,sigma公司,美国)和兔抗TrkB抗体(1∶200,sigma公司,美国),4 ℃过夜,辣根过氧化物酶标记种属特异性二抗(1∶5000)孵育1 h,使用增强化学发光检测系统(GE Healthcare公司,英国)观察蛋白印迹。
1.6免疫荧光组化染色将快速分离的ANA置于含4%多聚甲醛固定,30%蔗糖脱水,冰冻切片,常规免疫组化染色,一抗为兔抗NF200(1∶200,sigma公司,美国),二抗为羊抗兔FITC(1∶200,sigma公司,美国),荧光显微镜下观察并同时示踪PKH26标记的ADSC。每张切片400倍镜下随机选取4个视野检测光密度(IOD)值。
2 结 果
2.1ADSC培养与分化原代培养ADSC 8 d后形成的细胞群落较为密集,ADSC呈多角形或梭形伸展,有铺路石状特征。ADSC分化诱导成骨28 d后,可见分化细胞内的钙沉积茜素红染色 (见图1)。
2.2Western bolt结果KLF7+ADSC组和ADSC组ANA中TrkA和TrkB蛋白表达较ANA组显著增高,其中联合组TrkA和TrkB蛋白表达高于ADSC对照组。ANA组和ADSC组KLF7蛋白表达极少,而KLF7+ADSC组KLF7表达显著增高(KLF7:F2,12=125.9,P<0.001;TrkA:F2,12=85.15,P<0.001;TrkB:F2,12=77.10,P<0.001)(见图2)。
2.3免疫荧光染色观察荧光显微镜下可见KLF7+ADSC组和ADSC组在ANA中段有PKH26标记的ADSC,而KLF7+ADSC组PKH26阳性表达显著高于ADSC组 (t=3.56,P<0.05)。免疫荧光法染色NF200检测神经支架中段轴突生成情况,与ADSC组比较,KLF7+ADSC组NF200表达显著增加(t=21.75,P<0.001)(见图3)。
2.4SFI检测结果术后28 d,与ANA组比较,ADSC组和KLF7+ADSC组SFI指数显著增高,其中KLF7+ADSC组SFI指数高于ADSC组(F2,27=27.82,P<0.001)(见图4)。
2.5神经电生理检测与ANA组比较,ADSC组和KLF7+ADSC组神经传导速度及波幅显著增加,而延迟期缩短,其中联合组改善神经电生理参数优于ADSC组 (神经传导速度:F2,12=57.11,P<0.05;延迟期:F2,12=19.24,P<0.05;波幅:F2,12=22.76,P<0.05)(见表1)。

表1 各组神经电生理参数检测
*与ANA组比较P<0.05;#与ADSC组比较P<0.05

图1A:原代培养ADSC 8 d后呈铺路石状;B:ADSC分化诱导成骨,细胞内的钙沉积茜素红染色

图2Western bolt实验检测各组再生神经中KLF7、TrkA和TrkB 蛋白相对表达*P<0.05,**P<0.01,***P<0.001
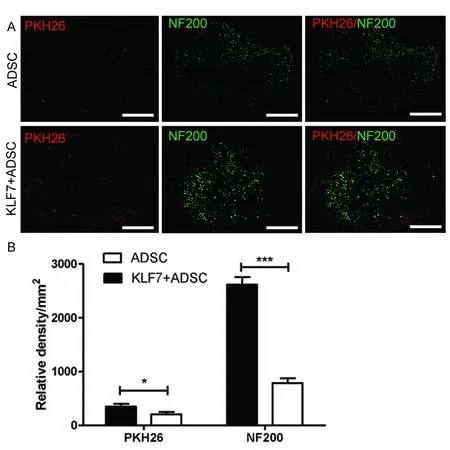
图3术后4 w ADSC组和KLF7+ADSC组神经移植体中段PKH26和NF200免疫组化荧光染色(A),PKH26和NF200的IOD值(B),标尺=100 μm,n=10
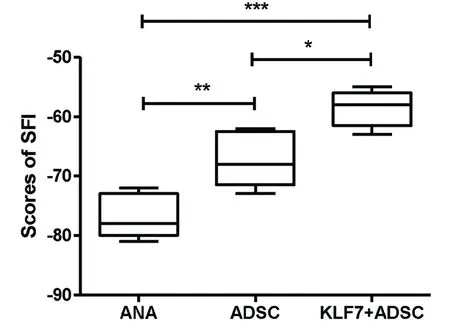
图4坐骨神经功能指数实验(n=10),*P<0.05,**P<0.01,***P<0.001
3 讨 论
目前发现近端周围神经病变或完全横断的预后普遍较差,运动功能恢复缓慢。其中主要原因是适宜神经生长的微环境缺乏,轴突生长底物和神经营养因子减少及受损轴突内在生长速度太慢,导致再生轴突需较长时间连接远端失神经支配的神经、不能重新支配靶组织,其功能恢复并不理想[9]。
我们前期研究发现[7,8]ANA由于脱去了周围神经的细胞成分,保存了神经天然结构,具有较好的组织相容性,能够为神经缺损提供良好的神经生长微环境。而种子细胞ADSC可合成和分泌大量神经营养因子,如神经生长因子、血管内皮生长因子等,这些促进神经生长的因子表达变化提供轴突生长的营养。本研究电生理检测结果也再次证实ADSC能够促进ANA桥接神经缺损后功能恢复,但SFI指数结果表明ADSC组神经功能恢复效果并不尽如人意,尽管其SFI指数有增高趋势,大量研究证实[10~13]联合治疗能够克服多种抑制神经轴突再生的因素,较单一治疗效果更为明显。
Krüppel like Factor(KLF)家族[14]是一类具有锌指结构的转录因子家族,其典型结构特征是在其羧基端具有3个C2H2锌指结构。KLF家族广泛参与细胞增殖、凋亡、分化以及胚胎发育等多个生命活动的调控。其中,核转录因子KLF7[2~4]在中枢和周围神经系统中广泛存在,其结构与其家族一样,含有一个DNA结合结构域和一个激活结构域,其DNA结合结构域位于C末端,通过羧基端三个连续锌指构成的保守结构域结合靶基因启动子内富含GC序列以调控其转录。近几年研究表明[4~6]KLF7调控多种细胞的发育、增殖和分化,对中枢神经系统轴突再生、髓鞘形成和神经胶质细胞的分化发挥重要作用。本研究结果证实术后4 w与ADSC组比较,联合组KLF7、TrkA和TrkB蛋白在神经支架内表达显著增高,证实KLF7高表达能够有效激活TrkA和TrkB细胞信号通路,这与以往研究结果相一致[6]。
另外本研究还发现联合组ANA中段PKH26标记阳性细胞个数显著高于ADSC组,而且NF200标记的轴突数量也显著高于ADSC组,因此我们推测KLF7可能通过激活TrkA和TrkB细胞信号通路,TrkA和TrkB是神经营养因子的高亲和力受体,通过与脑源性神经营养因子或神经生长因子特异性配体结合[15],促进移植的ADSC增殖和存活,进而促进轴突的再生。研究还发现与ANA组相比,ADSC组和KLF7+ADSC组显著改善电生理参数,说明ADSC组和联合组均能够促进坐骨神经损伤后功能恢复,但KLF7联合ADSC治疗效果明显优于ADSC组,其SFI指数也高于ANA组和ADSC组,证实了KLF7联合ADSC能够协同促进神经功能恢复。
综上所述,本研究探讨联合应用KLF7和ADSC治疗坐骨神经缺损,证实了联合治疗能够促进小鼠ANA移植后轴突再生和功能恢复,其机制可能与KLF7激活TrkA和TrkB细胞信号通路,促进移植的ADSC的存活有关。
[1]Zou Y,Chiu H,Zinovyeva A,et al. Developmental decline in neuronal regeneration by the progressive change of two intrinsic timers[J]. Science,2013,340(6130):372-376.
[2]Zhang Z,Wang H,Sun Y,et al. Klf7 modulates the differentiation and proliferation of chicken preadipocyte[J]. Acta Biochim Biophys Sin (Shanghai),2013,45(4):280-288.
[3]Laub F,Dragomir C,Ramirez F. Mice without transcription factor KLF7 provide new insight into olfactory bulb development[J]. Brain Res,2006,1103(1):108-113.
[4]Laub F,Lei L,Sumiyoshi H,et al. Transcription factor KLF7 is important for neuronal morphogenesis in selected regions of the nervous system[J]. Mol Cell Biol,2005,25(13):5699-5711.
[5]Blackmore MG,Wang Z,Lerch JK,et al. Kruppel-like Factor 7 engineered for transcriptional activation promotes axon regeneration in the adult corticospinal tract[J]. Proc Natl Acad Sci USA,2012,109(19):7517-7522.
[6]Lei L,Zhou J,Lin L,et al. Brn3a and Klf7 cooperate to control TrkA expression in sensory neurons[J]. Dev Biol,2006,300(2):758-769.
[7]Wang Y,Jia H,Li WY,et al. Synergistic effects of bone mesenchymal stem cells and chondroitinase ABC on nerve regeneration after acellular nerve allograft in rats[J]. Cell Mol Neurobiol,2012,32(3):361-371.
[8]Liu G,Cheng Y,Guo S,et al. Transplantation of adipose-derived stem cells for peripheral nerve repair[J]. Int J Mol Med,2011,28(4):565-572.
[9]Wang W,Itoh S,Takakuda K. Comparative study of the efficacy of decellularization treatment of allogenic and xenogeneic nerves as nerve conduits[J]. J Biomed Mater Res A,2016,2(28):445-454.
[10]Jia H,Wang Y,Tong XJ,et al. Sciatic nerve repair by acellular nerve xenografts implanted with ADSC in rats xenograft combined with ADSC[J]. Synapse,2012,66(3):256-269.
[11]Jaatinen L,Salemi S,Miettinen S,et al. The combination of electric current and copper promotes neuronal differentiation of adipose-derived stem cells[J]. Ann Biomed Eng,2015,43(4):1014-1023.
[12]Georgiou M,Golding JP,Loughlin AJ,et al. Engineered neural tissue with aligned,differentiated adipose-derived stem cells promotes peripheral nerve regeneration across a critical sized defect in rat sciatic nerve[J]. Biomaterials,2015,37(3):242-251.
[13]Mohammadi R,Mahmoodzadeh S. Combination of local transplantation of in vitro bone-marrow stromal cells and pulsed electromagnetic fields accelerate functional recovery of transected sciatic nerve regeneration:A novel approach in transected nerve repair[J]. Curr Neurovasc Res,2015,12(3):222-231.
[14]Pei J,Grishin NV. C2H2 zinc finger proteins of the SP/KLF,Wilms tumor,EGR,Huckebein,and Klumpfuss families in metazoans and beyond[J]. Gene,2015,573(1):91-99.
[15]王莹,李文媛,李智刚,等. 电针联合脂肪源性干细胞移植对脑缺血/再灌注大鼠BDNF及其受体TrkB表达的影响[J]. 中华中医药学刊,2012,30(10):2273-2275.
Effects of KLF7 and ADSC transplantation on expression of BDNF and its receptor TrkB after sciatic nerve injury in mice
LIWenyuan,WANGYing,LIZhigang,etal.
(DepartmentofAnatomy,MudanjiangMedicalCollege,Mudanjiang157011,China)
ObjectiveTo study the effect of KLF7 and adipose-derived stem cell (ADSC) transplantation on expression of axonal regeneration and function recovery after acellular nerve allograft (ANA)repair of the sciatic nerve gap in mice. MethodsAdult C57BL/6 mice were randomly divided into ANA group,ADSC group and KLF7+ADSC group. The sciatic functions index (SFI) and electrophysiology were used to evaluate functional recovery. KLF7,TrkA and TrkB protein were evaluated by Western bolt,the protein expression of NF200 and the fluorescence signal of ADSC labeled with PKH-26 in the nerve graft was observed by using immunofluorescence. ResultsCompared with ANA group,the expression of KLF7,TrkA,TrkB,NF200 and PKH-26 labeled ADSC in KLF7+ADSC group were increased (P<0.05). Compared with ANA group,nerve conduction velocity,wave amplitude and the SFI score were significantly increased in ADSC group and KLF7+ADSC group (P<0.05),however,incubation period were significantly decreased in two treatment groups (P<0.05),and the effect of KLF7+ADSC group was more powerful than ADSC group (P<0.05). ConclusionThe combined KLF7 and ADSC transplantation treatment promoted axon regeneration and function recovery much significantly than ADSC treatment,which may be related to KLF7 upregulating TrkA and TrkB expression in the ANA,and promoting ADSC survival.
KLF7;Adipose-derived stem cell;Acellular nerve allograft;TrkA;TrkB
1003-2754(2016)07-0580-04
2016-01-15;
2016-04-16
国家自然科学基金(No. 81371362);黑龙江省自然科学基金项目(No. H201491);黑龙江省卫生计生委立项科研课题(No. 2014-211);牡丹江医学院科学技术研究项目(No. 2s201310)
(1.牡丹江医学院解剖学教研室,黑龙江 牡丹江 157011;2.牡丹江医学院红旗医院普外科,黑龙江 牡丹江 157011)
王莹,E-mail:yingwang770224@163.com
R496
A

