小鼠睾丸不同阶段生精上皮细胞的发育形态学研究
吴枫王行明
(1.中国人民解放军疾病预防控制所 北京 100071;2.中南大学生殖与干细胞研究所 湖南长沙 410078)
小鼠睾丸不同阶段生精上皮细胞的发育形态学研究
吴枫1*王行明2
(1.中国人民解放军疾病预防控制所 北京 100071;2.中南大学生殖与干细胞研究所 湖南长沙 410078)
目的:研究小鼠生精上皮各类细胞发育过程中形体学特征以及异常发育的生精细胞形态 方法: PAS染色正常成年小鼠睾丸,通过光学显微镜观察每种上皮细胞的形态学特征。结果:小鼠生精上皮分为Stage I-XII不同阶段,在精子细胞分化、分裂的同时呈现出动态变化,生精上皮中的精子细胞包括精原细胞、减数分裂间期细胞(L、Z、P、D)、次级精母细胞、圆形精子细胞、长形精子细胞。每种细胞都具有明显形态学特征。结论:根据生精上皮细胞的形态特征可以判断小鼠不同类型精子发育是否正常,对于利用小鼠动物模型来研究生殖系统功能的研究有重要意义。
生精上皮 PAS染色 形态特征
精子细胞是由睾丸内原始生精细胞连续的有丝分裂和两次减数分裂而成,接着精子细胞发生形态学的变化最终形成成熟的精子。精子发生过程中生精上皮细胞的形态不断发生变化,通过显微镜观察睾丸组织某个特定发育阶段的生精上皮可以发现含有不同类型的生精细胞。其中原始精原细胞分布在靠近基底膜(basal compartment)的远腔端,而减数分裂细胞、减数分裂后期细胞分布随着发育的进度越来越靠近生精上皮的近腔端(adluminal compartment)[1]。本文以小鼠生精上皮作为研究对象,通过不同的形态学特征可以将其分为12个阶段,每个阶段的生精细胞都具有典型的形态性特征。通过bouin氏固定液固定睾丸组织能够清楚的观察核内染色体的形态特征,而通过PAS(过碘酸雪夫氏染色)可以标记发育过程中的顶体,能够区分每个阶段的生精上皮中的圆形精子细胞。
1 材料与方法
1.1 材料
本研究使用的成年C57BL/6实验小鼠购自赛业生物科技有限公司。体重35g-50g,全部为正常雄性野生型小鼠。
1.2 方法
主要仪器和试剂光学显微镜(Olympus BX51,日本) PAS试剂盒(Promega)。组织形态学观察睾丸用Bouin's液固定,常规脱水、透明、浸蜡、石蜡包埋,制成5 μm厚切片,进行常规PA S染色(Periodic Acid-Schiff),并用苏木素复染,以分析完整的曲细精管形态,中性树胶封片,光镜下观察。
2 结果
2.1 I (图A)
Stage I中的Step1是由次级精母细胞(secondary spermatocyte)分裂而来,相比次级精母细胞体积小30%-40%,早期的精子细胞核分布不规律、核染色深,不具备可区分的形态学特征。Step1结束后出现早期顶体颗粒(proacrosomal granules)。Step13的头部形态以及核凝集程度在Stage I呈现多样性。在同一个Stage I 能看到未凝集的精子细胞,然而Step13头部在形态上已经接近于释放出的精子,只是缺少随后的修饰。这一时期的粗线期精母细胞的核内大部分由“粗条形”和“细绳状”的染色体组成,染色体之间几乎没有空隙,细胞与细胞核大体呈圆形。
2.2 II-III (图B)
Step3内高尔基器和精子细胞核之间出现的含有顶体颗粒的“小圆圈”区域是这个时相的标志(图B,箭头)。通常顶体颗粒染色较浅。Step14头部变宽缩短,越来越接近成熟的精子头部形态,头部顶端“弯钩”特征明显(图B 白箭头)。在II时相末期,A型精原细胞分裂形成中间型精原细胞,核近似卵圆形且染色均一。
2.3 IV-V (图C-D)
Stage IV这一阶段典型特征是顶体颗粒开始贴着核膜慢慢展平(箭头)。顶体边缘与核中心形成40°之内的范围都是Stage IV。Step15在形态上更加接近精子头部,但是Step14、Step15和Step16在PAS染色很难区分,电镜可以通过观察线粒体鞘的形成判断精子发生的阶段。Stage V末期发生中间型精原细胞向B型精原细胞的分裂,二者在形态上相似。但是B型精原细胞比中间型精原细胞染色质多,与基底膜连接位置较平。这个时相的粗线期精母细胞加快变大并且出现性泡。Step5精子细胞沿核膜的顶体能在PAS染色下清晰可见,且与核中心形成的角度不超过95。
2.4 VI (图E)
在Stage VI晚期,大部分B型精原细胞分化成为细线前期初级精母细胞,B型精原细胞沿着核包膜呈现出染色质“斑块”,而PI在胞体和胞核都较小,这也是二者的主要区别。Step6精子细胞的顶体继续沿核周伸展,大约覆盖核周三分之一(95-120)。StageVI时期的粗线期初级精母细胞与前面阶段不同,可以刚好清楚的发现性颗粒(sex vesicle)(白箭头),其形态呈现圆形或卵圆形,核内“板块”染色有轻有重,染色体间的空隙增大。PAS染色发现Step15与前面两个阶段的Step15无明显差异。
2.5 VII (图F)
PI要比B型精母细胞小,核更圆。PI的核膜周分布着“圆圈状”的染色体,染色体厚度不均一。在VII后阶段PI向细线期精母细胞(L)转化,从基底膜向近腔端位移。Step7顶体延伸的角度超过120-150,核位于细胞中心处。而Step16更加靠近官腔。StageVII 的P在体积上明显变大且染色体形态不规则,性颗粒和高尔基复合器变得明显且增大。
2.6 VIII (图G)
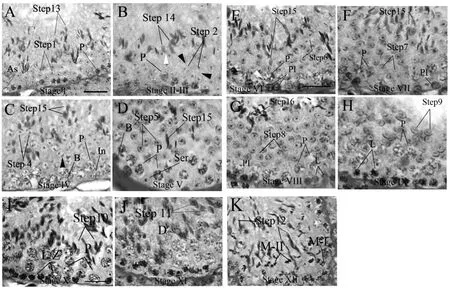
图A-K 分别代表小鼠不同的生精上皮阶段Stage I-XII,As, A型精原干细胞;B,B型精原干细胞;PI,减数分裂细线前期细胞;L,细线期初级精母细胞;Z,偶线期初级精母细胞;P,粗线期初级精母细胞;D,双线期初级精母细胞;M-I,减数分裂期细胞I;M-II,减数分裂期细胞II;2?,次级精母细胞;Step1-16,1-16阶段的单倍体精子细胞,Ser,支持细胞;Bar,20 μm。
StageVII晚期,就发生了PI向L细胞转化。PI核内成团的染色体逐渐消失,有“斑点”状的核物质出现,最后“斑点”消失后细线状的染色体出现在胞核内。这个阶段的粗线期精母细胞体积上继续增大,核内染色体染色比VII稍重。Step8精子细胞顶体与胞核表面接触,顶体延伸达到170°到180°胞核和顶体对向生精上皮的基底膜。高尔基复合体移动到细胞尾端,此时的Step8细胞开始慢慢延长,胞核慢慢成锥形移向末端。很多Step16精子细胞在Stage VIII早期释放到生精管墙内。
2.7 IX-X (图H、I)
Stage IX中Step9胞核顶端慢慢变平,细胞整体延长。此阶段L中出现几个“小斑点”,而P中核内物质染色较轻。Stage X的标志性特征是Step10头部腹侧“弯钩”,PAS染色发现Step10头部“腹角”(ventral angle)更加明显。这时期的P相比胞核和性颗粒比染色轻,体积持续增大。此外L正向Z发生转变,染色体变厚变粗,胞体和胞核呈现圆形。
2.9 XI-XII (图J-K)
Step11头部背角在StageX-XI过程中形成,且Step11染色加深,形态上比Step10长。D体积大与前面阶段的初级精母细胞,高尔基符合体明显,胞核不规则染色。Stage X中2°要比I实相的Step1在体积上大三分之一。在这个实相中,减数分裂实相细胞(M)所占比例大, M-II比M-I体积上大60%到70%。此外,Z到P的转变,由于二者体积性太相似,无法从形态上区分。Step12的核轮廓长且细,顶体染色后呈现出“钝角”。
3 讨论
本文同过系统描述小鼠生精上皮细胞的形态特征以及它们在发育过程中的变化,更加清晰的展示出生精上皮细胞的分化过程,有助于清楚辨别不同生精上皮细胞的发育阶段。传统的方法是在普通HE染色或苏木精复染标本上对精子发生周期进行简单划分的方法。赵杰[2]等人采用PAS染色法与普通HE染色法相对照,对比观察小鼠睾丸各级生精上皮在精子发生不同时期的形态学变化特点。低倍镜下,通过顶体的染色可以清楚的分辨出不同阶段的生精上皮(StageI-XII),高倍镜下,顶体特征更加明显如“点状”StageII-III,“平状”Stage IV,“弯曲状”StageVI,在研究中这些分子标志物的使用有利于分析突变小鼠精子发生功能是否异常。此外,除了可以用形态学的方式辨别生精上皮细胞的类型,很多生精细胞表达特异性的结构蛋白。例如Pou5f1/Oct4等都可以作为生精上皮精原细胞的标记分子[3]。SCP3是生殖细胞减数分裂中联会复合体形成必需的组成,可以用来标记减数分裂[4]。部分SP-10特异性表达在精子细胞的顶体,通过免疫显色反应发现Sp-10清晰的表达在顶体[5]。本研究细描述了每一类生精上皮细胞的形态学特征,为今后小鼠生殖系统基因的相关功能研究提供形态学基础。
[1]De Kretser D M,Loveland K L, Meinhardt A,et al. Spermatogenesis.[J].Hum Reprod,1998,13 Suppl 1:1-8
[2]赵洁,侯武刚,张远强.小鼠生精周期判定方法的改进[J].中国组织化学与细胞化学杂志,2006(2):130-134.
[3]王洪,李泽惠,邱学德.精原干细胞标志物的研究进展[J].医学综述,2010,16(7):982-985.
[4]侯越,吴应积,罗奋华,等.绒山羊Scp3基因的克隆及睾丸中第一轮减数分裂的发生[J].动物学研究,2009,30(3):341-344.
[5]Kurth B E,Klotz K,Flickinger C J,et al.Localization of sperm antigen SP-10 during the six stages of the cycle of the seminiferous epithelium in man.[J].Biology of Reproduction, 1991,44(5):814-21.
Q2
A
1674-2060(2016)03-0003-02
吴枫

