PMA-qPCR方法快速检测Lactobacillusparacasei N1115活菌的初步研究
张 栋,冯丽莉,薛玉玲,王 华,荀一萍,李兴佳,朱 宏,*,王世杰,2,*
(1.石家庄君乐宝乳业有限公司,河北石家庄 050000;2.四川大学华西公共卫生学院,四川成都 610041)
PMA-qPCR方法快速检测LactobacillusparacaseiN1115活菌的初步研究
张栋1,冯丽莉1,薛玉玲1,王华1,荀一萍1,李兴佳1,朱宏1,*,王世杰1,2,*
(1.石家庄君乐宝乳业有限公司,河北石家庄 050000;2.四川大学华西公共卫生学院,四川成都 610041)
目的:建立快速准确的副干酪乳杆菌N1115(LactobacillusParacaseiN1115)活菌的荧光定量检测方法并应用于菌粉的活菌计数。方法:根据副干酪乳杆菌N1115的苯丙氨酰-tRNA合成酶α亚基基因(pheS)设计特异性引物;使用叠氮溴化丙锭(Propidium monoazide PMA)抑制死菌DNA扩增,然后通过qPCR的方法检测菌粉中的N1115的活菌数。结果:经验证得到一对N1115特异引物:C15F、C15R;副干酪乳杆菌N1115在90 ℃水浴条件下热损伤时间为8 min;PMA对于N1115死菌DNA的扩增有明显的抑制效果;PMA-qPCR能够快速准确的测得菌粉中N1115活菌数。结论:建立了一种快速、准确的副干酪乳杆菌N1115活菌的荧光定量检测方法。
副干酪乳杆菌N1115,叠氮溴化丙锭,荧光定量PCR
副干酪乳杆菌(Lactobacillusparacasei)为乳杆菌属干酪乳杆菌(Lactobacilluscasei)的一个亚种,常被用作酸奶和干酪等乳制品的发酵剂或辅助发酵剂,是近年来研究较多的一种益生乳酸菌[1]。副干酪乳杆菌N1115是一株分离于传统发酵乳中的具有益生功能的副干酪乳杆菌[2]。研究表明,副干酪乳杆菌N1115在低pH和高胆盐环境下仍然能够较好的存活,有良好的益生菌潜质,可用于酸奶及酸奶饮料的制作[3]。在含有副干酪乳杆菌N1115的乳制品生产中,活菌数作为一个重要的数据需要反复的检测。然而传统的活菌数检测方法繁琐检测周期较长难以满足现代工业生产的需求。因此,开发一种能够简单快速检测副干酪乳杆菌N1115活菌数的方法显得尤为重要。
近年来,众多科学工作者尝试使用荧光定量PCR的方法进行微生物检测和计数实验,荧光定量PCR(qPCR)技术具有特异性好、灵敏度高、重复性强、定量准确、自动化程度高和速度快等优点,自推出以来被迅速应用到食品中微生物的快速检测[4-5]。吴燕涛等采用qPCR法测定了发酵乳中双歧杆菌的数量[6]。张力文等通过qPCR法检测人粪便中双歧杆菌[7]。赵胜娟运用qPCR法检测双歧杆菌对小鼠肠道菌群的变化[8]。陈津津等通过qPCR方法检测幼兔粪便双歧杆菌[9]。目前,与双歧杆菌和其他益生菌相比副干酪乳杆菌的检测和计数方法研究较少,对于某一株副干酪乳杆菌的检测和计数研究更为少见。王力均等[1]使用细菌通用引物能够通过PMA-qPCR方法检测只含有副干酪乳杆菌的样品,然而对于含有多种益生菌的产品或者对某特定副干酪乳杆菌菌株的检测和计数国内仍未见报道。
对于常规的荧光定量PCR扩增时无法区分死菌和活菌的DNA可能引起检测的假阳性结果,本研究采用了一种核酸交联试剂叠氮溴化丙锭(PMA),它能够渗透进入细胞膜受损的死菌并阻止其PCR扩增,同时不会影响活菌DNA的PCR扩增[10-11]。
苯丙氨酰-tRNA合成酶a亚基基因(pheS)是一种看家基因(housekeeping genes),乳杆菌属的pheS具有较大差异,种间差异一般高于10%而种内差异达到2%[12]。以此为依据利用副干酪乳杆菌N1115的pheS基因设计出满足荧光定量实验要求的副干酪乳杆菌N1115特异性引物,本研究以副干酪乳杆菌N1115为研究对象,利用pheS基因的特异性设计特异性引物,通过PMA处理与荧光定量PCR结合的方法,建立了一种能够快速准确检测副干酪乳杆菌N1115活菌数的方法。
1 材料与方法
1.1材料与仪器
副干酪乳杆菌N1115为本实验室由传统发酵乳中分离保藏,中国科学院微生物研究所鉴定保存,专利保藏号:CGMCC4691;干酪乳杆菌CICC 6117购自中国工业微生物保藏管理中心;鼠李糖乳杆菌 JMCC 1001分离自传统发酵乳样品,由本实验室鉴定并保存;植物乳杆菌 JMCC0108分离自云南大理传统发酵乳,由本实验室鉴定并保存[13];溶菌酶北京索莱宝科技有限公司;细菌基因组DNA提取试剂盒、2×Taq PCR Master Mix、SuperReal Permix Plus(SYBRGreen)天根生化科技有限公司。
D-37520型净化工作台上海新苗医疗器械制造有限公司;DPX-25BS-11型生化培养箱上海新苗医疗器械制造有限公司;CX31RTSF型显微镜日本奥林巴斯;D-37520型高速离心机赛默飞世尔科技有限公司;LDZX-50KBS型立式压力蒸汽灭菌器上海申安医疗器械厂;XR+型凝胶成像系统美国伯乐BIO-RAD公司;2720型PCR仪美国Aplied Biosystem 公司;罗氏96荧光定量PCR仪瑞士Roche公司。
1.2实验方法
1.2.1特异引物的筛选通过副干酪乳杆菌N1115的中国微生物所菌种鉴定保藏中心的鉴定结果中出具的pheS基因序列,使用DNAMAN软件进行引物设计,根据试剂公司技术手册上目的片段长度不超过400 bp的原则,选择适宜作为荧光定量计数引物3组送上海生工生物科技有限公司合成,引物信息见表1。
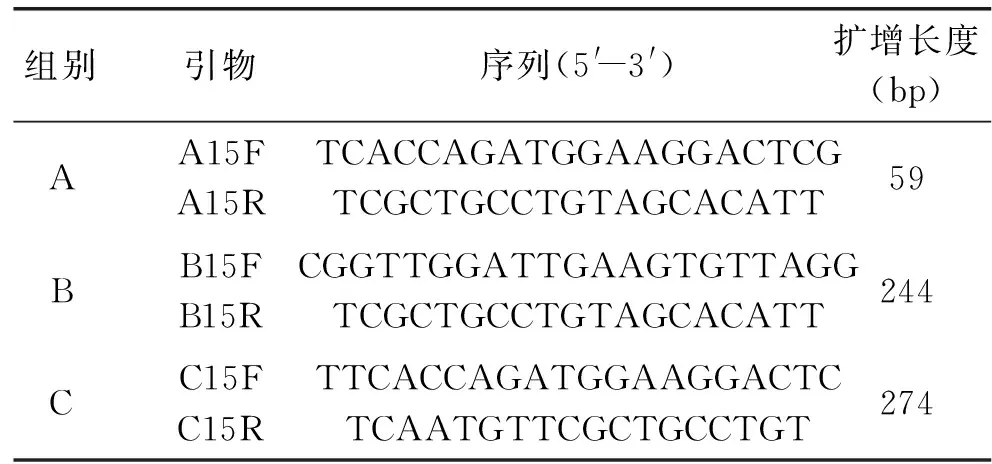
表1 引物信息
采用本实验室保藏的与副干酪乳杆菌N1115遗传距离相近的干酪乳杆菌CICC6117、鼠李糖乳杆菌JMCC1001、植物乳杆菌JMCC0108,作为对照组进行引物的特异性筛选。
使用细菌基因组DNA提取试剂盒按照说明提取以上菌株和副干酪乳杆菌N1115的DNA作为模板,分别以三组引物进行PCR扩增。PCR总体系为20 μL:10 μL 2×Taq PCR Master Mix,DNA模板2 μL,正反向引物各1 μL,加无菌水至20 μL。
PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,共进行30个循环;最后72 ℃延伸5 min。PCR 产物用1%的琼脂糖凝胶120 V电压进行电泳,用BIO-RAD凝胶成像系统成像,琼脂糖凝胶使用GoldView染色,以副干酪乳杆菌N1115能够扩增出目的条带且其他菌株无扩增产物的引物作为荧光定量PCR引物。
再通过荧光定量溶解曲线图对引物的特异性进一步分析,确定引物特异性。荧光定量PCR 的反应体系为25 μL:12.5 μL 2×SYBR Premix Ex Taq,0.75 μL 10 mmol的正反向引物,2 μL基因组DNA,用去离子水补齐至25 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火30 s 共进行40个循环,并在上述扩增条件后增加65 ℃至96 ℃溶解曲线分析步骤。
1.2.2热灭活时间测定为了建立死菌对照组,设计热致死实验来进行L.paracaseiN1115的死菌制备。取活化好的副干酪乳杆菌N1115 MRS菌悬液1~1.5 mL离心管中,离心去上清加入1 mL生理盐水洗涤后重悬,于90 ℃水浴分别放置0、1、4、6、8、10 min后立即置于冰上冷却,利用传统的平板计数法[14]测定各管中活菌数每组设置3个平行,确定副干酪乳杆菌N1115在90 ℃水浴条件下的致死时间。
1.2.3菌悬液的PMA处理和DNA提取取副干酪乳杆菌N1115菌液,取0.5 μL浓度为10 mg/mL的PMA 溶液加入到1 mL菌悬液中(PMA终浓度为5 μg/mL),充分混匀后,室温避光5 min。用500 W卤素灯曝光5 min,且光源距离心管的垂直距离为20 cm。曝光期间离心管置于冰上并持续摇晃离心管,避免局部过热和保证反应充分。曝光结束后12000 r/min离心5 min,弃上清,无菌水洗涤2次后重悬备用[1]。使用细菌基因组DNA提取试剂盒对上述菌体DNA进行提取后-20 ℃保存备用。
1.2.4PMA抑制死菌扩增实验以1.2.3中所提取DNA为模板,以表1中C15F和C15R作为引物,以1.2.1中方法进行PCR扩增和扩增产物检测,同时设置3个对照组:A组:未经任何处理的菌株DNA作为模板;B组:热处理后未进行PMA处理的菌株DNA作为模板;C组未经热处理直接进行PMA处理的菌株DNA作为模板,一个空白对照组:以H2O为模板,进行扩增。扩增结束后,1%琼脂糖凝胶120 V电压电泳后使用BIO-RAD成像系统成像,琼脂糖凝胶使用GoldView染色。

表2 热处理后菌悬液活菌数
1.2.5标准曲线绘制取活化后的副干酪乳杆菌N1115菌悬液,首先进行传统梯度稀释倒平板法活菌计数,确定其副干酪乳杆菌N1115的活菌数,然后将菌悬液连续10倍梯度稀释4次,经过1.2.3中PMA处理后参照1.2.1提取基因组DNA作为荧光定量PCR的模板,以表1中C15F、C15R作为引物,进行荧光定量PCR实验。荧光定量PCR 的反应体系为25μL:12.5 μL 2×SYBR Premix Ex Taq,0.75 μL 10 mmol的正反向引物,2 μL基因组DNA,用去离子水补齐至25 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火30 s 共进行40个循环。每个梯度实验重复三次,计算三次Ct值的平均值,以Ct值的平均值为纵坐标,以DNA模板对应的副干酪乳杆菌的活菌数的对数值为横坐标制作标准曲线。
1.2.6实际样品的检测采用工厂生产的副干酪乳杆菌N1115益生菌菌粉样品,取0.1 g样品进行传统的平板计数,同时取0.01 g样品溶于1 mL生理盐水后通过1.2.3中方法对样品进行PMA处理和DNA提取,通过1.2.4中方法进行qPCR扩增后,分别检测该菌粉中活菌数。
2 结果与分析
2.1特异引物的筛选
经过凝胶成像系统成像,3组引物在对不同菌株进行扩增后结果如图1、图2所示。
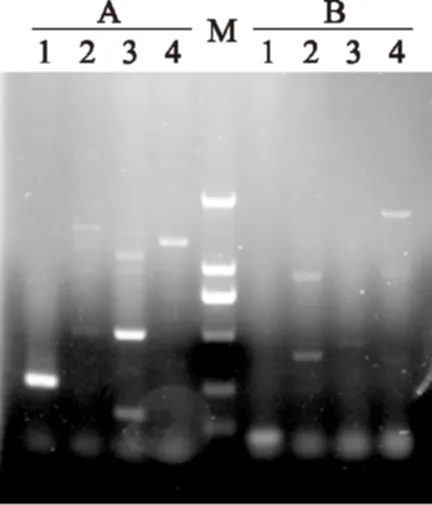
图1 A组B组引物扩增结果Fig.1 The PCR result of the groupA and groupB注:M:D2000Marker;1:副干酪乳杆菌N1115;2:干酪乳杆菌CICC6117;3:植物乳杆菌JMCC0108;4:鼠李糖乳杆菌JMCC1001。
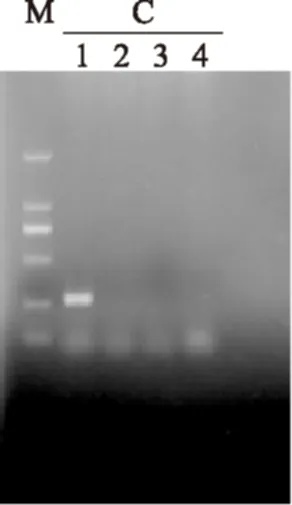
图2 C组引物扩增结果Fig.2 The PCR result of the group C
由图1、图2可知,A组引物特异性较差在其他相近种也出现了条带;B组引物目的条带没有出现且其他三株菌也出现扩增产物,而C组引物在琼脂糖凝胶电泳图中表现出良好的引物特异性,在扩增出明亮的目的片段的同时其他相近菌株均未出现扩增产物。因此选取C组引物进行溶解曲线分析,溶解曲线如图3所示,溶解曲线为单一峰未出现非特异性扩增和引物二聚体。
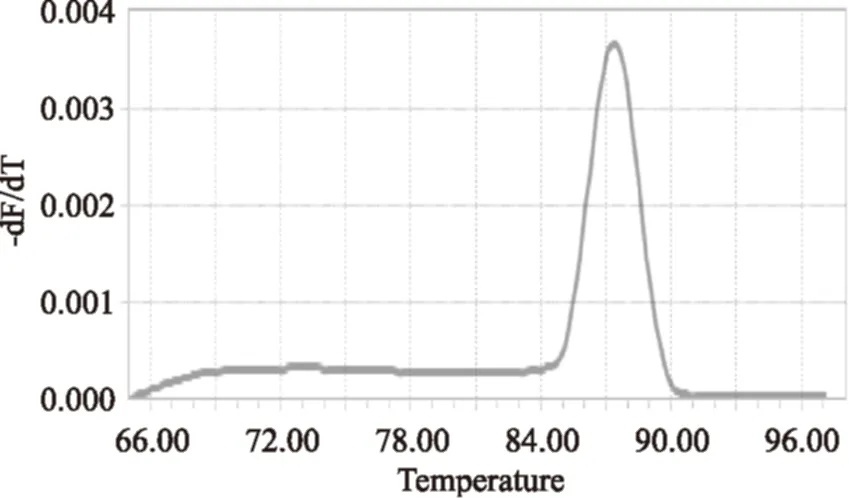
图3 C组引物溶解曲线Fig.3 Melting curves of the primer C
2.2热处理时间的选择
热处理后活菌计数结果取三组平行的算数平均值,如表2所示。
由表2可知,经过8 min 90 ℃水浴后,计数平板中未出现菌落,因此采用8 min作为热处理时间。
2.3PMA抑制死菌扩增效果
经过凝胶电泳成像系统成像,实验组与对照组的扩增产物电泳结果见图4。
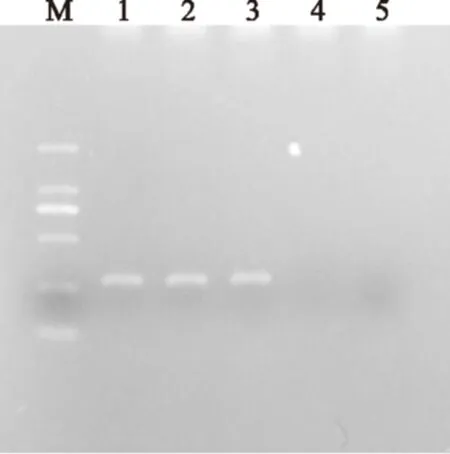
图4 PMA抑制L.paracasei N1115死菌扩增实验结果Fig.4 The result of control the amplification of the dead L.paracasei N1115注:M:D2000 Maker,1:活菌未处理,2:活菌PMA处理,3:热致死后未处理,4:热致死后PMA处理,5:空白对照。
由图4可以观察到,先经过热致死然后进行PMA处理的实验组与未进行PMA处理的对照组比较扩增得到了明显的抑制,而对于活菌PMA处理组与未处理组没有明显的差别。因此PMA能够有效的抑制死菌DNA扩增,不影响活菌的DNA扩增,从而抑制了检测中假阳性结果的产生。
2.4标准曲线绘制
经过传统的平板活菌计数统计得到菌悬液活菌数为8.16×108CFU/mL。qPCR实验结果见表3。
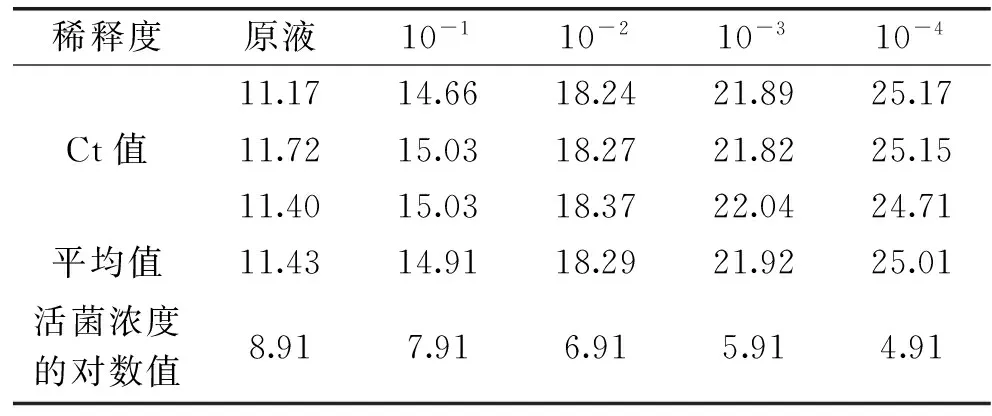
表3 qPCR实验Ct值
以表3中Ct值的平均值为纵坐标,活菌浓度的对数值为横坐标,制作标准曲线见图5。

图5 副干酪乳杆菌N1115荧光定量PCR计数标准曲线Fig.5 The qPCR standard curve of L.paracasei N1115
由标准曲线可知,Ct值与菌浓度的对数值之间程线性关系,关系式为y=-3.417x+41.923,R2=0.9995。
2.5实际样品检测
使用传统活菌计数方法测得副干酪乳杆菌N1115菌粉活菌数为1.93×1010CFU/g,使用本实验方法对副干酪乳杆菌菌粉样品的检测,检测结果通过2.4中关系式计算出活菌数,检测结果和计算结果见表4。
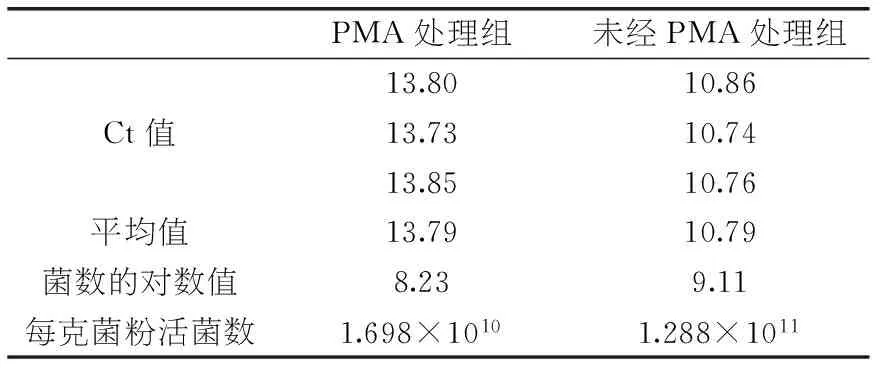
表4 副干酪乳杆菌N1115菌粉样品荧光定量检测结果
由表4可知,通过荧光定量PCR计数,未经PMA处理组的Ct值明显低于PMA处理组,说明PMA抑制了其中死菌的扩增,保证了检测的准确性,PMA处理组计数结果为1.698×1010CFU/g,与传统方法测得的结果接近。
3 结论
根据pheS基因的特异性设计适于副干酪乳杆菌N1115的特异性引物,结合PMA的特性与荧光定量PCR的优点,研究出一种快速、准确的检测副干酪乳杆菌N1115活菌数的方法。将传统培养法检测所需3 d时间缩短到1 d内即可完成。根据本方法可检测副干酪乳杆菌N1115益生菌菌粉中活菌数,通过开发快速的活菌计数方法,为副干酪乳杆菌N1115的进一步开发利用奠定了一定的基础,但是实验条件仍有待优化比如PMA浓度等。
[1]王力均,谭强来,朱江,等. 应用PMA-qPCR方法快速准确检测发酵乳制品中副干酪乳杆菌活菌的研究[J]. 中国微生态学杂志,2013(1):1-4.
[2]Shijie Wang,Hong Zhu,Fang He,et al. Whole Genome Sequence of the Probiotic StrainLactobacillusparacaseiN1115,Isolated from Traditional Chinese Fermented Milk[J]. Genome Announcement,2014,13:2.
[3]卢晓莉,王世杰,陆淳,等. 副干酪乳杆菌N1115的耐酸耐胆盐特性研究[J]. 农业工程技术:农产品加工业,2011(5):32-35.
[4]汪建明,赵仁国,肖冬光.高活性干酪乳杆菌粉末发酵剂初步研究[J].天津科技大学学报,2005,20(2):9-13.
[5]中华人民共和国卫生部 中国国家标准化管理委员会.GB 4789.35-2010 食品安全国家标准-食品微生物学检验-乳酸菌检验[S].北京:中国标准出版社,2008.
[6]吴燕涛,刘晓莉,曹悦,等. 实时荧光定量PCR法测定发酵乳中双歧杆菌[J]. 食品科学,2013(8):172-175.
[7]张力文,王宗润,吴秀丽,等. 实时荧光定量PCR法检测人粪便中双歧杆菌方法的建立及评价[J]. 吉林大学学报:医学版,2014(3):686-691.
[8]赵胜娟. 实时荧光定量PCR法检测双歧杆菌对小鼠肠道菌群影响的研究[D].乌鲁木齐:新疆农业大学,2008.
[9]陈津津,蔡威. 实时荧光定量PCR方法检测幼兔粪便双歧杆菌的实验研究[J]. 世界华人消化杂志,2006,14:1367-1371.
[10]Nocker A,Cheung C Y,Camper A K. Comparison ofpropidium monoazide with ethidium monoazide for differentiation of live vs dead bacteria by selective removal of DNA from dead cells[J].J Microbiolog Methods,2006,67(2):310-320.
[11]于洁. 利用tuf,hsp60和pheS基因的部分序列对乳杆菌进行分类研究[D].呼和浩特:内蒙古农业大学,2009.
[12]刘光全,刘勇,李辉,等. pheS基因序列分析在干酪乳杆菌群种水平鉴定中的应用[J]. 食品与发酵工业,2011(9):94-97.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:289-294.
[14]凌代文.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:1-129.
Study on PMA-qPCR assay for rapid and accurate detection of viableLactobacillusparacaseiN1115
ZHANG Dong1,FENG Li-li1,XUE Yu-ling1,WANG Hua1,XUN Yi-ping1,LI Xing-jia1,ZHU Hong1,*,WANG Shi-jie1,2,*
(1.The Shijiazhuang Junlebao Dairy Co.,Ltd.,Shijiazhuang 050000,China;2.West China School of Public Health,Sichan University,Chengdu 060041,China)
Objective:To develop a fast and accurate live bacteria fluorescent quantitative detection method applied in the viable count ofLactobacillusparacaseiin bacterial powder. Methods:Specific primers were designed according to Phenyl alanine-tRNA synthetase alpha subunit gene(pheS)ofL.paracaseiN1115. Propidium monoazide(PMA)was used to suppress dead bacteria DNA amplification,and then the qPCR method was used to detect bacteria powder in the number of live bacteria N1115. Results:Specific and verified primers ofL.paracaseiN1115 were:C15F,C15R. The thermal damage time ofL.paracaseiN1115 was 8 min in the 90 ℃ water bath. PMA could obviously control the amplification of deadL.paracaseiN1115 . The way of PMA-qPCR could detect the number of livingL.paracaseiN1115 rapidly and accurately. Conclusion:A PMA-qPCR assay had been developed for rapid and accurate detection of viableL.paracaseiN1115.
LactobacillusparacaseiN1115;propidium monoazide;qPCR
2016-01-18
张栋(1987-),男,硕士,研究方向:食品微生物筛选与应用技术研究,E-mail:zhangdong18540@jlbry.com。
朱宏(1964-),男,博士,正高级工程师,研究方向:动物食品研究,E-mail:zhuhong@jlbry.com。
王世杰(1980-),男,博士,正高级工程师,研究方向:微生物及乳制品研究,E-mail:wangshijie@jlbry.com。
河北省重大成果转化项目专项项目(14047104Z)。
TS252
A
1002-0306(2016)18-0070-05
10.13386/j.issn1002-0306.2016.18.005

