HP-β-CD对桑色素的包合作用及光稳定性研究
李姝静,周自若,周 威,白冬生
(北京工商大学理学院化学系,北京 100048)
HP-β-CD对桑色素的包合作用及光稳定性研究
李姝静,周自若,周威,白冬生
(北京工商大学理学院化学系,北京 100048)
以羟丙基-β-环糊精(HP-β-CD)为主体,采用冷冻干燥法制备水溶性良好的桑色素/HP-β-CD包合物。根据相溶解法研究了主客体之间的包合作用,并利用扫描电子显微镜(SEM)、粉末X 射线衍射谱图(XRD)表征了包合物形成。此外,还通过差示扫描量热法(DSC)、热重分析(TG)及光稳定性分析的方法探究了包合前后桑色素光、热稳定性的变化。实验表明:桑色素与HP-β-CD形成了摩尔比1∶1的包合物,缔合常数为833(mol/L)-1。包合后桑色素的水溶性得到提升,在加入了8×10-3mol/L的HP-β-CD后,其溶解度提升了7倍。此外,经包合后的桑色素光、热稳定性也到提升,热分解温度从294 ℃提升至341 ℃,在300 min内的光稳定性也由75.2%提升至82.7%。这为桑色素作为食品添加剂在储存及使用过程中稳定性的提升提供了重要的帮助。
桑色素,羟丙基-β-环糊精,包合物,热稳定性,光降解
桑色素,化学名称为2′,3,4′,5,7-五羟基黄酮,是一种天然的生物类黄酮,广泛存在于桑科植物中,如番石榴叶片、黄颜木等[1-2]。由于其颜色显棕黄色,但难溶于水,只溶于有机溶剂,常常仅作为一种化工色素使用。此外,桑色素也是一种很强的生物活性剂,具有抗炎[3-4]、抗氧化[5]以及抗癌[6-7]等作用,因其结构存在大π键共轭体系,具有较高的超离域度,也可作为金属离子良好的配合物[8],因此可以应用于食品、药品等多种领域。但是,由于桑色素较低的水溶性及易受外界环境中紫外线(UVB)影响[9],从而限制了其发展应用。
环糊精(CDs)是由多个吡喃葡萄糖单元经α-1,4-糖苷键连接形成的环状低聚糖。环糊精因具有亲水的外壳及疏水的空腔,可与一些疏水性的客体分子包合形成包合物,从而提高客体分子的水溶性及稳定性。最常见的环糊精一般含6,7,8个吡喃葡萄糖单元,分别叫做α-,β-,γ-CD[10]。其中,β-CD因为价格低廉,空腔大小适合包合一些常见的疏水性物质而使用最为广泛[11]。研究发现,羟烷基化β-环糊精衍射物(如HP-β-CD)相比β-CD拥有更高的水溶性且无毒副作用,常用来代替β-CD包合一些难溶性分子[12]。因此,本实验选取了HP-β-CD为主体,桑色素为客体分子,研究主客体之间的相互作用,并在此基础上进一步探究桑色素对抗光、热时的稳定性变化。
1 材料与方法
1.1材料与仪器
桑色素上海阿拉丁生化科技股份有限公司;羟丙基-β-环糊精上海西宝生物科技有限公司;其它试剂均为分析纯。
N-1100V-W(WD)旋转蒸发仪东京理化器械株式会社;CARY-60分光光度计美国瓦里安公司;D/MAX 2500V/PC X射线衍射仪德国布鲁克公司;DTG-60AH热重分析仪日本岛津公司;TESCAN VEGA Ⅱ扫描电镜捷克泰思肯公司。
1.2实验方法
1.2.1制备方法
1.2.1.1桑色素/HP-β-CD包合物的制备采用冷冻干燥法制备桑色素/HP-β-CD包合物。桑色素溶于甲醇溶液,HP-β-CD用去离子水溶解。将桑色素溶液缓慢加入HP-β-CD溶液中,磁力搅拌3 d。将搅拌均匀的混合液旋蒸去除有机溶剂后,用0.45 μm过滤膜滤出不溶物,剩余滤液经冷冻干燥后即得桑色素/HP-β-CD包合物。
1.2.1.2桑色素/HP-β-CD物理混合物的制备25 ℃的条件下,将桑色素与HP-β-CD按摩尔比1∶1称取,放入研钵中充分研磨均匀后的产物为桑色素/HP-β-CD的物理混合物。
1.2.2分析方法
1.2.2.1桑色素的标准曲线配制1×10-3mol/L的桑色素乙醇溶液,再稀释成浓度梯度从2.0×10-5~3.0×10-5mol/L的标准液,检测其吸光值。然后以桑色素的浓度为横坐标,吸光值为纵坐标,绘制桑色素浓度与吸光值的标准曲线,得标准曲线为y=18.458x-0.1061,R2=0.9995,线性相关性好。
1.2.2.2桑色素包合物的相溶解度将10 mg桑色素加入10 mL不同浓度的HP-β-CD溶液中(浓度从0 mol/L到1.0×10-2mol/L),放入25 ℃的水浴锅中强力振荡24 h,使用0.45 μm过滤膜除去不溶物,利用分光光度计检测滤液的吸光值,代入到标准曲线中。以HP-β-CD的浓度为横坐标,桑色素的溶解度为纵坐标,绘制桑色素的相溶解度曲线。桑色素与HP-β-CD的缔合常数根据所得的相溶解曲线按下列公式计算得到[13]:
式(1)
式中,S0表示在25 ℃的条件下,不添加环糊精的桑色素的溶解度;Slope为相溶解度曲线的斜率。
1.2.2.3扫描电子显微镜(SEM)将桑色素、HP-β-CD、桑色素/HP-β-CD混合物和桑色素/HP-β-CD包合物粉末研磨均匀后,在双面导电胶带上涂布薄薄的一层,放入喷金室喷金30 s,使样品具有导电性,之后将处理好的样品放入电镜中观察形貌。
1.2.2.4X-射线粉末衍射(XRD)在检测条件为Cu Ka射线,波长=1.54056 Å,电压40 kV,电流40 mA,扫描速度4°/min,2θ范围5~50°的情况下,对桑色素、HP-β-CD、桑色素/HP-β-CD物理混合物及桑色素/HP-β-CD包合物进行X-射线粉末衍射实验,检测物质的晶体结构。
1.2.2.5差示扫描量热法(DSC)及热重分析(TG)差示扫描量热分析及热重分析实验操作条件为:升温区间为50~500 ℃,升温速率10 ℃/min,氮气流量70 mL/min。
1.2.2.6光稳定性研究使用波长范围在UVB区间内的紫外灯照内含桑色素浓度为7×10-5mol/L的桑色素及其包合物溶液,利用紫外-可见分光光度计检测300~500 nm内物质的吸光值。物质光解剩余量的表达方式是:经紫外光照射后物质的吸光度占未经紫外照射时的百分比,其计算公式如下[14]:
光稳定性(%)=经紫外照射样品时的吸光度/未经紫外照射样品的吸光度×100
式(2)
2 结果与讨论
2.1相溶解度
利用相溶解度法分析了25 ℃水浴条件下,桑色素与HP-β-CD之间的相互作用,得到其相溶解度曲线如图所示(图1)。图像中的曲线为典型的AL型相溶解度曲线,表明了桑色素与HP-β-CD之间形成了摩尔比1∶1的包合物[15],意味着一个桑色素分子仅与一个HP-β-CD分子产生包合作用。
通过相溶解度曲线的斜率可以计算得到主客体间形成包合物的缔合常数值,该数值越大,表明主客体之间的包合能力越强[16]。实验得出:桑色素/HP-β-CD包合物的缔合常数为833(mol/L)-1,表明形成的包合物较为稳定。此外,当加入HP-β-CD的浓度为8×10-3mol/L时,包合物的溶解度较未经包合物质溶解度提高了7倍,表示环糊精的包合作用有助于提高桑色素的水溶性。

图1 HP-β-CD存在下桑色素的相溶解度曲线(25 ℃)Fig.1 Phase-solubility diagram of morinwith HP-β-CD(25 ℃)
2.2扫描电子显微镜(SEM)
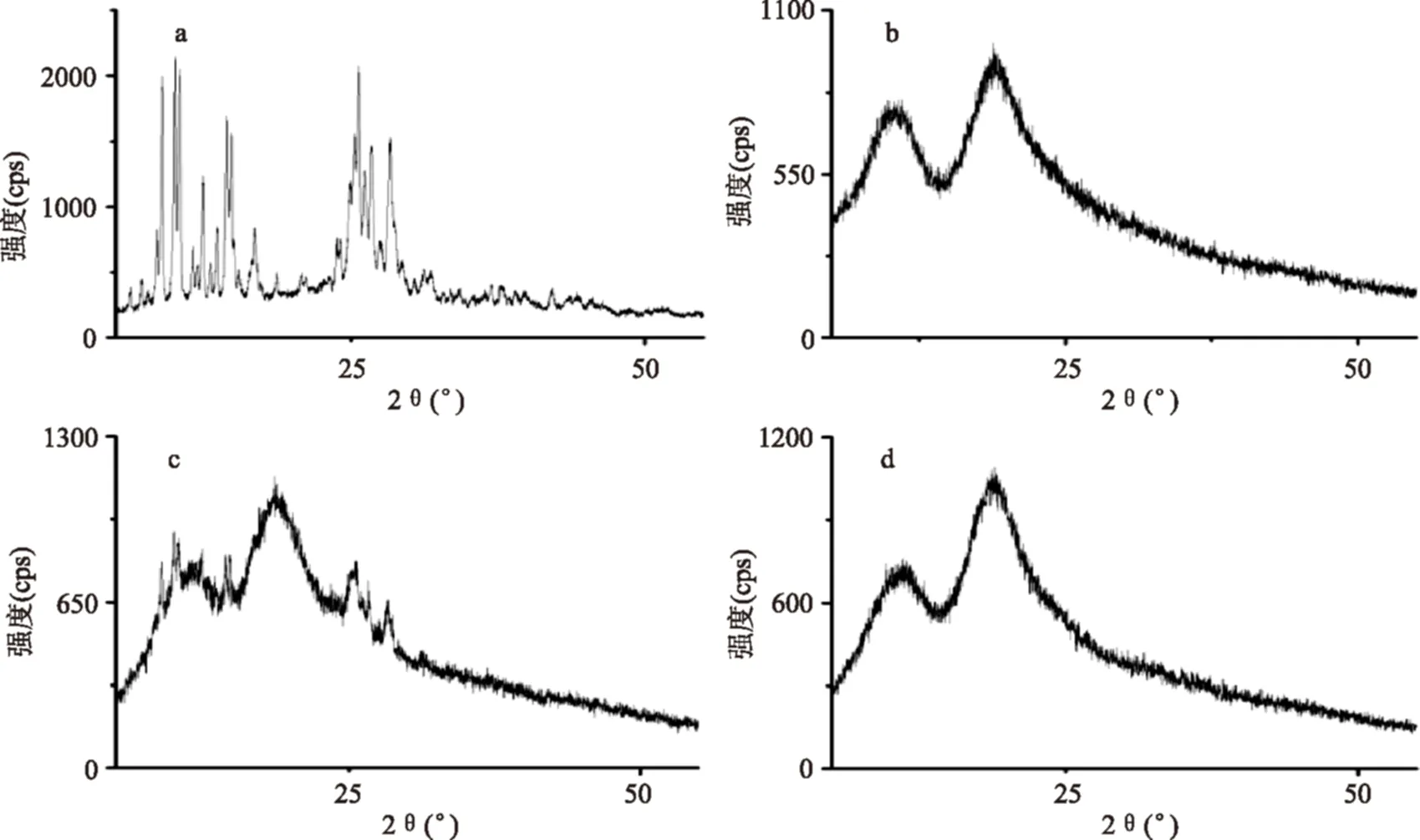
图3 XRPD图(a)桑色素,(b)HP-β-CD,(c)HP-β-CD与桑色素的物理混合物,(d)桑色素/HP-β-CD包合物Fig.3 XRPD patterns:(a)morin,(b)HP-β-CD,(c)morin and HP-β-CD physical mixture,(d)morin/HP-β-CD inclusion complex
桑色素、HP-β-CD、桑色素/HP-β-CD物理混合物和桑色素/HP-β-CD包合物的扫描电子显微照片如图2所示。其中,桑色素的晶型为表面粗糙的块状晶体,而HP-β-CD为不规则球形。在两者的物理混合物中,桑色素的晶体形状及HP-β-CD的形状同时存在。对比包合物,其扫描图片中未出现桑色素及HP-β-CD的形状,而是出现了表面光滑的块状结构。该对照结果表明:桑色素与HP-β-CD简单的物理混合并未使两者发生相互作用,两者仍以原始的状态存在。而通过冷冻-干燥法获得的包合物,桑色素与HP-β-CD的特征形态均消失,推测两者可能发生了相互作用,制备的包合物不再以晶体的形态存在。

图2 SEM图(a)桑色素,(b)HP-β-CD,(c)HP-β-CD与桑色素的物理混合物,(d)桑色素/HP-β-CD包合物(1000×)Fig.2 Scanning electron microphotographs:(a)morin,(b)HP-β-CD,(c)morin and HP-β-CD physical mixture,(d)morin/HP-β-CD inclusion complex(1000×)
2.3X-射线粉末衍射(XRD)
为了进一步的证明桑色素/HP-β-CD包合物的形成,选用XRD对桑色素及其包合物进行分析,结果见图3。HP-β-CD的粉末衍射峰为两条宽峰,表示其为非晶体结构,而桑色素的特征衍射峰中则出现了许多晶体结构特有的尖峰。物理混合物的峰型为两者峰型的简单叠加,证明它们并未形成化学键,仍保留着各自的物理特性。对比包合物的XRD模型,其峰型与HP-β-CD的几乎一样,原有的晶体特征峰完全消失。该结果证明了桑色素形成包合物后失去了原有的晶体结构,也验证了对SEM实验结果的推测。
2.4差示扫描量热分析(DSC)及热重分析(TG)
图4为桑色素(图4a),HP-β-CD(图4b),桑色素/HP-β-CD混合物(图4c),桑色素/HP-β-CD包合物(图4d)的DSC曲线。由于桑色素特殊的晶体结构,使得它存在两条较宽的热分解峰,一个在294 ℃,另一个在352 ℃。HP-β-CD仅存在一个热分解峰,发生在357 ℃。桑色素/HP-β-CD包合物的谱图中,其热分解峰仅有一个,为341 ℃。桑色素及HP-β-CD的吸收峰完全消失,表明主客体之间形成了交联结构,并且热分解温度也趋于稳定且有所提升,意味着包合后的桑色素热稳定性得到了加强。桑色素/HP-β-CD物理混合物的DSC谱图应为两者谱图的简单叠加,造成桑色素/HP-β-CD的物理混合物与其包合物DSC图类似的原因可能是桑色素在物理混合物中所占比例小且桑色素在发生熔融分解时,其中一部分与HP-β-CD形成了包合物的结果。

图4 DSC图(a)桑色素,(b)HP-β-CD,(c)HP-β-CD与桑色素的物理混合物,(d)桑色素/HP-β-CD包合物Fig.4 DSC thermograms:(a)morin,(b)HP-β-CD,(c)morin and HP-β-CD physical mixture,(d)morin/HP-β-CD inclusion complex
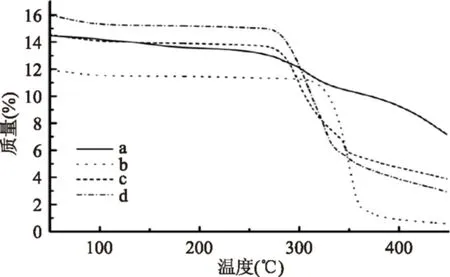
图5 TG图(a)桑色素,(b)HP-β-CD,(c)HP-β-CD与桑色素的物理混合物,(d)桑色素/HP-β-CD包合物Fig.5 TG curves(a)morin,(b)HP-β-CD,(c)morin and HP-β-CD physical mixture,(d)morin/HP-β-CD inclusion complex
热重分析与差示扫描量热分析的原理类似,也是研究包合物热稳定性的有效方法。根据桑色素(图5a)、HP-β-CD(图5b)、HP-β-CD/桑色素物理混合物(图5c)及桑色素/HP-β-CD包合物(图5d)的热重分析图像可知(见图5):桑色素质量在251 ℃时出现了下降趋势,表示该温度下,桑色素发生了分解。而HP-β-CD和桑色素/HP-β-CD包合物的分解温度分别为341、273 ℃,包合物的分解温度与主客体物质均不相同,以此证明了桑色素与HP-β-CD发生相互作用。而两者的物理混合物及包合物TG图相差不大的原因与DSC图类似。
2.5光稳定性

图6 桑色素随光照时间的紫外-可见光谱图Fig.6 The UV-Vis spectra of morinwiththe photoirradiation

图7 桑色素/HP-β-CD包合物随光照时间的紫外-可见光谱图Fig.7 The UV-Vis spectra of morin/HP-β-CDwiththe photoirradiation
为了研究HP-β-CD对桑色素光降解的保护作用,分别配制了相同浓度的桑色素及其包合物溶液,将其置于黑暗环境中,用紫外光照射,每隔一段时间检测吸光度的变化,其结果如图6、图7。由图6、图7可知,桑色素及其包合物的最大吸收波长由359 nm逐渐红移至362 nm,推测是由于生色团的共轭键被破坏,产生了光解产物。根据图8可以看出:随着紫外刺激的时间增加,桑色素及其包合物的吸光值随之减小,表明桑色素发生了光解反应,但是桑色素/HP-β-CD包合物吸光值的下降趋势要小于桑色素。从图9中可知:紫外照射300 min后,桑色素/HP-β-CD包合物光解剩余量为82.7%,而桑色素仅为75.2%,由此证明了桑色素/HP-β-CD包合物的光稳定性要大于桑色素。

图8 桑色素和桑色素/HP-β-CD在最大吸收波长处随光照时间的变化图Fig.8 The absorbance of morin and morin/HP-β-CDat max absorption wavelengh with the photoirradiation time

图9 桑色素和桑色素/HP-β-CD包合物在最大收波长处随光照时间的剩余量Fig.9 The remnant of morin and morin/HP-β-CDat max absorption wavelengh with the photoirradiation time
桑色素发生光降解的原因可能是由于受UVB光照刺激,自身被光氧化导致结构变化的结果[16-17]。CD因能提供更多的非极性环境、阻断通往客体分子的光路而具有保护客体分子免受可见光及紫外光刺激的作用[18]。根据黄酮类化合物的特点,其光稳定的强弱主要取决于苯环上的羟基(-OH)[19],由于包合物也产生部分光解,推测原因可能为桑色素的酚羟基并未完全被HP-β-CD包合,部分处在空腔的外部,从而未能100%的起到光保护作用。
3 结论
采用冷冻-干燥法制备了桑色素/HP-β-CD包合物,桑色素的水溶性经HP-β-CD包合后得到了大幅增长,包合物水溶性增强的原因可能是由于环糊精将桑色素难溶于水的部分全部包裹在疏水性空腔内部,从而大大增加了其在水中的溶解性。此外,SEM、XRD的研究证明了桑色素与HP-β-CD包合成功,DSC及TG实验分析得出桑色素包合物的热稳定性要高于未包合的桑色素,而紫外光照实验则证实了CD可以有效地保护空腔内的桑色素免受外界环境的干扰。因此,桑色素/HP-β-CD包合物可以作为水溶性色素添加到糕点、饮料等食品行业中。而且由于各方面稳定性能的提升也有助于食品的储存、运输。总之,桑色素/HP-β-CD包合物稳定性的研究为其在食品工业的发展奠定了理论基础。
[1]Perumal MK,Perumal NK,Samidurai M,et al. Morin ameliorates chemically induced liver fibrosisinvivoand inhibits stellate cell proliferationinvitroby suppressing Wnt/β-catenin signaling[J]. Toxicology and Applied Pharmacology,2014,277:210-220.
[2]Aggarwal BB,Shishodia S. Molecular targets of dietary agents for prevention andtherapy of cancer[J]. Biochemical Pharmacology,2006,71(10):1397-1421.
[3]Mendoza-wilson AM,santacruz-ortega H,Balandrán-quintana RR. Relationship between structure,properties,and the radical scavenging activity of morin[J]. Journal of Molecular Structure,2011,995(1):134-141.
[4]Fang SH,Hou Y C,Chang W C,et al.Morin sulfates/glucuronides exert anti-inflammatory activity onactivated macrophages and decreased the incidence of septic shock[J].Life Sciences,2003,74(6):743-756.
[5]Kok LD,Wong Y P,Wu T W,et al.Morin hydrate:a potential antioxidant in minimizing the freeradicals-mediated damage to cardiovascular cells by antitumor drugs[J]. Life Sciences,2000,67(1):91-99.
[6]Iwase Y,Takemura Y,Ju-ichi M,et al. Inhibitory effect of flavonoid derivatives on Epstein-Barr virus activation and two-stage carcinogenesis of skin tumors[J]. Cancer Letters,2001,173:105-109.
[7]Panhwar QK,Memon S,Bhanger MI. Synthesis,characterization,spectroscopic and antioxidation studies of Cu(II)-morin complex[J]. Journal of Molecular Structure,2010,967(1):47-53.
[8]宋玉民,康敬万,卢小泉,等. 桑色素及其配合物与DNA作用的研究[J]. 高等学校化学学报,2003,24(2):249-251.
[9]Jienny L,Yeun-Kyung S,Jae-Young S,et al. Protective mechanism of morin against ultraviolet B-induced cellular senescence in human keratinocyte stem cells[J]. International Journal of Radiation Biology,2014,90(1):20-28.
[10]Gomes L M M,Petito N,Costa V G,et al. Inclusion complexes of red bell pepper pigments withβ-cyclodextrin:Preparation,characterisation and application as natural colorant in yogurt[J].Food Chemistry,2014,148:428-436.
[11]Szente L,Szejtli J. Cyclodextrins as food ingredients[J]. Trends in Food Science and Technology,2004,15:137-142.
[12]Wang Z,Zhang X,Deng Y,et al. Complexation of hydrophobicdrugs with hydroxypropyl-β-cyclodextrin by lyophilization using a tertiarybutyl alcohol system[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2007,57:349-354.
[13]Higuchi T,Connors K A. Phase solubility techniques[J]. Advances in Analytical Chemistry Instrumentation,1965,4:117-212.
[14]Thitinun K,Raweewan K,Chaiwat N,et al. Photostability of water-soluble inclusion complexes of UV-filters and curcumin with gamma-cyclodextrin polymer[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry,2016,84:121-128.
[15]Takahashi A I,Veiga F J B,Ferraz H G. A literature review ofcyclodextrin inclusion complexes characterization-Part I:Phase solubilitydiagram,dissolution and scanning electron microscopy[J]. International Journal of Pharmaceutical Sciences Review and Research,2012,12(1):1-6.
[16]Zeynep A,Semran I K,Engin D,et al. Quercetin/β-cyclodextrin inclusion complex embedded nanofibres:Slowrelease and high solubility[J]. Food Chemistry,2016,197:864-871.
[17]Chen YH,Yang ZS,Wen CC,et al. Evaluation of the structure-activity relationship of flavonoids as antioxidantsand toxicants of zebrafish larvae[J].Food Chemistry,2012,134:717-724.
[18]Carlotti M E,Sapino S,Ugazio E,et al. On the complexation ofquercetin with methyl-β-cyclodextrin:Photostability and antioxidant studies[J]. Journal of Inclusion Phenomena and Macrocyclic,2011,70(1-2):81-90.
[19]Smith G J,Thomsen S J,Markham K R,et al. Thephotostabilities of naturally occurring 5-hydroxyflavones,flavonols,theirglycosides and their aluminium complexes[J]. Journal of Photochemistry and Photobiology A:Chemistry,2000,136(1):87-91.
Preparation and stability of the inclusion complex of HP-β-CD with morin
LI Shu-jing,ZHOU Zi-ruo,ZHOU Wei,BAI Dong-sheng
(Department of Chemistry,School of Science,Beijing Technology and Business University,Beijing 100048,China)
The water-soluble inclusion complex of morin and(2-hydroxy)propyl-β-cyclodextrin(HP-β-CD)was prepared by freeze-drying method. The effects of the inclusion behavior of host-guest was investigated by methods of phase-solubility and characterized byscanning electron microscopy(SEM)and X-ray diffraction(XRD).Furthermore,the stability of morin and it inclusion complex was also investigated by differential scanning calorimetry(DSC),andphotostability test.The experiment showed thatmorin formed 1∶1 stoichiometric inclusion complex with HP-β-CD,and the apparent stability constant was 833(mol/L)-1.The solubility of the morin was dramaticallyincreasedas it enhanced more than 9 times. Also the decomposition temperature of morin was improved from 294 ℃ to 341 ℃ after encapsulated by HP-β-CD and the photostability of morin was enhanced from 75.2% to 82.7%. Therefore,it could be a potentially promising way to promote its stability as food additive in storage and application.
morin;cyclodextrin;inclusion complex;solubility;photodegradation
2016-03-23
李姝静(1980-), 女, 博士, 副教授, 主要从事新型主客体识别功能体系的设计与制备方面的研究,E-mail:lishujing@mail.ipc.ac.cn。
国家自然科学基金(31501445);北京工商大学中国化妆品协同创新研究中心。
TS201.1
A
1002-0306(2016)18-0094-06
10.13386/j.issn1002-0306.2016.18.010

