动物肌肉组织DNA的提取方法及实时荧光定量PCR检测
刘 娜,赵 新,陈 锐,王 成,朱 珠,王 永,兰青阔
(天津市农业质量标准与检测技术研究所,天津 300381)
动物肌肉组织DNA的提取方法及实时荧光定量PCR检测
刘娜,赵新+,陈锐,王成,朱珠,王永,兰青阔*
(天津市农业质量标准与检测技术研究所,天津 300381)
以生鲜羊肉、猪肉、鸡肉、牛肉、鸭肉为实验材料,采用SDS法、异硫氰酸胍法、试剂盒法提取动物肌肉组织基因组DNA,对提取的DNA进行琼脂糖凝胶电泳和实时荧光定量PCR检测。结果表明,试剂盒法提取的基因组DNA在浓度和纯度方面均优于SDS法和异硫氰酸胍法。通过对三种提取方法建立的标准曲线进行比较,回归系数(R2)按照质量排序为:试剂盒法≥异硫氰酸胍法>SDS法,扩增效率按照质量排序为:试剂盒法>异硫氰酸胍法>SDS法。三种提取方法的羊源性成分灵敏度检测,最低检出限均为80 pg/μL,但在低浓度检测时试剂盒法的相对标准偏差RSD为0.684%,小于异硫氰酸胍法0.734%和SDS法1.075%;猪源性成分灵敏度检测,SDS法的最低检出限为80 pg/μL,异硫氰酸胍法和试剂盒法的最低检出限均为16 pg/μL,但在低浓度检测时试剂盒法的相对标准偏差RSD为0.092%,小于异硫氰酸胍法4.640%;鸡源性成分灵敏度检测,SDS法和异硫氰酸胍法的最低检出限均为3.2 pg/μL,试剂盒法的最低检出限为640 fg/μL,明显高于SDS法和异硫氰酸胍法。综上所述,试剂盒法提取的基因组DNA更有利于运用实时荧光定量PCR技术进行食物掺假和物种鉴别工作。
动物肌肉,SDS法,异硫氰酸胍法,试剂盒法,DNA,实时荧光定量PCR
近年来,随着食品工业的迅猛发展,动物源食品掺假造假现象普遍发生,对食品进行动物源成分鉴定,已经成为一个备受关注的问题[1-2]。随着生物技术的发展,以物种间基因差异为基础的分子学鉴定方法成为研究的热点。由于PCR方法特异性和灵敏度都很高,以DNA为基础的PCR技术已经被广泛用于鉴定食品、饲料中的动物源性成分,而高质量、高纯度的基因组DNA的获得则是开展该方面研究工作的前提。长期以来,动物肌肉组织样本中DNA的提取一直是耗时、繁琐的过程,消解过程长达数小时甚至过夜,严重减慢了检测速度,同时在提取过程中还反复使用多种有机溶剂,对实验人员的健康造成损伤。因此,许多学者一直在探索动物肌肉组织DNA的高效安全提取方法。

表1 PCR和测序引物序列
目前国内外研究发现并使用的动物肌肉组织DNA提取方法有很多,其中使用最频繁主要为SDS法、异硫氰酸胍法[3]、试剂盒法[4],以及一些以SDS法为基础的改良方法[5]。根据研究表明,SDS法虽能获得纯度高,含量多的DNA,但比较费时,往往消化过程需要数小时甚至过夜,且蛋白酶K的消化成本过高,流程繁琐,操作复杂,而且提取过程中使用了大量的有机溶剂,有损实验人员的健康。异硫氰酸胍法操作相对简单、快速,虽可以得到较纯的DNA,但仍不可避免氯仿等有机溶剂对实验人员的损伤。本实验室依据各种方法的原理和试剂特性,开发出一种便于提取DNA的试剂盒。该试剂盒将SDS(十二烷基硫酸钠)与吸附性硅胶柱相结合,既达到了有效的细胞裂解,又通过硅胶柱实现了安全无污染的分离纯化,同时操作简单、快速且成本低廉,有效地避免使用氯仿等有机溶剂,并对操作人员没有损害。
因此本文采用SDS法、异硫氰酸胍法以及本实验室研发的试剂盒法提取不同动物肌肉组织基因组DNA,并对提取的DNA进行纯度、浓度检测和实时荧光定量PCR检测分析,从而对提取效果进行比较,为食品安全中利用PCR技术进行食物掺假和物种鉴别检测提供一个更快速、稳定、优质的DNA提取方法。
1 材料与方法
1.1材料与仪器
生鲜羊肉、生鲜猪肉、生鲜鸡肉、生鲜牛肉、生鲜鸭肉均购于天津市农贸市场;DNA提取主要试剂的配制:SDS裂解液10 mol/L NaOH、500 mmol/L EDTA、1 mol/L Tris·Cl、5 mol/L NaCl、10%十二烷基磺酸钠;异硫氰酸胍裂解液5 mol/L GuSCN、50 mmol/L Tris·Cl、20 mmol/L EDTA、1.3%Triton-100 曲拉通;TE缓冲液10 mmol/L Tris·HC1、l rnmol/L EDTA;三氯甲烷-异戊醇比例为24∶1;异丙醇、70%乙醇;实验用水灭菌双蒸水;定量Premix Ex Taq(Probe qPCR)预混液TaKaRa公司;引物、探针由上海生工生物技术有限公司合成。
StepOnePlus Real-time PCR仪美国ABI公司;SUB-cell GT核酸电泳仪、ND-1000 NanoDrop核酸蛋白测定仪美国Bio-Rad公司;G:BOX凝胶成像系统英国SYNGENE公司;Allegra 21R Centrifuge高速冷冻离心机美国BECKMAN公司。
1.2实验方法
1.2.1引物与探针的设计参照文献[6],同时根据GenBank中公布的动物源线粒体细胞色素b基因序列,运用Primer Express 3.0软件,设计引物和探针序列,见表1,引物和探针由上海生工生物工程有限公司合成。
1.2.2样品的制备取待测动物肌肉组织样本清水洗净后,剔去动物组织中的结缔组织和脂肪,剪成约200 mg的小块,放入用液氮预冷的研钵中,然后缓缓的向研钵中加入液氮,迅速研磨,直到样品成细微的粉末状为止。本实验涉及的羊肉、猪肉、鸡肉、鸭肉、牛肉可分为三类,一是反刍动物包括羊和牛,二是禽源性动物包括鸡和鸭,三是猪。为了在较短时间内比较三种DNA提取方法的实时荧光PCR检测效果,因此本实验室以羊肉、猪肉和鸡肉为例,按照质量浓度,以非目标动物源成分为基质,配制羊肉、猪肉、鸡肉浓度含量为100%、50%、10%、5%、1%的标准品,备用。
1.2.3DNA模板的提取
1.2.3.1SDS法参照文献[7]。取100 mg样品至2 mL灭菌离心管中,加入500 μL SDS裂解液和20 μL蛋白酶K,混匀,55 ℃水浴消化数小时至过夜,期间不停颠倒混匀,直至溶液透明;将消化后的组织裂解液加入等体积的Tris饱和酚,缓慢颠倒混匀,12000 r/min离心10 min,转移上清液至一新离心管中,重复1次;加入0.5倍体积的Tris饱和酚和0.5倍体积的氯仿/异戊醇(24∶1),缓慢颠倒混匀,12000 r/min离心10 min,转移上清至一新离心管;加入0.1倍体积的乙酸钠溶液和2.5倍体积4 ℃预冷的无水乙醇,缓慢颠倒混匀,可见白色DNA絮状沉淀析出,-20 ℃沉淀2 h;12000 r/min离心5 min,加入500 μL 70%乙醇洗涤沉淀;室温下放置使残余乙醇完全挥发,加入100 μL TE缓冲液溶解DNA沉淀。
1.2.3.2异硫氰酸胍法参照文献[8]。取50 mg粉末至2 mL灭菌离心管中,加入200 μL TE,混匀;再加入400 μL异硫氰酸胍裂解液和10 μL蛋白酶K,涡旋混匀,55 ℃水浴消化1 h,期间不停颠倒混匀,直至溶液透明;加入300 Tis-饱和酚和300 μL氯仿/异戊醇(24∶1),剧烈振荡15 s,13000 r/min离心10 min;取上清,加入等体积的氯仿/异戊醇(24∶1),剧烈振荡15 s,13000 r/min离心10 min;取上清,加入等体积的氯仿,剧烈振荡15 s,13000 r/min离心10 min;取上清,加入0.8倍体积的异丙醇,12000 r/min离心10 min,弃上清,加入1 mL 70%乙醇洗涤沉淀;室温下放置使残余乙醇完全挥发,加入100 μL TE缓冲液溶解DNA沉淀。
1.2.3.3试剂盒法取100 mg放入2 mL离心管,加入500 μL SDS裂解液和6 μL蛋白酶K,65 ℃水浴60 min,期间不停颠倒混匀;13200 r/min离心5 min;小心地将上层水相转入一个新的离心管中,加入0.8倍异丙醇;将混匀的液体转入吸附柱中,13200 r/min,离心30 s,弃掉废液;向吸附柱中加入70%乙醇,13200 r/min离心30 s,弃掉废液,重复此步骤一次;将吸附柱放回收集管中,13200 r/min离心2 min,倒掉废液;将吸附柱置于室温数分钟,以彻底晾干吸附材料中残余的乙醇;将吸附柱转入一个干净的离心管中,向吸附膜的中间位置悬空滴加100 μL的洗脱缓冲液TE,室温放置2~5 min,13200 r/min,离心2 min,所得溶液即为DNA。
1.2.4DNA质量检测取2 μL DNA样品溶液,用 Nano Drop ND1000进行检测和定量。同时取5 μL DNA溶液进行1%琼脂糖凝胶电泳,在凝胶成像系统观察并分析DNA的电泳情况。
1.2.5动物源性成分实时荧光PCR反应条件的建立PCR反应体系为20 μL,各成分含量为:2×Premix Ex Taq(Probe qPCR)预混液10 μL,上下游引物各1 μL,探针引物0.5 μL,模板2 μL,无菌超纯水补足20 μL,混匀后离心,在实时荧光PCR仪上开始循环。循环参数为:95 ℃预变性15 min,然后进行45个循环,每个循环为95 ℃变性20 s,62 ℃退火30 s。
1.2.6标准曲线的建立将配制的50%、10%、5%、1%的4个梯度标准品作为模版,建立20 μL反应体系,每个标准品设置3个平行,根据1.2.5建立的反应条件进行实时荧光PCR扩增。
1.2.7方法灵敏度研究用鲑鱼精DNA将提取的羊肉、猪肉、鸡肉DNA原液稀释至50 ng/μL,然后进行5倍系列梯度稀释,即50、10、2 ng/μL、400、80、16、3.2 pg/μL、640 fg/μL等8个梯度,去离子水作为阴性对照模版,以1.2.4建立的反应程序及条件进行实时荧光PCR检测。RSD值按下列公式计算:
2 结果与分析
2.1DNA模版提取及浓度测定
DNA提取结果如表2所示,三种方法提取的DNA260/280比值均在1.8~2.0之间,提取方法对核酸中蛋白质、RNA等杂质的处理较为得当。SDS法和试剂盒法提取的DNA 260/230比值在2.0以上,说明提取方法对核酸中盐分等杂质的处理较为得当;异硫氰酸胍法提取的DNA260/230比值在2.0以下,该提取方法对核酸中盐分等杂质处理的较差。同时用1%琼脂糖电泳检测核酸提取质量,由图1可知,异硫氰酸胍法、试剂盒法可得到相对单一条带,但试剂盒法提取的DNA条带更清晰明亮、整齐,蛋白质和RNA污染少,相比SDS法提取的DNA条带有拖尾现象,降解较为严重。

表2 不同肉源品种DNA浓度
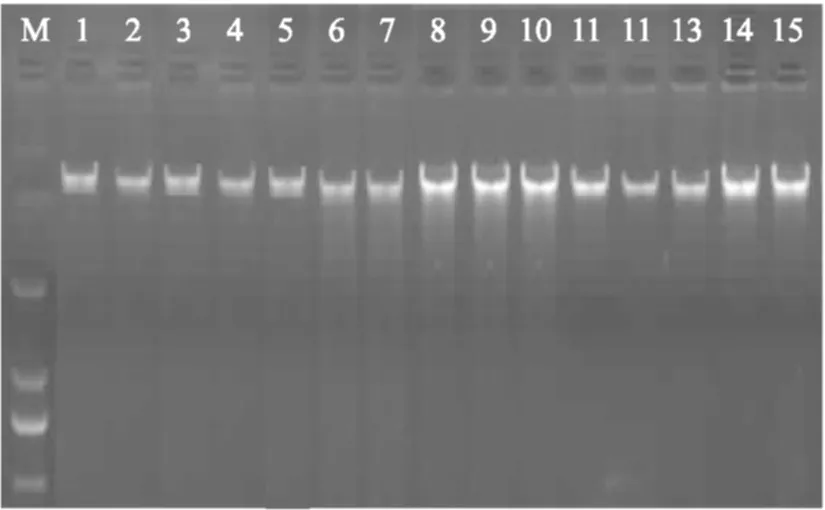
图1 不同肉源品种DNA电泳检测Fig.1 DNA electrophoresis detection of different meat varieties注:M:DL2000 DNA Marker;1:异硫氰酸胍法-生鲜鸡肉;2:异硫氰酸胍法-生鲜猪肉;3:异硫氰酸胍法-生鲜羊肉;4:异硫氰酸胍法-生鲜牛肉;5:异硫氰酸胍法-生鲜鸭肉;6:SDS法-生鲜鸡肉;7:SDS法-生鲜猪肉;8:SDS法-生鲜羊肉;9:SDS法-生鲜牛肉;10:SDS法-生鲜鸭肉;11:试剂盒法-生鲜鸡肉;12:试剂盒法-生鲜猪肉;13:试剂盒法-生鲜羊肉;14:试剂盒法-生鲜牛肉;15:试剂盒法-生鲜鸭肉。
2.2标准曲线的建立
本实验以生鲜羊肉、猪肉、鸡肉为例建立标准曲线,通过对不同肉源不同质量浓度梯度的标准品(50%、10%、5%、1%)进行扩增,每个梯度设三个重复,选取重复性好的作为标准点,以标准品的Ct值(threshold cycle)为横坐标对初始浓度的对数值作图,以标准品拷贝数的对数值为横坐标,以测得的Ct值为纵坐标,绘制标准曲线。根据《实时荧光定量国际化标准—MIQE指南》要求,检测方法的回归系数R2最小可接受值0.98,斜率可接受的范围:-3.1≥斜率≥-3.6,扩增效率在90%~110%之间,所有质量排序均参照《实时荧光定量国际化标准—MIQE指南》要求以最接近100%为最优。
对于生鲜羊肉,结果如表3所示,通过三种提取方法建立的标准曲线的比较,回归系数(R2)按照质量排序为:试剂盒=异硫氰酸胍法>SDS法,扩增效率按照质量排序为:试剂盒>异硫氰酸胍法>SDS法,斜率都在可接受的范围内(-3.1≥斜率≥-3.6);对于生鲜猪肉,三种提取方法建立的标准曲线的比较,R2按照质量排序为:试剂盒=异硫氰酸胍法>SDS法,扩增效率按照质量排序为:试剂盒>异硫氰酸胍法>SDS法,斜率都在可接受的范围内(-3.1≥斜率≥-3.6);对于生鲜鸡肉,三种提取方法建立的标准曲线的比较,R2按照质量排序为:试剂盒>SDS法>异硫氰酸胍法,扩增效率按照质量排序为:试剂盒>SDS法>异硫氰酸胍法,斜率都在可接受的范围内(-3.1≥斜率≥-3.6)。
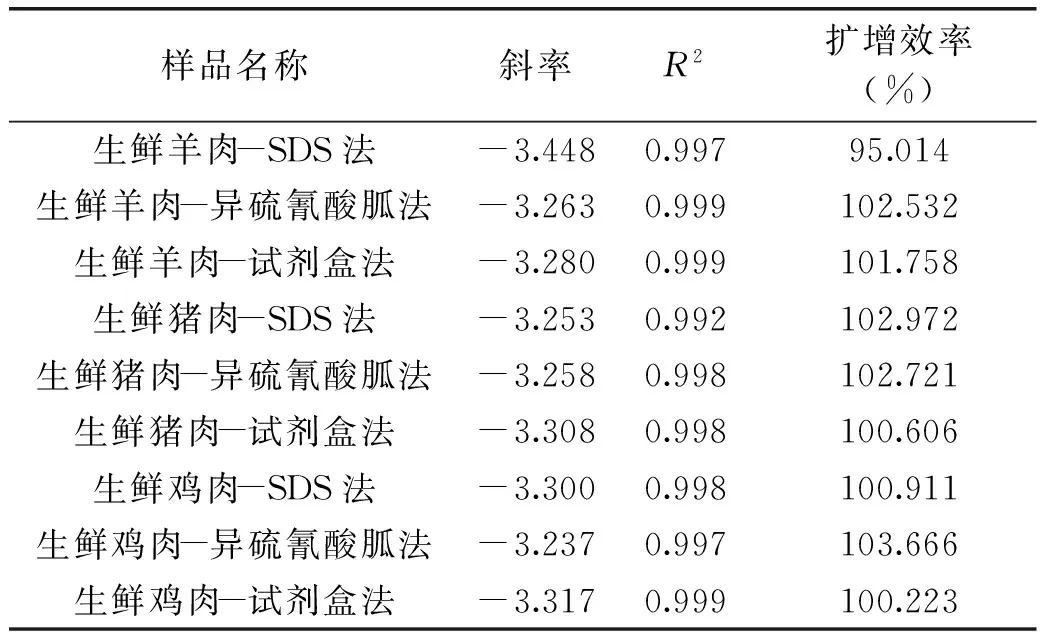
表3 不同肉源品种标准曲线
通过综合实验结果比较,以本实验室研发的试剂盒法提取的三种动物源成分的DNA为模板建立标准曲线的回归系数和扩增效率均优于SDS法和异硫氰酸胍法。标准曲线如图2所示。
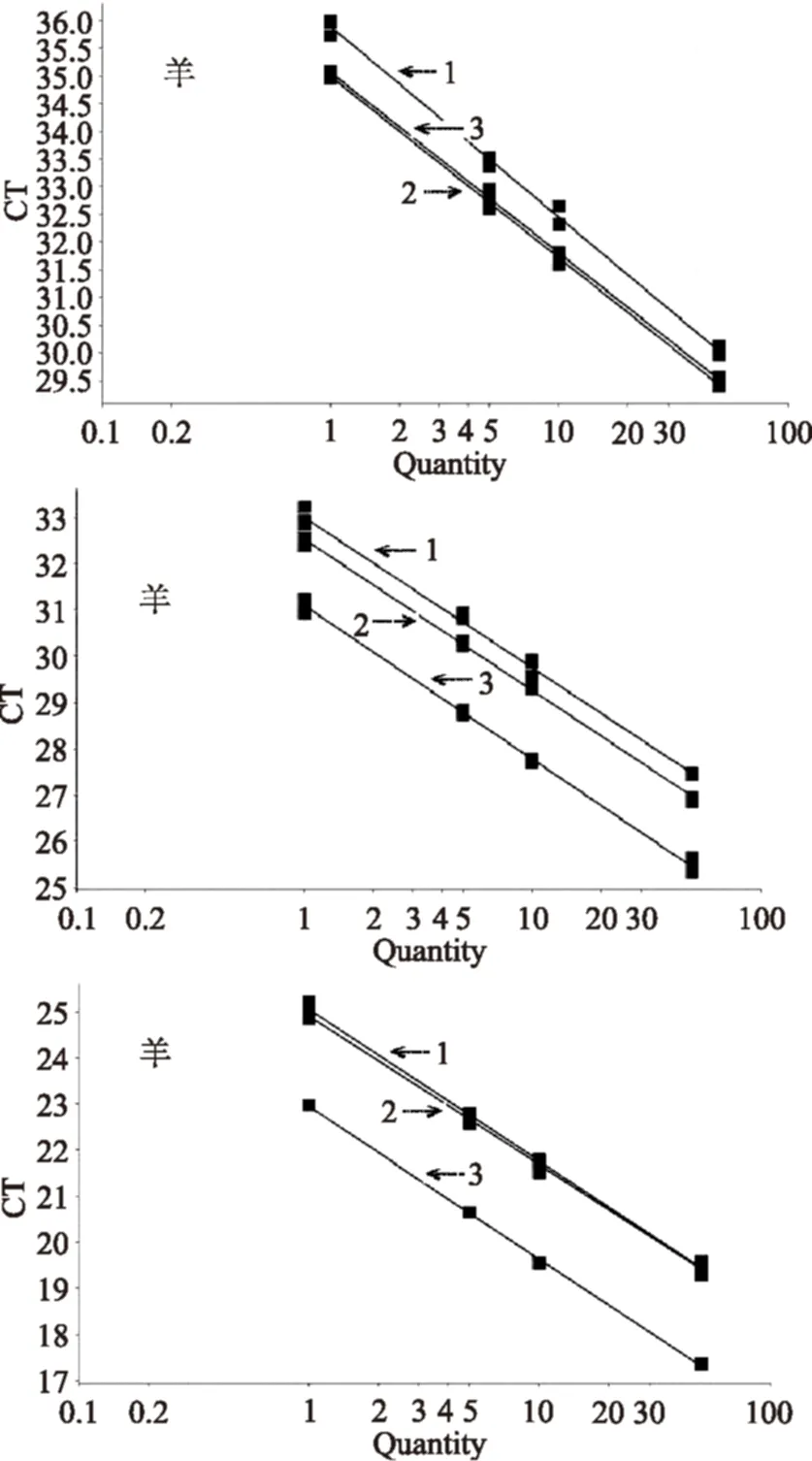
图2 定量标准曲线Fig.2 Quantitative standard curve注:1,SDS法;2,异硫氰酸胍法;3,试剂盒法。
2.3方法敏感性实验
2.3.1羊源性成分方法灵敏度研究以浓度为50、10、2 ng/μL、400、80、16、3.2 pg/μL、640 fg/μL的羊源性成分DNA样本作为模板时,三种提取方法的羊源性成分灵敏度检测结果Ct值如图3,表4所示,根据《实时荧光定量国际化标准—MIQE指南》要求,Ct值≥40视为无效扩增,Ct值≤38视为典型扩增,Ct值在38到40之间经重复实验依然在该区间内稳定扩增的视为有效扩增。因此虽然在16 pg/μL和3.2 pg/μL有扩增曲线,但不符合上述指南要求,无法判定为稳定的检出限,在浓度80 pg/μL时经过重复实验,三种提取方法的Ct值依然在38~40,可视为有效扩增,因此三种提取方法的最低检出限均为80 pg/μL,空白对照及阴性对照均正常。相对标准偏差RSD均小于25%,在可接受的范围之内,具有良好的重复性和重现性,但对于检出限都是80 pg/μL的试剂盒法相对标准偏差RSD 0.684%小于异硫酸氰胍法的相对标准偏差RSD 0.734%,试剂盒法表现出更加稳定的重复性。

表4 羊源性成分灵敏度检测结果Ct值
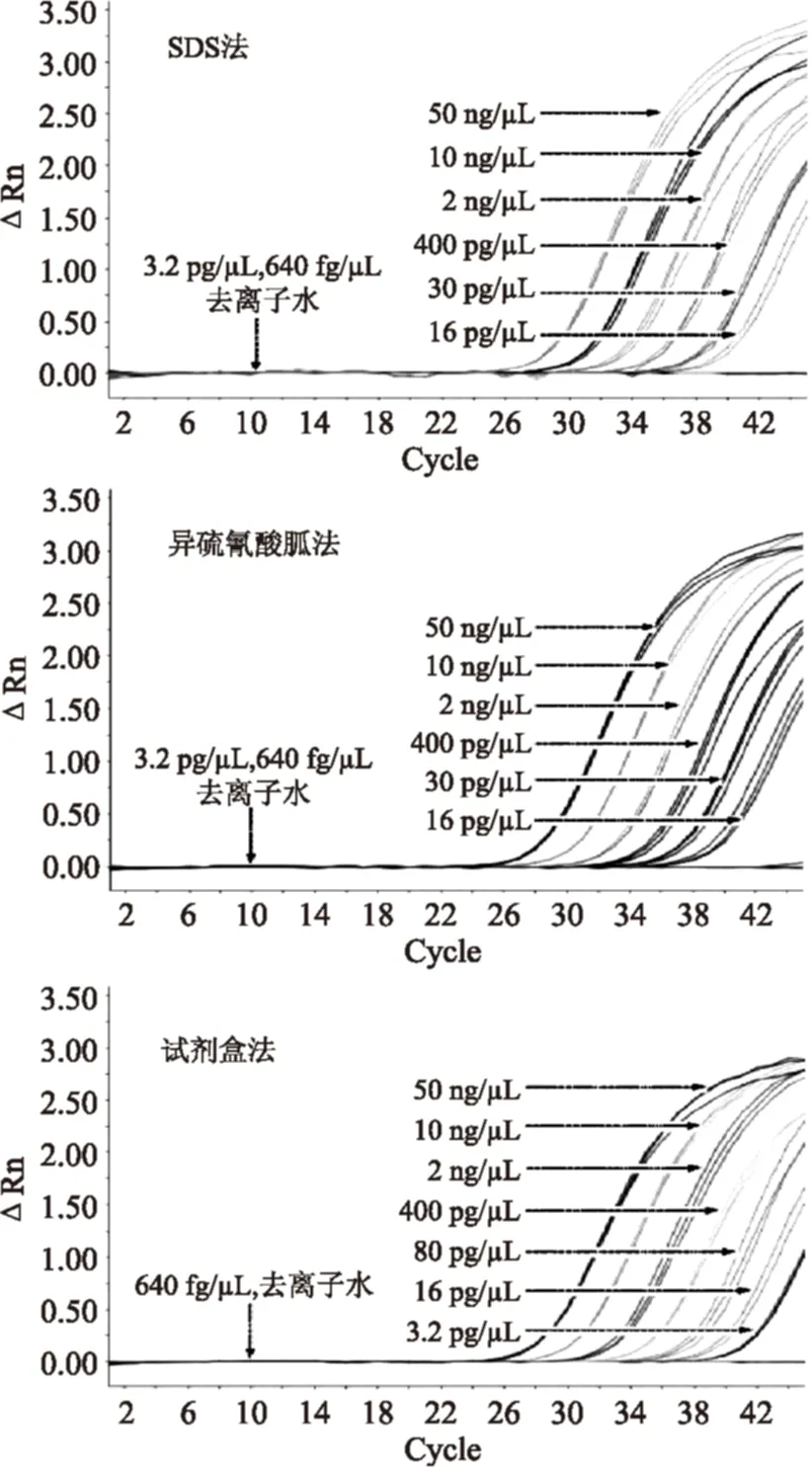
图3 羊源性成分方法灵敏度研究荧光扩增曲线Fig.3 Fluorescent amplification curve of sheep-derived ingredients sensitivity research method
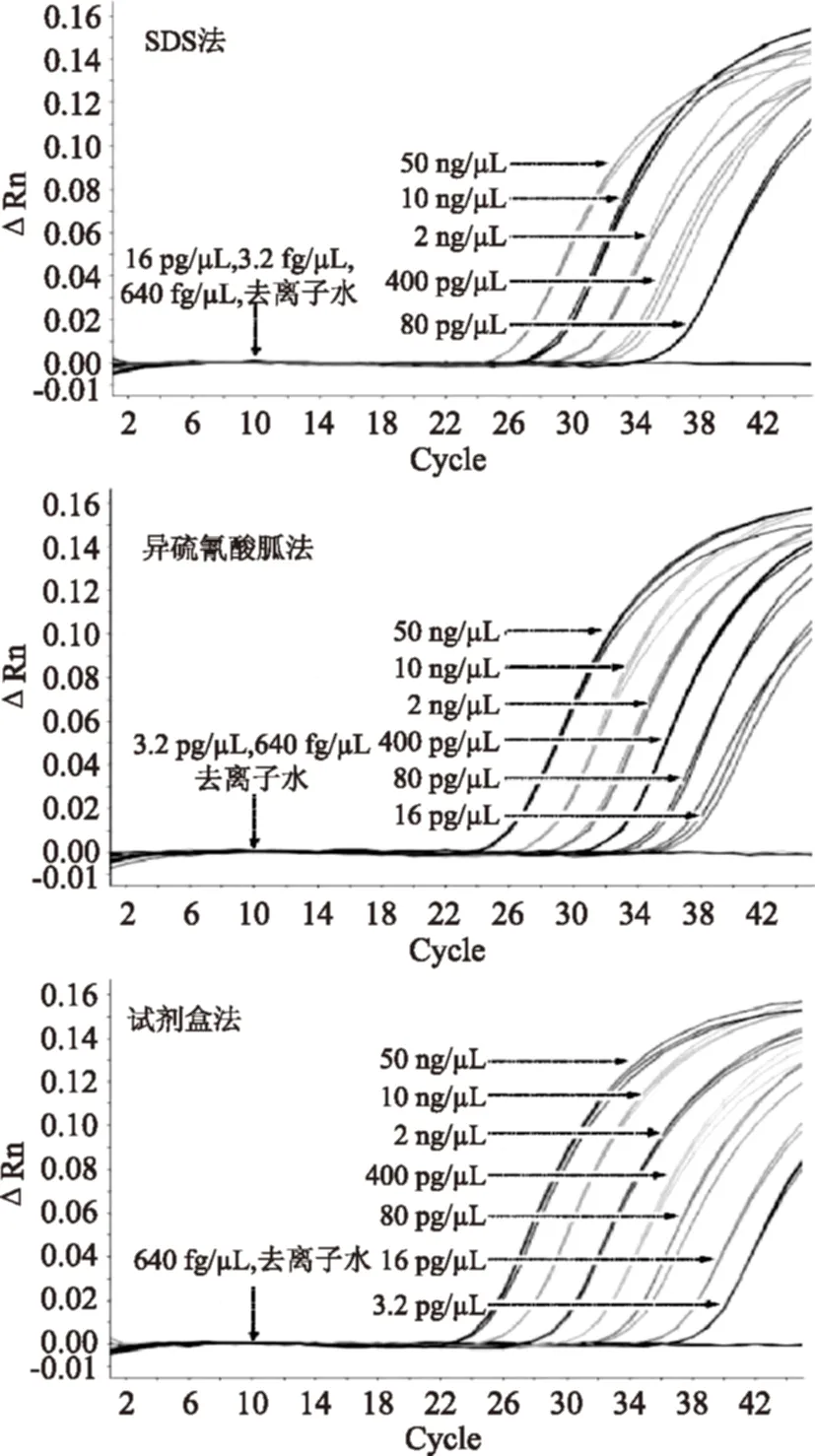
图4 猪源性成分方法灵敏度研究荧光扩增曲线Fig.4 Fluorescent amplification curve of pig-derived ingredients sensitivity research method
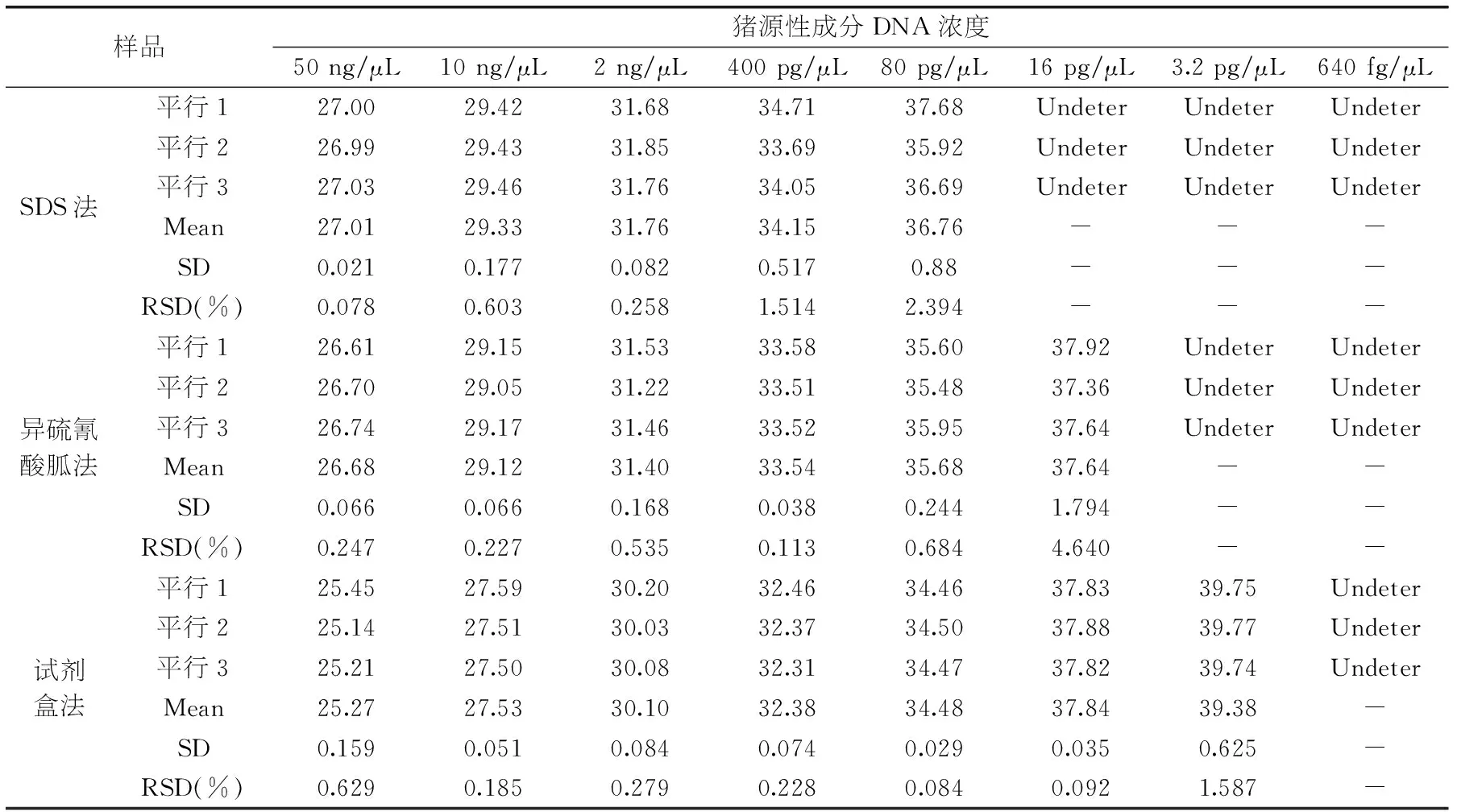
表5 猪源性成分灵敏度检测结果Ct值
2.3.2猪源性成分方法灵敏度研究以浓度为50、10、2 ng/μL、400、80、16、3.2 pg/μL、640 fg/μL的猪源性成分DNA样本作为模板时,三种提取方法的猪源性成分灵敏度检测结果Ct值如图4,表5所示。参照《实时荧光定量国际化标准—MIQE指南》,虽然本实验室研发的试剂盒法在3.2 pg/μL有扩增曲线,但经过重复实验Ct值>40,视为无效扩增。因此SDS法的最低检出限为80 pg/μL,异硫氰酸胍法和本实验室研发的试剂盒法的最低检出限均为16 pg/μL,空白对照及阴性对照均正常。相对标准偏差均小于25%,在可接受的范围之内,具有良好的重复性和重现性,但对于检出限都是16 pg/μL的试剂盒法,其相对标准偏差RSD 0.092%小于异硫酸氰胍法的相对标准偏差RSD 4.640%,试剂盒法表现出更加稳定的重复性。
2.3.3鸡源性成分方法灵敏度研究以浓度为50、10、2 ng/μL、400、80、16、3.2 pg/μL、640 fg/μL的鸡源性成分DNA样本作为模板时,三种提取方法的鸡源性成分灵敏度检测结果Ct值如图5,表6所示。参照《实时荧光定量国际化标准—MIQE指南》,SDS法和异硫氰酸胍法的最低检出限均为3.2 pg/μL,本实验室研发的试剂盒法的最低检出限为640 fg/μL,空白对照及阴性对照均正常。相对标准偏差RSD均小于25%,在可接受的范围之内,具有良好的重复性和重现性。
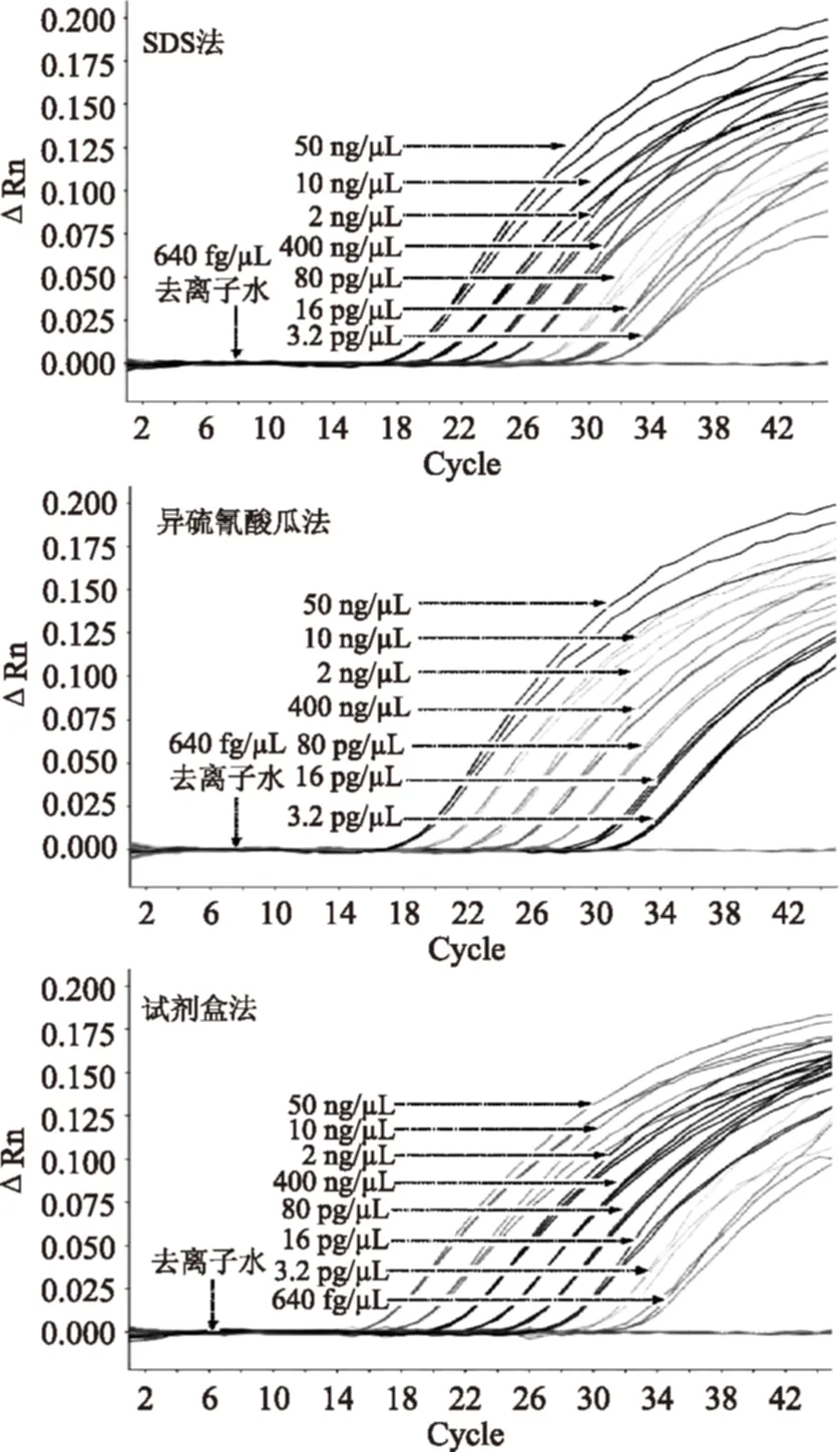
图5 鸡源性成分方法灵敏度研究荧光扩增曲线Fig.5 Fluorescent amplification curve of chicken-derived ingredients sensitivity research method
3 讨论与结论
近年来,以DNA为基础的PCR技术已经被广泛用来鉴定食品中的动物源性成分鉴别[9-11],而高质量、高纯度及结构完整的基因组DNA是影响PCR扩增的重要因素,因此快速、稳定、优质的DNA提取方法能成为PCR扩增成功的关键。
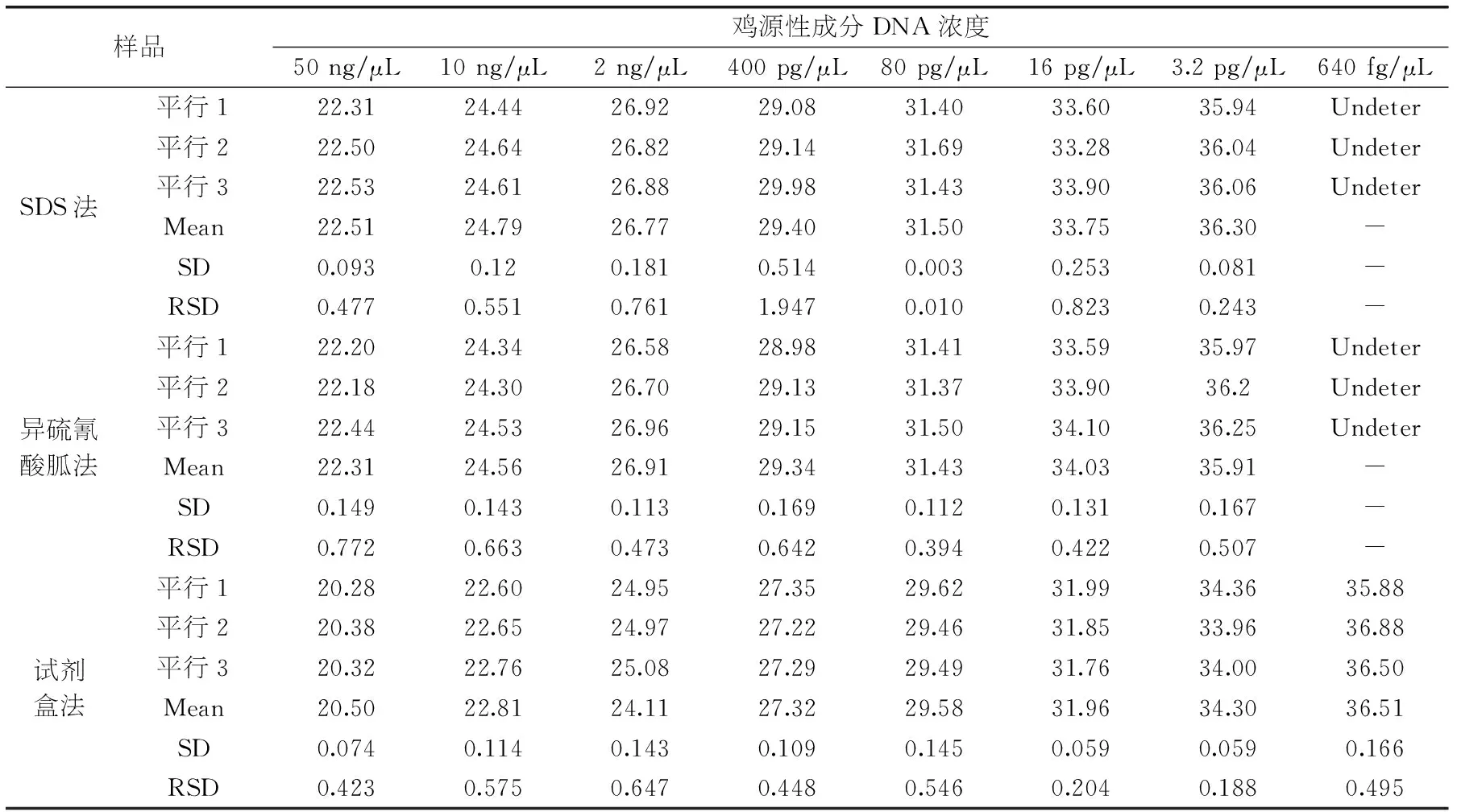
表6 鸡源性成分灵敏度检测结果Ct值
对于样品的预处理,本实验采用液态氮进行冷冻研磨,有效地防止了DNA的降解和断裂,保证了DNA的完整性。对于样品的DNA提取方法,SDS法和异硫氰酸胍法操作步骤复杂,而且提取过程中使用了大量的酚氯仿等有机溶剂,损害了实验人员的健康。本实验室研发的试剂盒提取法在2 h内即可完成样品DNA提取的全过程,所提取的DNA质量标准满足了后续PCR扩增的要求,同时避免了SDS法或异硫酸氰胍法提取过程中各种有机试剂对实验人员的危害,而且时间上也得到了很大的提升,更适合于动物源性成分鉴定过程中高效快速提取样品DNA的目的,具有高效、快速、低成本、操作简便、无毒安全等优势。
本实验中分别用三种方法提取生鲜羊肉、猪肉和鸡肉DNA,并对不同质量浓度梯度的标准品(50%、10%、5%、1%)建立标准曲线,这三类动物源成分提取的DNA通过荧光信号的检测和比较,试剂盒法提取DNA建立的标准曲线的扩增效率和R2均优于SDS法和异硫氰酸胍法。综上所述,采用SDS法、异硫氰酸胍法和试剂盒法提取的动物肌肉组织基因组DNA,虽然均可满足PCR等后继分子生物学实验的要求,但是试剂盒法在基因组的纯度和浓度及稳定性方面均优于其他两个方法,为以后运用实时荧光PCR技术进行动物源性成分检测提供了一个简单、快速、高效的DNA提取方法。
[1]Brodmann PD,Moor D.Sensitive and semi-quantitative Taq Man TM real-time polymerase chain reaction systems for thedetection of beef(Bos Taurus)and the detection of the family Mammalian in food and feed[J].Meat Science,2003(65):599-607.
[2]潘良文,陈家华,丁燕,等. 进口肉骨粉中牛成分检测研究[J]. 生物技术通报,2001(5):23-26.
[3]徐伟丽,杜明,李启,等. 动物肌肉组织基因组DNA两种提取方法的比较[J].食品工业科技,2011,12:81-84.
[4]杨利丽,刘红英,杨和军,等. 一种改进的异硫氰酸胍法结合硅胶膜离心吸附柱提取孕妇外周血微量胎儿RNA的方法[J].中国生物化学与分子生物学报,2012(2):177-181.
[5]高丹丹,陈燕,王迎华,等.动物肉制品基因组DNA的提取和纯化[J].食品科技,2007(8):42-44.
[6]Köppel R,Ruf J,Rentsch J. Multiplex real-time PCR for the detection and quantification of DNA from beef,pork,horse and sheep[J]. European Food Research and Technology,2011,232(1):151-155.
[7]鲍毅新,孙波,张龙龙,等.对动物组织DNA提取方法的改进及PCR检测[J].浙江师范大学学报,自然科学版,2009,32(3):317-321.
[8]邵碧英,杨婕,张体银.动物产品的DNA提取方法[J].畜牧与兽医,2005,37(9):47-49.
[9]周正,吕二盼,周巍,等.动物源性食品鸭血、猪血DNA提取方法研究及双重PCR检测[J].食品工业,20012(33):161-166.
[10]钟伟军,陈金顶. PCR检测饲料中牛源组织成分的研究[J]. 华南农业大学学报,2006,27(3):33-36.
[11]汪永信,安虹,程坚,等. 双重实时荧光PCR法检测食品和饲料中的鸡源性成分[J]. 生物技术通报,2012(5):134-138.
The method of DNA extraction from animal muscle tissue and real-time PCR detection
LIU Na,ZHAO Xin+,CHEN Rui,WANG Cheng,ZHU Zhu,WANG Yong,LAN Qing-kuo*
(Institute of Tianjin Agriculture Quality Standard and Testing Technology,Tianjin 300381,China)
Genomic DNA of muscle tissues from fresh mutton,pork,chicken,beef,duck were extracted through SDS method,GuSCN method and kit method .The DNA was detected by agarosegel electrophoresis and real-time PCR method. Results indicated that the kit method improved better concentration and purity of DNA than SDS method and GuSCN method. By comparing the three extraction methods to establish standard curve,the sorted according to the quality of the regression coefficients:kit method≥GuSCN method>SDS method. The amplification efficiency according to the sorting for quality was kit method≥GuSCN method>SDS method. The detection sensitivity of sheep-derived ingredients sensitivity by three Extraction Methods,the minimum detection limits were 80 pg/μL,but in the low-concentration detecting the relative standard deviation(RSD)of the kit method 0.684% was less than GuSCN method 0.734% and SDS method 1.075%. The detection of pig-derived ingredients sensitivity,the minimum detection limit of SDS method was 80 pg/μL. The minimum detection limit of GuSCN method and kit method were 16 pg/μL,but in the low-concentration detecting the relative standard deviation(RSD)of the kit method 0.092% was less than GuSCN method 4.640%. The detection of chicken-derived ingredients sensitivity,the minimum detection limit of SDS method and GuSCN method were 3.2 pg/μL,the minimum detection limit of kit method was 640 fg/μL. Above all,the genomic DNA from kit method was more conducive to use the real-time PCR technique in food adulteration and species identification.
animal muscle;SDS method;GuSCN method;kit method;DNA;Real-time PCR
2016-03-08+并列第一作者。
刘娜(1987-),女,大学本科,研究实习员,研究方向:农产品分子检测技术研究,E-mail:zhaoxin2008999@126.com。
赵新(1983-),女,硕士,助理研究员,研究方向:农产品分子检测技术研究,E-mail:zhaoxin2008999@163.com。
兰青阔(1980-),男,硕士,副研究员,研究方向:农产品安全质量分子检测技术,E-mail:lanqingkuo@163.com。
天津市应用基础与前沿技术研究计划(14JCQNJC14800)资助。
TS251.1
A
1002-0306(2016)18-0074-07
10.13386/j.issn1002-0306.2016.18.006

