超临界CO2萃取脂质对南极磷虾肌原纤维蛋白理化性质的影响
王晓龙,冯晓梅,隋 晓,席 璇,韩玉谦,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.青岛大学生物系,山东青岛 266071)
超临界CO2萃取脂质对南极磷虾肌原纤维蛋白理化性质的影响
王晓龙1,冯晓梅1,隋晓2,席璇1,韩玉谦1,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.青岛大学生物系,山东青岛 266071)
通过研究南极磷虾肌原纤维蛋白经超临界CO2萃取脂质后的理化性质变化特点及规律,为南极磷虾深加工提供基础数据。在15~25 MPa,35~55 ℃,2 h以及15 MPa,35 ℃,1~3 h的实验条件下,考察了经过萃取脂质后的肌原纤维蛋白的巯基数量、Ca2+-ATPase活性、表面疏水性变化并结合SDS-PAGE电泳,研究超临界CO2萃取南极磷虾脂质对肌原纤维蛋白理化性质的影响情况。结果表明,南极磷虾肌原纤维蛋白总巯基数量和Ca2+-ATPase活性随温度、压力和时间的增加而下降;表面疏水性随温度、压力和时间的增加而上升;巯基数量与Ca2+-ATPase活性的下降主要发生在0~1 h内,而表面疏水性的上升主要发生在1~2 h内;SDS-PAGE电泳图显示经过超临界CO2萃取脂质后的蛋白条带略有变浅,说明超临界萃取处理会使南极磷虾肌原纤维蛋白的结构发生变化,产生新的作用键。经过超临界萃取处理后,肌原纤维蛋白巯基的氧化、二硫键的生成和表面疏水性的提高以及其他作用键的形成均有利于改善蛋白的乳化和凝胶等功能性质,这对南极磷虾的加工及利用有重要意义。
超临界流体萃取,南极磷虾,肌原纤维蛋白,理化性质,影响
南极磷虾是一种生活在南极水域的甲壳类浮游生物,其生物资源量巨大,含有丰富的营养成分,营养价值十分丰富。南极磷虾含有丰富的蛋白质,是一种优质的蛋白资源[1]。同时,南极磷虾的脂肪含量也很可观,脂质中多不饱和脂肪酸含量较高,富含磷脂型EPA、DHA,具有较好的医药保健功能[2]。此外,南极磷虾还含有丰富的类胡萝卜素、虾青素和脂溶性维生素(如维生素A、维生素E)[2-3]。近年来,南极磷虾已经成为食品、医学和药学等学科的研究热点之一[4]。
目前南极磷虾脂质的提取主要采用的有机溶剂中通常含有氯仿和甲醇[5],但会产生有机溶剂,且用量大、残留多,导致蛋白变性、失去部分功能性质[6]等问题。近年来,超临界CO2作为一种新兴的技术受到人们的重视,CO2具有无毒、廉价、易得、临界压力和温度都不太高等优点,有利于在温和的条件下提取脂质。许多油脂化工反应都可以在超临界CO2中进行,关于超临界流体在脂类萃取、分级方面的研究已有详细的报道[7-8]。目前,超临界CO2已用于磷虾等海洋生物的脂质萃取,Yamaguchi[9]等人采用超临界CO2从南极磷虾中萃取出脂质并进行了分析。
肌原纤维蛋白是肌肉蛋白质的重要组成部分,在肉制品加工过程中,虽然肌浆蛋白和基质蛋白也对肉制品的风味等起到一定的作用,但是肌肉中主要起作用的蛋白是肌原纤维蛋白,肌原纤维蛋白的性质是由肌原纤维蛋白的结构体现出来,蛋白与蛋白、蛋白和水之间的作用形成的肌原纤维蛋白凝胶,在溶液界面是肌原纤维蛋白的性质改变,直接影响蛋白的感官性质(肉制品的弹性、多汁性、口感等)[10]。
肌原纤维蛋白在不同的环境和加工条件下,通常表现出不同的特性[11]。经过超临界CO2萃取脂质后的南极磷虾肌原纤维蛋白会表现出一些特性,有利于在食品和工业中的进一步利用。本文通过考察肌原纤维蛋白的巯基数量,Ca2+-ATPase活性,表面疏水性并结合SDS-PAGE电泳研究南极磷虾肌原纤维蛋白经超临界CO2萃取脂质后的变化特点及规律,为南极磷虾加工及利用提供基础数据。
1 材料与方法
1.1材料与仪器
南极磷虾肉由中国水产科学研究院东海水产研究所提供,冷冻运至实验室,-20 ℃冰箱保存,实验前解冻粉碎;正己烷、三羟甲基氨基甲烷(Tris)、马来酸、氯化钠、三氯乙酸、盐酸购于国药;尿素、乙二胺四乙酸(EDTA)、三磷酸腺苷二钠、5,5′-二硫代双(2-硝基苯甲酸)(DTNB)、8-苯胺萘磺-1-酸盐(ANS)、十二烷基硫酸钠(SDS)等试剂来自索莱宝,均为分析纯。
SFE121-50-02超临界萃取装置江苏南通华兴石油仪器有限公司;粉碎机上海梅香仪器有限公司;乳化分散均质机IKA T18 basic;JY-SCZ2+型双垂直电泳槽北京六一生物科技有限公司;旋转蒸发器上海亚荣生化仪器厂;紫外分光光度计上海元析仪器有限公司;F-4600荧光光谱仪Hitachi。
1.2实验方法
1.2.1超临界CO2萃取南极磷虾脂质20 g南极磷虾肉放入到1 L的萃取釜中,萃取釜采用不锈钢材质,温度控制采用循环水浴,压力由高压泵打压、调节阀控制,采用15~25 MPa的压力,35~55 ℃的温度,时间2 h以及15 MPa,35 ℃,1~3 h对南极磷虾肉进行萃取,用正己烷进行收集,将油水混合物分层,取有机层40 ℃旋蒸得到南极磷虾脂质。经超临界CO2萃取脂质后的样品存放在-80 ℃的冰箱中,待分析。
1.2.2南极磷虾肌原纤维蛋白的提取肌原纤维蛋白的提取参考文献[12],并稍作修改。取5 g处理后的南极磷虾肉,加入40 mL pH7.0的Tris马来酸缓冲液,均质1 min,静置1 h,4 ℃下6000×g离心10 min,重复三次。然后将8倍体积的含0.6 mol/L 氯化钠的pH7.0的Tris马来酸缓冲液加入到沉淀中,均质1 min后放入到4 ℃冰箱静置1 h,6000×g离心20 min,取上清液作为肌原纤维蛋白溶液。采用双缩脲法对蛋白质浓度进行测定,用牛血清白蛋白作为标准蛋白。
1.2.3肌原纤维蛋白巯基数量的测定巯基数量的测定参考文献[13-14],并稍作修改。肌原纤维蛋白溶液浓度调至2 mg/mL,取0.5 mL蛋白溶液,加入4.5 mL 0.2 mol Tris-HCI缓冲液(含8 mol/L尿素,2% SDS,10 mmol/L EDTA,pH6.8),取4 mL混合液,加入0.5 mL 0.1% DTNB-Tris-HCI缓冲液,40 ℃反应20 min,在412 nm下测定吸光度。
巯基数量(mol/10000 g)=AD/BC
式中,A为吸光度,B为蛋白浓度mg/mL,C为分子吸光系数,C=13600 L/mol·cm,D为稀释倍数,蛋白浓度为2 mg/mL。
1.2.4肌原纤维蛋白Ca2+-ATPase活性的测定Ca2+-ATPase活性的测定参考文献[13],并稍作修改。肌原纤维蛋白溶液调至2 mg/mL,取0.5 mL蛋白溶液,依次加入0.25 mL pH7.0的Tris马来酸缓冲液、025 mL 0.1 mol/L CaCI2溶液,3.75 mL去离子水,0.25 mL 20 mmol/L ATP溶液,25 ℃反应3 min,加入2.5 mL 15% TCA终止反应,反应液6000 r/min离心5 min,取上清液采用钼蓝比色法测定无机磷的含量。
Ca2+-ATPase活性(μmol Pi/mg·min)=m/t·M
式中,m为生成的无机磷含量(μmol),t为反应时间(min),M表示肌原纤维蛋白的含量。
1.2.5肌原纤维蛋白表面疏水性的测定表面疏水性的测定参考文献[15],并稍作修改。蛋白溶液分别稀释到0.125、0.25、0.5、1 mg/mL,分别取2 mL,加入10 μL含8 mmol/L ANS的pH7.0的0.1 mol/L磷酸缓冲液,暗反应10 min,在激发波长390,发射波长470,狭缝5 nm的条件下测定荧光强度,表面疏水性S0以荧光强度与蛋白浓度对应曲线的斜率表示。
1.2.6肌原纤维蛋白SDS-PAGE的研究SDS-PAGE参考文献[16],并稍作修改。肌原纤维蛋白溶液浓度调至4 mg/mL,采用浓缩胶浓度5%,分离胶浓度12%,上样量为10 μL。电压80 V,待染料前端跑到分离胶时,加大电压到120 V,直至电泳完成,电泳后凝胶用考马斯亮蓝R250染色,经脱色后,进行凝胶成像。
1.2.7数据处理每组实验进行三次,采用平均值。使用SPSS19.0软件(IBM公司,USA)对数据进行分析(Turkey HSD),对于每个参数,计算其在95%的置信区间内的显著性差异。
2 结果与分析
2.1超临界CO2萃取对肌原纤维蛋白巯基数量的影响
萃取温度和压力对肌原纤维蛋白巯基数量的影响如图1,未经超临界萃取处理的样品肌原纤维蛋白巯基数量为2.05×10-5mol/g。经过萃取处理的样品巯基数量随温度和压力的升高而下降,在25 MPa、55 ℃达到最小值1.11×10-5mol/g,而在15 MPa、35 ℃的条件下具有最大值1.69×10-5mol/g。巯基数量的下降可能是由于肌原纤维蛋白在超临界萃取脂质过程中巯基基团暴露,氧化聚集,形成了二硫键[17],随着温度和压力的升高,蛋白进一步发生了变性和展开,从而使巯基数量不断下降。经过处理的样品巯基数量在15 MPa、35 ℃时具有最大值,说明此条件下超临界CO2对样品肌原纤维蛋白的影响最小,因此研究萃取时间对肌原纤维蛋白巯基数量的影响选择在15 MPa、35 ℃、1~3 h的条件下进行。

图1 萃取温度和压力对肌原纤维蛋白巯基数量的影响Fig.1 Effect of temperature and pressure on sulphydryl content of myofibrillar proteins注:定义25 ℃时样品的巯基数量为未处理样品的巯基数量;图3、5同。
萃取时间对肌原纤维蛋白巯基数量的影响如图2,肌原纤维蛋白巯基数量随着时间的延长呈现下降的趋势,与未处理样品相比,处理1、2、3 h的样品巯基数量分别下降了13.7%,17.6%,20.5%。根据两点之间的斜率进行比较,可以发现巯基数量的下降主要发生在萃取过程的1 h内,说明蛋白结构的变化主要发生在萃取过程的开始阶段,从而使得巯基数量下降。这可能是由于在超临界萃取过程中的1 h内脂质提取的量较高,大量的脂肪被除去,超临界CO2与肌原纤维蛋白的接触面积增大,CO2对蛋白的作用增强,使得肌原纤维蛋白的大部分巯基暴露,更容易被氧化,从而导致巯基数量主要下降发生在萃取的1 h内。

图2 萃取时间对肌原纤维蛋白巯基数量的影响Fig.2 Effect of time on sulphydryl content of myofibrillar proteins注:相同小写字母表示差异不显著(p>0.05),不同小写字母表示差异显著(p<0.05);图4、6同。
巯基氧化、巯基/二硫键交换等反应产生的蛋白质分子间的二硫键将对食品的功能性质产生影响。一方面,吸附于空气-水界面或油-水界面的蛋白质所形成的二硫键交联网络结构对于稳定乳状液和气泡具有重要作用[18],乳液界面蛋白质形成的分子间二硫键,增强吸附蛋白质的表面粘弹性,增大乳液粘度[19]。另一方面,在凝胶结构中蛋白分子间二硫键交联具有增强凝胶弹性和强度的作用,肌球蛋白和肌动蛋白含有丰富的巯基,经氧化剂诱导形成二硫键交联增强了肉制品的凝胶性[20]。因此,巯基氧化,二硫键的生成有利于肌原纤维蛋白乳化性质和凝胶性质的提高。
2.2超临界CO2萃取对肌原纤维蛋白Ca2+-ATPase活性的影响
超临界CO2萃取脂质对肌原纤维蛋白Ca2+-ATPase活性的影响如图3和图4。未经超临界萃取处理的样品Ca2+-ATPase活性为0.25 μmol Pi/mg·min,随着温度和压力的升高,Ca2+-ATPase活性也呈现了下降的趋势,与巯基数量相似,并在25 MPa,55 ℃的条件下达到最小值0.06 μmol Pi/mg·min,这是因为蛋白质氧化和巯基数量的下降与Ca2+-ATPase活性的丧失密切相关[21]。

图3 萃取温度和压力对肌原纤维蛋白Ca2+-ATPase活性的影响Fig.3 Effect of temperatue and pressure on Ca2+-ATPase activity of myofibrillar proteins
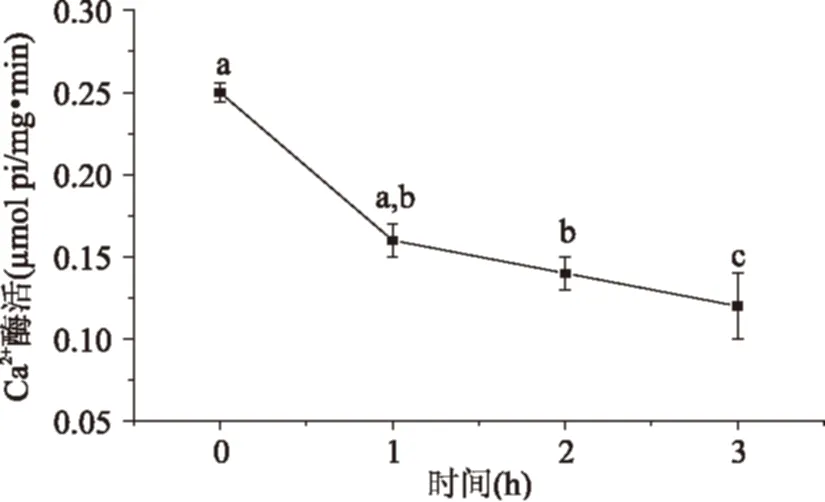
图4 萃取时间对肌原纤维蛋白Ca2+-ATPase活性的影响Fig.4 Effect of time on Ca2+-ATPase activity of myofibrillar proteins
Ca2+-ATPase活性是一个表征肌凝蛋白完整性的良好指标[22],因为肌凝蛋白的球状头部具有Ca2+-ATPase活性。Ca2+-ATPase活性是肌球蛋白的最主要特性,反映肌球蛋白的生化活性,与肌球蛋白的生物功能、凝胶形成有一定的关系。Ca2+-ATPase活性的下降可能是由于肌凝蛋白的球状头部构象变化,发生聚合,以及蛋白质通过蛋白质之间的相互作用产生了重排[13]。位于肌凝蛋白头部的巯基(SH1、SH2)对Ca2+-ATPase活性具有重要作用[23],这部分巯基的氧化会导致Ca2+-ATPase活性的下降。超临界萃取脂质过程中随着温度和压力的升高,Ca2+-ATPase活性下降,说明蛋白质的头部结构发生变化,巯基暴露氧化,形成了二硫键,有利于改善蛋白质的乳化和凝胶等功能性质。
随着时间的延长,肌原纤维蛋白的Ca2+-ATPase活性显著下降,与未处理样品相比,在经过萃取1、2、3 h后分别下降了36%、44%、52%,与巯基数量受萃取时间影响类似,Ca2+-ATPase活性的下降主要发生在1 h内。在本实验的条件范围内,Ca2+-ATPase活性下降最大发生在25 MPa、55 ℃时,此时相比未处理样品,肌原纤维蛋白巯基数量下降了76%,这说明经过超临界萃取处理后的肌凝蛋白大部分构象发生了变化,但仍有部分保持一定的结构和活性。肌凝蛋白对凝胶的形成具有重要作用,经过超临界萃取处理后Ca2+-ATPase活性下降,巯基氧化,生成了二硫键,可能会使其乳化和凝胶等功能性质得到提高。
2.3超临界CO2萃取对肌原纤维蛋白表面疏水性的影响
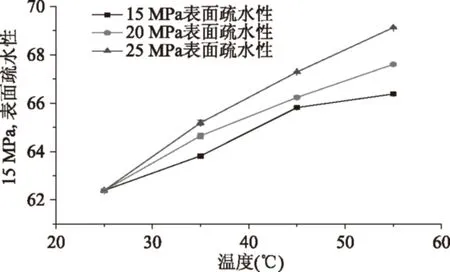
图5 萃取温度和压力对肌原纤维蛋白表面疏水性的影响Fig.5 Effect of temperature and pressure on surface hydrophobicity of myofibrillar proteins
ANS是一种有效的荧光探针,用来检测蛋白质分子结构的变化[24]。萃取温度和压力对肌原纤维蛋白表面疏水性的影响如图5,未经超临界萃取处理的样品表面疏水性为62.39,随着温度和压力的升高,肌原纤维蛋白的表面疏水性呈现上升的趋势,在25 MPa、55 ℃时表面疏水性达到最大值69.13。表面疏水性的增加说明肌原纤维蛋白的结构和构象在超临界萃取脂质过程中发生变化,导致疏水基团变得更加暴露,结合了ANS[25]。Temelli[26]等人研究了超临界CO2萃取大西洋鲭鱼脂质后蛋白质理化性质的变化,发现经过超临界CO2萃取脂质后蛋白的系水能力有所增强,说明萃取脂质使得蛋白质表面结合部位发生变化,从而增强了蛋白质的疏水性。
萃取时间对肌原纤维蛋白表面疏水性的影响如图6,随着时间的延长,蛋白的表面疏水性升高,不同于巯基数量与Ca2+-ATPase活性,表面疏水性在1~2 h内增加最多,这可能是由于1~2 h内脂质提取率最高,较高脂肪的去除量使蛋白表面结合部分发生较大的变化,从而使蛋白疏水性增加最多。

图6 萃取时间对肌原纤维蛋白表面疏水性的影响Fig.6 Effect of time on surfacehydrophobicity of myofibrillar proteins
疏水作用的增加,说明了蛋白质结构的变化使疏水基团出现在分子的表面,形成了疏水相互作用,减少了自由能,疏水作用参与了胶凝过程[27],并且疏水基团在胶凝过程中起很重要的作用[28]。因此表面疏水性的增加有利于蛋白质凝胶性质的改善和提高。Smaeijma等则发现在肌球蛋白胶凝过程中,头部的聚集与疏基有关,而尾部的聚集主要是非共价键如氢键、疏水相互作用在起作用[29]。
2.4超临界CO2萃取对肌原纤维蛋白SDS-PAGE影响
SDS-PAGE图像显示南极磷虾肌原纤维蛋白主要由肌球蛋白重链、肌动蛋白、肌钙蛋白T、原肌球蛋白、肌球蛋白轻链组成,各个蛋白的分子量大约分别为220、43、37、35、17~20 ku。随着温度和压力的升高,肌原纤维各蛋白条带逐渐变浅,可能是由于肌原纤维蛋白在脂质萃取过程中受到超临界CO2的影响,形成新的疏水键、氢键、二硫键,小分子量的蛋白发生聚集,形成了大分子量的蛋白。Temelli[26]在研究超临界CO2萃取大西洋鲭鱼脂质后各分子量蛋白变化时,发现分子量<100 ku的蛋白含量均有减少,>100 ku蛋白含量有所上升,其中以220 ku上升为主。随着时间的延长,肌原纤维蛋白的条带略有变浅,这是因为肌原纤维蛋白在脂质萃取过程中受到超临界CO2的影响,发生了部分变性。本实验中肌原纤维各小分子蛋白条带随温度和压力的升高、时间的延长略有变浅,这与上述的研究结果一致,但未见高分子量蛋白条带的形成,这可能是由于形成的高分子量蛋白较少,在电泳条带中不明显。经过萃取处理后新形成的一些键对凝胶的形成具有重要的作用,氢键在水凝胶稳定结合水方面发挥重要作用,蛋白分子表面极性氨基酸基团的暴露,造成大量的水分子与其进行键合。二硫键是巯基氧化形成的,有利于稳定乳液和增强凝胶强度,而疏水相互作用力则是一个热动力学事件,主要由于蛋白变性造成疏水位点暴露引起[30],疏水作用的增强有利于蛋白质凝胶性质的改善和提高。
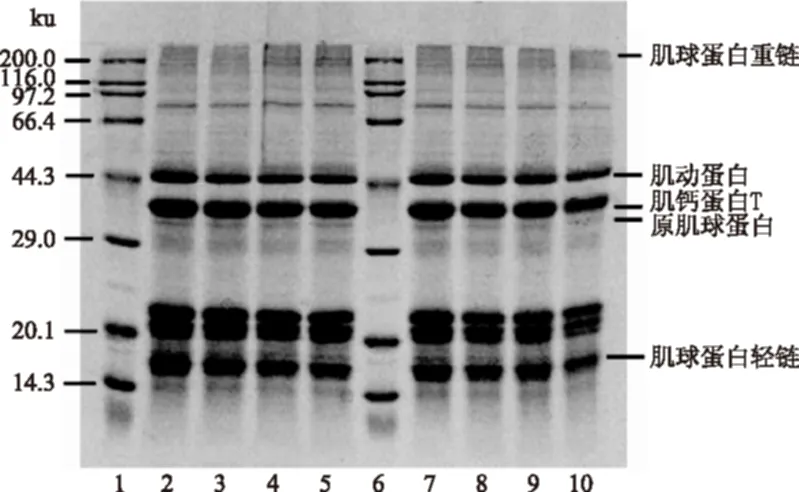
图7 15 MPa下不同时间和温度的肌原纤维蛋白SDS-PAGE电泳Fig.7 SDS-PAGE analysis of myofibrillar proteinsunder different time and temperatures of 15 MPa注:1,6为Marker;2,7为未处理样品;3~5分别为15 MPa,35 ℃,1、2、3 h处理下的蛋白条带,8~10分别为15 MPa,2 h,35、45、55 ℃处理下的蛋白条带。
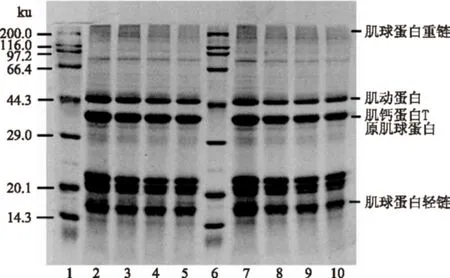
图8 20 MPa和25 MPa 下不同温度的肌原纤维蛋白SDS-PAGE电泳Fig.8 SDS-PAGE analysis of myofibrillar proteinsunder different temperatures of 20 and 25 MPa注:1,6为Marker;2,7为未处理样品;3~5分别为20 MPa,2 h,35、45、55 ℃处理下的蛋白条带;8~10分别为25 MPa,2 h,35、45、55 ℃处理下的蛋白条带。
Ai-Nehari[31]研究南极磷虾经超临界CO2萃取脂质后消化酶电泳条带的变化后发现,未经处理的样品蛋白条带与超临界CO2萃取脂质后的蛋白条带基本一致,认为超临界萃取脂质过程中蛋白没有变性。这与本实验的结果有所不同,本实验中通过超临界萃取处理后的蛋白条带虽与原样相比基本一致,但略有变浅,造成这种不同的原因可能是由于本实验采用的原料是新鲜的南极磷虾,水分含量高于上述研究采用的干燥的磷虾,大量水分的存在可能会使蛋白结构发生更大的变化。蛋白条带的变浅说明蛋白在超临界萃取过程中发生了部分变性,超临界萃取处理会使南极磷虾肌原纤维蛋白的结构发生变化,生成新的疏水键、氢键、二硫键,从而提高蛋白的乳化和凝胶等功能性质,这对南极磷虾的加工及利用有重要意义。
3 结论
本文通过研究超临界萃取脂质后南极磷虾肌原纤维理化性质的变化,为南极磷虾加工利用提供基础数据。经过超临界萃取脂质处理后,南极磷虾蛋白的巯基数量和Ca2+-ATPase活性均有所下降,在25 MPa、55 ℃达到最小值。表面疏水性有所升高,也在25 MPa、55 ℃达到最大值。巯基数量和与Ca2+-ATPase活性的下降主要发生在0~1 h内,而表面疏水性的上升主要发生在1~2 h内。SDS-PAGE电泳图显示超临界萃取脂质后的蛋白条带有所变浅,说明超临界萃取会使蛋白结构发生变化,产生新的作用键。巯基氧化、二硫键的生成,表面疏水性的升高以及其他作用键的形成有利于改善蛋白的乳化和凝胶性质,说明经过超临界萃取处理后的南极磷虾肌原纤维蛋白乳化和凝胶等功能性质会得到改善,有利于南极磷虾的进一步加工和利用。
[1]孙雷,周德庆,盛晓风. 南极磷虾营养评价与安全性研究[J]. 海洋水产研究,2008(2):57-64.
[2]田晓清,杨桥,邵盛男,等. 南极磷虾脂溶性成分的研究进展[J]. 海洋渔业,2011(4):462-6.
[3]Quetin L,Ross R,Clarke A. Krill energetics:seasonal and environmental aspects of the physiology of Euphausia superba[J]. Southern ocean ecology:The BIOMASS perspective,1994:165-84.
[4]孙松,刘永芹. 南极磷虾与南大洋生态系统[J]. 自然杂志,2009(2):88-90,104.
[5]Bligh EG,Dyer WJ. A rapid method of total lipid extraction and purification[J]. Canadian journal of biochemistry and physiology,1959,37(8):911-7.
[6]Pariser ER. Fish protein concentrate,panacea for protein malnutrition[M]. Cambridge,mass:MIT Press,1978.
[7]Sahena F,Zaidul I,Jinap S,et al. Application of supercritical CO2in lipid extraction-a review[J]. Journal of Food Engineering,2009,95(2):240-53.
[8]周泉诚,吴谋成. 超临界CO2萃取技术在油脂工业中的应用[J]. 中国油脂,2003(3):17-20.
[9]Yamaguchi K,Murakami M,Nakano H,et al. Supercritical carbon dioxide extraction of oils from Antarctic krill[J]. Journal of Agricultural and Food Chemistry,1986,34(5):904-7.
[10]Pearson A,Young R. Post-mortem changes during conversion of muscle to meat[J]. Muscle and meat biochemistry,1989:391-444.
[11]罗永康,潘道东,沈慧星,等. 蛋白质浓度、pH、离子强度对鲢鱼肌原纤维蛋白粘度的影响[J]. 食品与发酵工业,2004(7):52-4.
[12]Pan J,Shen H,You J,et al. Changes in physiochemical properties of myofibrillar protein from silver carp(Hypophthalmichthys mollitrix)during heat treatment[J]. Journal of Food Biochemistry,2011,35(3):939-52.
[13]Benjakul S,Seymour TA,MORRISSEY MT,et al. Physicochemical changes in Pacific whiting muscle proteins during iced storage[J]. Journal of Food science,1997,62(4):729-33.
[14]Ellman GL. Tissue sulfhydryl groups[J]. Archives of biochemistry and biophysics,1959,82(1):70-77.
[15]Wang H,Pato MD,Shand PJ. Biochemical properties of natural actomyosin extracted from normal and pale,soft,and exudative pork loin after frozen storage[J]. Journal of food science,2005,70(4):C313-C20.
[16]Mine Y,Noutomi T,Haga N. Thermally induced changes in egg white proteins[J]. Journal of Agricultural and Food Chemistry,1990,38(12):2122-2125.
[17]Tadpitchayangkoon P,Park JW,Yongsawatdigul J. Conformational changes and dynamic rheological properties of fish sarcoplasmic proteins treated at various pHs[J]. Food chemistry,2010,121(4):1046-1052.
[18]Kudryashova E V,Meinders M B J,Visser A J W G,et al. Structure and dynamics of egg white ovalbumin adsorbed at the air/water interface[J]. Eur Biophys,2003,32:553-562.
[19]Mcclements D J,Monahan F J,Kinsella J E. Disulfide bond formation affects stability of whey protein isolate emulsions[J]. J Food Sci,1993,58(5):1036-1039.
[20]Liu G,Butterfield D A,Xiong Y L. Chemical,physical,and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolates[J]. J Food Sci,2000:811-818.
[21]BM Klebl,AT Ayoub,D Pette. Protein oxidation,tyrosine nitration,and inactivation of sarcoplasmic reticulum Ca2+-ATPase in low-frequency stimulated rabbit muscle[J]. FEBS Letters,1998,422(3):381-384.
[22]Benjakul S,Visessanguan W,Thongkaew C,et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Research International,2003,36(8):787-795.
[23]Kielley W W,Bradley L B. The relationship between sulfydryl groups and the activation of myosin adenosinetriphosphatase[J]. The Journal of Biological Chemistry,1956,218:653-659.
[24]Van der Plancken I,Van Loey A,Hendrickx ME. Effect of heat-treatment on the physico-chemical properties of egg white proteins:A kinetic study[J]. Journal of Food Engineering,2006,75(3):316-326.
[25]Visessanguan W,Ogawa M,Nakai S,et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J]. Journal of Agricultural and Food Chemistry,2000,48(4):1016-1023.
[26]Temelli F,Leblanc E,Fu L,et al. Effect of supercritical CO2extraction of oil on physicochemical properties of residual Atlantic mackerel(Scomber scombrus)proteins[J]. Journal of Muscle Foods,1998,9(2):57-73.
[27]Benjakul S,Visessanguan W,Ishizaki S,etal. Differences in gelation characteristics of natural actomyosin from two species of bigeye snappr,priacathus tayenus and priacanthus macracanthus[J]. J Food Sci,2001,66:1311-1318.
[28]Liu Y M,Lin T S,Lanier T C. Thermal denaturation and aggregation of actomyosin from Atlanticcroaker[J]. J Food Sci,1982,50:1034-1037.
[29]Samejima K,Ishioroshi M,Yasui T. Relative roles of the heat and tails portions of molecule in the heat-induced gelation of myosin[J]. J Food Sci,1981,46:1412-1418.
[30]Okan E. Characterization of rheologieal properties and thermal stability of fish myofibrillar proteins[J]. Agriculture Food Science and Technology,2004,64(7):3006.
[31]Ali-Nehari A,Kim S-B,Lee Y-B,et al. Digestive enzymes characterization of krill(Euphausiasuperba)residues deoiled by supercritical carbon dioxide and organic solvents[J]. Journal of Industrial and Engineering Chemistry,2012,18(4):1314-1319.
Effect of supercritical CO2extraction of oil on physicochemical properties of myofibrillar proteins inEuphausiaSuperba
WANG Xiao-long1,FENG Xiao-mei1,SUI Xiao2,XI Xuan1,HAN Yu-qian1,*
(1.Food Department,Ocean University of China,Qingdao 266003,China;2.Biology Department of Qingdao University,Qingdao 266071,China)
Physicochemical properties of myofibrillar proteins inEuphausiaSuperbawas investigated following extraction of oil with supercritical CO2in order to provide basic information for food process. The lipids ofEuphausiaSuperbawas extracted at 15~25 MPa,35~55 ℃,2 h and 15 MPa,35 ℃,1~3 h. Sulphydryl content,Ca2+-ATPase activity,surface hydrophobicity and SDS-PAGE pattern were measured after extraction to study the changes in myofibrillar proteins . Total sulphydryl content and Ca2+-ATPase activity decreased with pressure,temperature and time while surface hydrophobicity increased after extraction. The changes in total sulphydryl content and Ca2+-ATPase activity mainly occurred during the first hour,however,surface hydrophobicity increased most at 1~2 h. SDS-PAGE pattern showed there were slight changes in protein bands,which indicated the structure of myofibrillar proteins varied after supercritical CO2extraction,thus some new bonds formed. After supercritical CO2extraction,the oxidized sulphydryl groups,formed disulfide bonds,increase in surface hydrophobicity and formation of some new bonds all improved the emulsifying and gel properties of proteins,which was very important to the application of theEuphausiaSuperba.
supercritical fluids extraction;EuphausiaSuperba;myofibrillar proteins;physicochemical properties;effect
2016-03-08
王晓龙(1990-),男,硕士研究生,研究方向:食品质量与安全控制,E-mail:wangxiaolong0109@163.com。
韩玉谦(1962-),男,教授,研究方向:超/亚临界流体萃取技术的应用,E-mail:hanyuqian@ouc.edu.cn。
TS254.4
A
1002-0306(2016)18-0116-06
10.13386/j.issn1002-0306.2016.18.014

