超声波处理对β-乳球蛋白结构和抗原性的影响
李 雪,涂宗财,2,*,齐午城,王 辉,杨文华,田 明
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.江西师范大学生命科学学院,江西南昌 330022)
超声波处理对β-乳球蛋白结构和抗原性的影响
李雪1,涂宗财1,2,*,齐午城1,王辉1,杨文华1,田明1
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.江西师范大学生命科学学院,江西南昌 330022)
采用电泳、圆二色谱、荧光光谱及酶联免疫吸附等方法,研究了超声波处理对β-乳球蛋白(β-lactoglobulin,β-Lg)结构和抗原性的影响。结果表明:随着超声波功率的增大,β-Lg的分子量无显著性变化,自由巯基含量下降,β-折叠含量和表面疏水性呈先升高后降低的趋势,且均在400 W时达到最大值。这表明超声波处理能迫使β-Lg结构展开,破坏其高级结构。与此同时,β-Lg的抗原性呈先升高后降低的趋势,在400 W 25 min时达到最大,为2540.20 μg/mL,比未处理样品增加了133%,这表明β-Lg结构的展开可能会导致其过敏表位的暴露,因此,β-Lg抗原性的改变可能与其高级结构的变化有关。
超声波,β-乳球蛋白,酶联免疫吸附法,结构,抗原性
食物过敏是世界卫生组织(WHO)公布的第六大人类健康问题,其中牛乳是国际粮农组织认定的八大主要食物过敏原之一[1]。牛乳过敏是婴幼儿以及儿童最普遍的过敏反应,并且发病率高达7.5%[2]。目前,普遍认为引起牛乳过敏的主要过敏原是β-乳球蛋白(β-lactoglobulin,β-Lg)。β-Lg是牛乳清中的主要蛋白,约占牛乳清蛋白的50%,能与脂肪酸、视黄醇等疏水性配体结合,具有良好的功能特性,已被广泛应用于食品加工中[3]。然而,β-Lg可能会引起牛乳过敏人群的一系列临床反应,如荨麻疹、血管性水肿、哮喘、鼻炎、呕吐、肠胃痉挛甚至过敏性休克等,严重影响了牛乳过敏人群对牛乳中营养成分的吸收,阻碍了过敏人群的生长发育,甚至危及过敏人群的生命安全。
针对这种现状,目前国内外学者已采用不同的加工方法对过敏原β-Lg的免疫原性进行研究。Toheder等[4]研究了不同pH、温度以及剪切速率对β-Lg抗原性的影响,结果表明β-Lg在pH5、120 ℃、剪切力为100~1000 s-1的条件下,抗原性最低,而在pH3的条件下加热时,过敏原蛋白结构展开,β-Lg抗原性增加。Zhong等[5]研究发现动态高压微射流技术(0.1~160 MPa)会不同程度的增加β-Lg的抗原性,且其抗原性的变化与结构的改变息息相关。Asghar等[6]研究了不同美拉德反应条件对β-Lg免疫原性的影响,结果发现糖基化程度高的β-Lg其免疫原性显著降低。以上研究表明不同的食品加工方法可能会产生新的过敏表位或者掩盖原本的过敏表位,这对β-Lg和牛乳加工方法的探索具有重要的指导意义。
近年来,超声波技术作为一种新型技术被广泛应用于食品无损检测、乳液的乳化和均质、辅助提取、杀菌、食品保鲜、食品冻结以及肉的嫩化等方面[7],而对过敏原蛋白免疫特性方面却鲜有研究。由于超声波能够产生空穴效应、机械效应以及化学效应,因此对过敏原蛋白质的空间结构也会产生影响[8],而过敏原蛋白空间结构的变化可能会影响其免疫原性。因此本文以β-Lg为研究对象,探究不同超声波处理条件对β-Lg空间结构和抗原性的影响,并且研究β-Lg抗原性变化与其结构变化之间的关系,为脱敏牛乳的研制和低敏性牛乳产品的开发提供一条新思路。
1 材料与方法
1.1材料与仪器
β-Lg(L3908)、鱼皮明胶和羊抗兔酶标二抗美国Sigma公司;兔抗β-Lg血清实验室自制;5,5′二硫代双(2-硝基苯甲酸)(DTNB)、8-苯胺-1-萘磺酸(ANS)、三羟甲基氨基甲烷(Tris)、甘氨酸(Gly)、乙二胺四乙酸(EDTA)、3,3′,5,5′-四甲基联苯胺盐酸盐(TMB.2HCl)和电泳Marker(14.4~97.4kDa)等索莱宝试剂有限公司。
电泳仪美国BIO-RAD公司;JY92-Ⅱ超声波破碎仪宁波新芝生物科技股份有限公司;F-7000荧光光谱仪日本日立公司;HF2000酶标分析仪北京华安麦科生物技术有限公司;Bio-Logic MOS 450 CD圆二色谱仪法国Bio-Logic公司。
1.2实验方法
1.2.1样品处理用0.01 mol/L pH7.4的磷酸盐缓冲溶液(phosphate buffer,PBS)配成2 mg/mL的β-Lg溶液,取25 mL上述溶液于烧杯中,放入JY92-Ⅱ超声波细胞破碎仪中(探头直径为6 mm)进行超声波处理。设置超声功率分别为0、100、250、400、550 W,超声时间为25 min。其间,脉冲工作3 s,休息8 s,整个超声过程使用冰浴降温,使样品的温度保持在4~10 ℃左右,超声完毕后放入4 ℃冰箱,备用。
1.2.2分子量分析参照Zhang等[9]的方法,采用12%的分离胶,5%的浓缩胶,4×上样缓冲液(含β-巯基乙醇),上样量为8 μL,Mark为低分子质量(14.4~97.4 ku)。实验初始电流为8 mA/板,进入分离胶后,调整为16 mA/板,分离后取出,用考马斯亮蓝G250染色30 min,然后于7%的冰乙酸中进行脱色,直至背景清晰。
1.2.3圆二色谱分析β-Lg的二级结构采用Bio-Logic MOS 450圆二色谱仪进行测定。用0.01 mol/L PBS(pH7.4)稀释不同条件超声波处理的β-Lg至0.2 mg/mL。参照Lucia等[10]的方法,测定条件:光径0.1 cm样品池,扫描速度100 nm/min,扫描范围190~250 nm,带宽1.0 nm。每个样品测量三次,圆二色谱的测量值用椭圆率表示(θ;degree.cm2/dmol),最终结果通过圆二在线分析软件dichroweb进行分析(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)。
1.2.4自由巯基含量的测定自由巯基的测定采用Ellman’s DTNB法[11]。取1.0 mL 样品溶液与4.0 mL Tris-Gly 缓冲溶液(0.086 mol/L Tris、0.09 mol/L Gly、5 mmol/L EDTA、pH8.0)混合,再加入50 μL 4 mg/mL的Ellman’s试剂,37 ℃ 15 min后于412 nm处测其吸光值。自由巯基含量的计算见公式:
式中:D为稀释倍数,C为样品浓度(mg/mL)。
Ellman’s试剂的配制:4.0 mg DTNB溶于1.0 mL Tris-Gly缓冲液。
1.2.5表面疏水性测定采用ANS荧光探针法测定超声波处理前后β-Lg的表面疏水性。将蛋白样品用PBS(0.01 mol/L,pH7.4)分别稀释成1、0.5和0.25 mg/mL,取4 mL稀释后的蛋白样品与20 μL 8 mmol/L的ANS磷酸盐缓冲液(0.01 mol/L,pH7.4)混合后,测定其荧光强度。测定条件:激发波长为370 nm,发射波长为400~600 nm,扫描速度为2400 nm/min,狭缝宽度均为10 nm,电压为400V。以蛋白浓度(mg/mL)为横坐标,荧光强度为纵坐标作图,采用线性回归分析进行曲线拟合,曲线的斜率即为蛋白样品的表面疏水性(H0)[12]。
1.2.6抗原性评估抗原性的测定采用间接竞争ELISA方法。在96酶标板中每孔依次包被100 μL 2 μg/mL的β-Lg标准品,4 ℃过夜。用质量分数为1%的鱼皮明胶作为封闭液,37 ℃温浴1 h。依次加入50 μL不同浓度的β-Lg标准品以及50 μL 15 μg/mL的不同条件超声波处理的样品,再加入50 μL兔抗β-Lg血清(1∶50000),37 ℃温浴1 h。每孔加入100 μL羊抗兔酶标二抗(1∶10000),37 ℃温浴1 h,每步操作之后均用PBST溶液(含0.05%吐温-20的pH7.4 0.01 mol/L的PBS液)洗板3次并扣干。用TMB底物显色,37 ℃避光反应15 min,最后用2 mol/L H2SO4溶液终止反应,于450 nm处测其吸光值[5]。以β-Lg标准品浓度(0.5~64 μg/mL)的对数为横坐标,吸光值为纵坐标绘制标准曲线,根据标准曲线即可算出不同超声波处理条件下β-Lg样品的抗原性。
1.2.7数据统计与分析每组实验重复3次,实验数据采用Origin7.5软件作图,SPSS17.0软件进行显著性分析(p<0.05)。
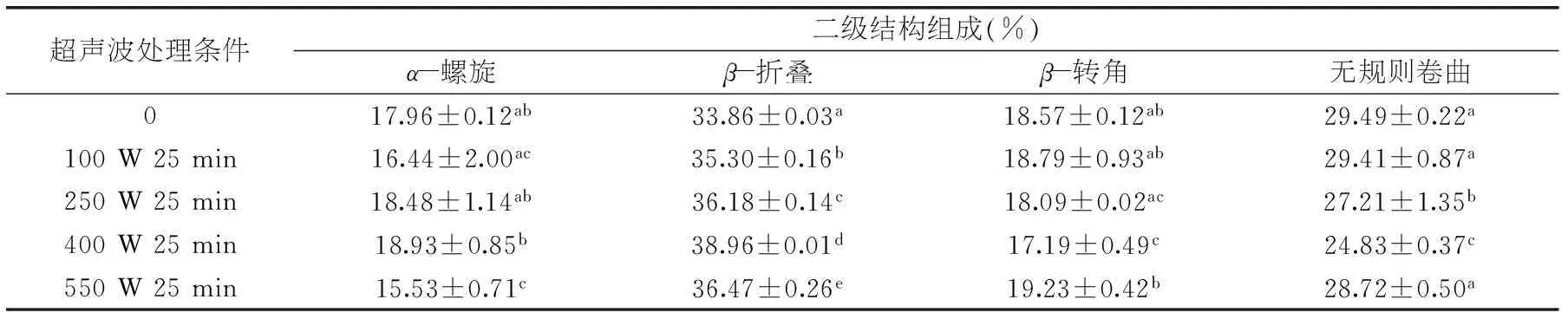
表1 超声波处理对β-Lg二级结构各组分含量的影响(%)
注:不同小写字母表示差异显著(p<0.05,n=3);图2~图4同。
2 结果与讨论
2.1分子量分析
过敏原蛋白经过许多物理手段(如热处理、辐射、高压脉冲电场等)处理后,其分子量可能会发生改变[13-14]。β-Lg单体由162个氨基酸组成,分子量为18.4 ku,图1为不同条件超声波处理对β-Lg分子量的影响。根据图1的标准蛋白电泳条带可以看出,与未处理的β-Lg相比,经不同超声波处理条件的β-Lg样品电泳条带无明显变化,说明超声波处理(0~550 W,25 min)不会改变β-Lg的分子量。此研究结果与前人的实验结果一致[15],超声波处理不会导致β-Lg生成共价交联的二聚体或多聚体。相似的研究结果在大豆分离蛋白的还原性SDS-PAGE电泳中也得到了证实[16]。

图1 超声波处理对β-Lg分子量的影响Fig.1 Effects of ultrasound treatment on the molecular weight of β-Lg
2.2圆二色谱分析
圆二色谱可以用来检测过敏原蛋白的二级结构,分析超声波对过敏原蛋白二级结构的影响。表1所示是通过Bio-Logic MOS 450圆二色谱仪测定的不同条件超声波处理对β-Lg二级结构各组分含量的影响。由表1可知,超声波处理对β-Lg二级结构的各组分含量有显著影响,经过超声波处理的样品其β-折叠含量均增加,无规则卷曲含量均减少,并且β-折叠的百分含量随超声波功率的增加呈先增加后降低的趋势,而无规则卷曲则呈先降低后增加的趋势。众所周知,过敏原β-Lg是以β-折叠为主的高度结构化的球蛋白,在其三维结构中包含8个反平行的β-折叠结构和一个α-螺旋结构。当超声波处理条件为400 W 25 min时,β-折叠含量达到最大,为38.96%±0.01%,然而当处理强度进一步增大时,β-折叠含量开始下降,无规则卷曲增加。这说明超声波处理会改变过敏原蛋白的二级结构,并且β-折叠与无规则卷曲相互转化。这主要是因为蛋白质的二级结构不仅取决于其氨基酸序列,还与蛋白质不同基团之间的相互作用力有关,如氢键、静电相互作用、范德华力等[16]。当低强度超声波处理时,超声波的空穴作用和机械作用使蛋白内部的次级键断裂[17],导致蛋白结构展开,β-折叠含量增加,无规则卷曲减少。当处理强度进一步增大时,β-Lg内部基团之间相互靠近,β-折叠含量减少,无规则卷曲含量增加,使之前展开的蛋白结构又变得致密。
2.3自由巯基含量分析
巯基基团是蛋白质中重要的功能性基团,能相互交联形成二硫键,维持蛋白质高级结构的稳定。每个β-Lg单体中都含有5个半胱氨酸残基,两个二硫键(Cys66~Cys160、Cys106~Cys199)和一个自由巯基(Cys121),其中游离的第121位半胱氨酸包埋在β-Lg分子内部[18]。图2是不同超声处理功率对β-Lg自由巯基含量的影响。从图2可以看出,经过超声波处理后β-Lg的自由巯基含量均有不同程度的降低。可能原因是超声波作用过程中的气泡破裂会产生高强度的震动波和剪切力造成了β-Lg结构的改变,使得β-Lg发生去折叠,其内部的自由巯基(Cys121)暴露到蛋白表面。同时,超声波的空化效应会使水分子分解成高活性的氢自由基和羟基自由基,并与暴露到蛋白表面的自由巯基反应,使β-Lg自由巯基含量减少。因此超声波过程中产生的自由基和暴露的自由巯基作用导致了β-Lg自由巯基含量减少[19]。

图2 超声波处理对β-Lg自由巯基含量的影响Fig.2 Effects of ultrasound treatment on free sulfhydryl groups of β-Lg
2.4表面疏水性分析
蛋白质的表面疏水性是蛋白质表面与极性水溶液环境接触的疏水基团的参数,是维持蛋白质三级结构的重要作用力之一,对蛋白质分子结构的研究具有重要意义。过敏原β-Lg是由亲水层包围、具有疏水内核的、拥有一定空间构型的球形分子,其表面疏水性的大小是通过β-Lg表面的疏水性氨基酸与ANS形成的结合物的荧光强度来表示。图3是不同超声波处理条件对β-Lg表面疏水性的影响。从图3可以看出,经超声波处理后,β-Lg的表面疏水性均增加,且随超声功率的增加呈先增加后降低的趋势,并在400 W时达到最大,H0为1945。β-Lg有许多疏水性氨基酸且大部分被掩埋在分子内部,然而由于超声波的空穴效应和机械效应会导致过敏原蛋白内部的疏水性区域外翻到蛋白分子表面,且与疏水性探针ANS结合,使其表面疏水性增加。随着超声波处理强度的进一步增大,蛋白分子内部的电荷分布发生改变,导致β-Lg内部基团相互靠近,β-Lg发生部分折叠,使分子表面的疏水性氨基酸重新掩埋到分子内部。这说明超声波这种温和的处理技术对蛋白表面疏水性的改变是可逆的[20]。对比表1和图3可以看出,β-Lg的β-折叠含量和表面疏水性均呈先增加后降低的趋势,且均在400 W 25 min时达到最大,这进一步的证明在超声波处理过程中(0~550 W),β-Lg的结构发生了先展开后折叠的变化。

图3 超声波处理对β-Lg表面疏水性的影响Fig.3 Effects of ultrasound treatment on the surface hydrophobicity of β-Lg
2.5抗原性分析
采用间接竞争ELISA法检测超声波处理对β-Lg抗原性的影响,结果如图4所示。经超声波处理后,β-Lg的抗原性均有显著增加,且在400 W 25 min时达到最大,为2540.20 μg/mL,比未处理样品增加了133%。
在天然状态下,过敏原蛋白有90%以上的表位为构象性表位,而且有些线性表位是构象性表位的组成部分,这说明过敏原蛋白的空间结构与抗原性密切相关[21-22]。β-Lg的三维结构是由8个反平行片层、一个α-螺旋和一个β-转角组成,这10个片层组成了一个桶状结构,这个桶状结构主要是靠疏水相互作用、二硫键以及氢键等次级键来稳定β-Lg的空间结构,这主要是由于超声波处理会破坏过敏原β-乳球蛋白的二级结构和三级结构。从图4中可以看出随着超声波强度的增大,β-乳球蛋白的抗原性呈先增加后降低的趋势。结合圆二色谱、自由巯基以及表面疏水性等实验结果可知,这可能是因为β-乳球蛋白结构展开,表现为β-折叠含量增加、自由巯基暴露、掩埋在β-Lg分子内部的疏水性基团外翻等,使部分隐性过敏表位变为显性,更易与抗体特异性结合,抗原性增加,且在400 W 25 min时β-Lg的抗原性达到最大。而随着超声波处理强度的进一步增加,抗原性有所降低,但仍比未处理样品要高。这可能是由于β-Lg结构发生部分折叠,表现为β-折叠含量降低和表面疏水性下降,蛋白分子表面的抗原表位重新掩埋到分子内部(如过敏表位Val41~Lys60,Tyr102~Val124,Arg 149~Ile162),使抗体不能与这些掩埋在分子内部的抗原表位结合,抗原性降低。因此β-Lg抗原性的变化与其结构的变化密切相关。

图4 超声波处理对β-Lg抗原性的影响Fig.4 Effects of ultrasound treatment power on antigenicity of β-Lg
3 结论
综上所述,超声波处理会迫使β-Lg的二、三级结构发生改变,从而导致蛋白的抗原性也随之改变。随着超声波功率的增加,β-Lg的空间结构展开,在400 W 25 min时,展开程度达到最大,其内部的过敏表位暴露,导致抗原性达到最大(2540.20 μg/mL)。随着超声波功率的进一步增加,β-Lg发生部分折叠,过敏表位被掩盖,在550 W 25 min时抗原性开始下降。因此抗原性的变化与其结构的改变密切相关。
[1]Li Z,Luo Y,Feng L. Effects of Maillard reaction conditions on the antigenicity ofα-lactalbumin andβ-lactoglobulin in whey protein conjugated with maltose[J]. European Food Research and Technology,2011,233(3):387-394.
[2]Fiocchi A,Brozek J,Schünemann H,et al. World Allergy Organization(WAO)diagnosis and rationale for action against cow’s milk allergy(DRACMA)guidelines[J]. Pediatr Allergy Immunol,2010,21(S21):57-161.
[3]吴序栎,朱倩倩,成小娟,等. 牛乳β-乳球蛋白热稳定与免疫原性关系的光谱学研究[J]. 光谱学与光谱分析,2011,31(8):2205-2209.
[4]Rahaman T,Vasiljevic T,Ramchandran L. Conformational changes ofβ-lactoglobulin induced by shear,heat,and pH-Effects on antigenicity[J]. Journal of Dairy Science,2015,98(7):4255-4265.
[5] Zhong J Z,Liu W,Liu C M,et al. Aggregation and conformational changes of bovineβ-lactoglobulin subjected to dynamic high-pressure microfluidization in relation to antigenicity[J]. Journal of Dairy Science,2012,95(8):4237-4245.
[6]Taheri-Kafrani A,Gaudin J C,Rabesona H,et al. Effects of heating and glycation ofβ-lactoglobulin on its recognition by IgE of sera from cow milk allergy patients[J]. Journal of Agricultural and Food Chemistry,2009,57(11):4974-4982.
[7]Shanmugam A,Chandrapala J,Ashokkumar M. The effect of ultrasound on the physical and functional properties of skim milk[J]. Innovative Food Science & Emerging Technologies,2012,16:251-258.
[8]胡昊,胡坦,许琦,等. 高场强超声波技术在食品蛋白质加工中的应用研究进展[J]. 食品科学,2015,36(15):260-265.
[9]Zhang Q T,Tu Z C,Xiao H,et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing,2014,92(1):30-37.
[10]L de la Hoz,Netto F M. Structural modifications ofβ-lactoglobulin subjected to gamma radiation[J]. International Dairy Journal,2008,18(12):1126-1132.
[11]Sava N,Van der Plancken I,Claeys W,et al. The kinetics of heat-induced structural changes ofβ-lactoglobulin[J]. Journal of Dairy Science,2005,88(5):1646-1653.
[12]Xiang B Y,Ngadi M O,Ochoa-Martinez L A,et al. Pulsed electric field-induced structural modification of whey protein isolate[J]. Food and Bioprocess Technology,2011,4(8):1341-1348.
[13]Moro A,Báez G D,Busti P A,et al. Effects of heat-treatedβ-lactoglobulin and its aggregates on foaming properties[J]. Food Hydrocolloids,2011,25(5):1009-1015.
[14]Shi Y,Li R,Tu Z,et al. Effect of γ-irradiation on the physicochemical properties and structure of fish myofibrillar proteins[J]. Radiation Physics and Chemistry,2015,109:70-72.
[15]Stanic-Vucinic D,Stojadinovic M,Atanaskovic-Markovic M,et al. Structural changes and allergenic properties ofβ-lactoglobulin upon exposure to high-intensity ultrasound[J]. Molecular nutrition & food research,2012,56(12):1894-1905.
[16]Hu H,Wu J,Li-Chan E C Y,et al. Effects of ultrasound on structural and physical properties of soy protein isolate(SPI)dispersions[J]. Food Hydrocolloids,2013,30(2):647-655.
[17]Maity I,Rasale D B,Das A K. Sonication induced peptide-appended bolaamphiphile hydrogels for in situ generation and catalytic activity of Pt nanoparticles[J]. Soft Matter,2012,8(19):5301-5308.
[18]Brownlow S,Cabral J H M,Cooper R,et al. Bovineβ-lactoglobulin at 1.8 Å resolution-still an enigmatic lipocalin[J]. Structure,1997,5(4):481-495.
[20]Chandrapala J,Zisu B,Kentish S,et al. The effects of high-intensity ultrasound on the structural and functional properties ofα-Lactalbumin,β-Lactoglobulin and their mixtures[J]. Food Research International,2012,48(2):940-943.
[21]Clement G,Boquet D,Frobert Y,et al. Epitopic characterization of native bovineβ-lactoglobulin[J]. Journal of immunological methods,2002,266(1):67-78.
[22]Sélo I,Négroni L,Créminon C,et al. Allergy to Bovineβ-Lactoglobulin:Specificity of Human IgE Using Cyanogen Bromide-Derived Peptides[J]. International Archives of Allergy and Immunology,1998,117(1):20-28.
Effect of ultrasound treatment on structure and antigenicity ofβ-lactoglobulin
LI Xue1,TU Zong-cai1,2,*,QI Wu-cheng1,WANG Hui1,YANG Wen-hua1,TIAN Ming1
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.College of Life Science,Jiangxi Normal University,Nanchang 330022,China)
In order to study the effect of ultrasound treatment on structure and antigenicity ofβ-lactoglobulin(β-Lg),SDS-PAGE,circular dichroism spectra,fluorescence spectrum and indirect competitive enzyme-linked immunosorbent assay were used to measure the structure and antigenicity,respectively. The molecular weight ofβ-Lg was not significant change,free sulfhydryl groups decreased,the content ofβ-sheet and surface hydrophobicity firstly increased and then decreased with the increasing of ultrasonic power. The content ofβ-sheet and surface hydrophobicity reached the maximum with 400 W ultrasound treatment. It was indicated thatβ-Lg could be unfolded and spacial structure was destroyed by ultrasound treatment. Meanwhile,the antigenicity ofβ-Lg was also firstly increased and then decreased. When it was treated at 400 W for 25 min,the antigenicity ofβ-Lg increased up to 2540.20 μg/mL,showing an increase by 133%. The results indicated that the unfolding ofβ-Lg might result in the allergic epitope exposed. Therefore,the antigenicity change ofβ-Lg was probably related to its spacial structural alteration induced by ultrasound treatment.
ultrasound;β-lactoglobulin;enzyme-linked immunosorbent assay;structure;antigenicity
2016-03-04
李雪(1991-),女,硕士研究生,研究方向:食品资源开发与高效利用,E-mail:lixue0616@foxmail.com。
涂宗财(1965-),男,博士,教授,研究方向:食品资源开发与高效利用,E-mail:tuzc_mail@aliyun.com。
国家高技术研究发展计划专项经费资助(863计划)2013AA102205;国家自然科学基金资助项目(31460395)。
TS252.1
A
1002-0306(2016)18-0106-05
10.13386/j.issn1002-0306.2016.18.012

