卵白蛋白-油酸复合物对人结肠癌细胞的HAMLET样生长抑制作用研究
邢效娟,刘建垒,景 浩
(中国农业大学食品科学与营养工程学院,北京 100083)
卵白蛋白-油酸复合物对人结肠癌细胞的HAMLET样生长抑制作用研究
邢效娟,刘建垒,景浩*
(中国农业大学食品科学与营养工程学院,北京 100083)
乳白蛋白与油酸形成的复合物具有癌细胞生长抑制作用(Human alpha-lactalbumin made lethal to tumor cells,HAMLET)。本文制备了卵白蛋白(Ovalbumin,OVA)和油酸(Oleic acid,OA)的复合物(OVA-OA),通过检测细胞生长抑制、细胞膜通透性、细胞生长周期和凋亡的变化,分析了OVA-OA对人结肠癌细胞(Caco-2)的生长抑制作用以及其中OA对生长抑制作用的贡献。结果表明,当OVA-OA中OA的浓度达到182 μmol/L时,OVA-OA对Caco-2细胞有显著(p<0.05)生长抑制作用,273 μmol/L时生长抑制作用增强,且随着作用时间的延长(1~3 h)而增强。在182 μmol/L时,OA对Caco-2细胞也有生长抑制作用,其剂量效应关系与OVA-OA一致。但当OA浓度为273 μmol/L时,其生长抑制作用弱于OVA-OA的。OVA-OA和OA均会促使乳酸脱氢酶(Lactate dehydrogenase,LDH)释放,增大晚期凋亡和坏死的细胞百分比,阻滞细胞周期在G0/G1期和S期。由此可知,OVA-OA对结肠癌细胞具有HAMLET样生长抑制作用,其中OA起主要作用。OVA-OA对人结肠癌细胞的生长抑制作用是通过损伤细胞膜、阻滞细胞生长周期和促进细胞凋亡来实现的。
卵白蛋白,油酸,细胞生长抑制,乳酸脱氢酶,细胞凋亡,细胞周期
Hakansson和Svanborg等[1]发现母乳中含有一种能特异性促使人肺癌细胞凋亡的物质,用蛋白质电泳确定其分子量后发现这种物质的分子量与α-乳白蛋白(α-Lactalbumin,α-LA)相近,但经验证发现α-LA本身并不能引起肺癌细胞的凋亡,因此当时称这种物质为乳白蛋白多聚体(multimericα-LA)。经过5年的研究,Svensson等[2]证明这种聚合物是α-LA与油酸(Oleic acid,OA)的复合物,并将其命名为HAMLET。Tolin等[3]通过胃蛋白酶将α-LA进行酶解,再用α-LA肽段与OA混合制备复合物,并通过细胞实验发现此复合物也有HAMLET样的细胞生长抑制作用。随着研究的进行,发现其他类型的蛋白质,比如马溶菌酶[4]、β-乳球蛋白[5]、乳铁蛋白[6]也可以与OA形成有HAMLET样细胞生长抑制作用的复合物,而相对应的蛋白质没有这种作用。
卵白蛋白(Ovalbumin,OVA)约占蛋清蛋白含量的54%,属于含磷糖的糖蛋白,分子量为45 ku,等电点为4.5[7]。目前只有一些OVA与不饱和脂肪酸相互作用的报道,例如OA的结合使得OVA的荧光强度降低,二级结构变得更加松散[8],加热后的OVA可以与亚油酸(Linoleic acid,LA)通过疏水键相互作用[9]。但对结合后的OVA-OA的生物活性,尤其是是否具有HAMLET样的癌细胞生长抑制作用还未见报道。
一般认为α-LA-OA的癌细胞生长抑制作用不是由OA引起的,而是复合物特有的性质。Kamijima等[10]研究α-LA-OA对小鼠淋巴细胞白血病细胞株L1210细胞生长影响时发现即使当OA浓度达到2.5 mmol/L时,也没有细胞生长抑制作用,而经α-LA-OA作用后细胞生长抑制率为90%左右。Fang等[11]研究α-LA-OA对人结肠癌细胞(Caco-2)和人早幼粒白血病细胞(HL-60)等细胞生长抑制作用时发现OA浓度低于100 μmol/L时,对细胞没有生长抑制作用。但近年来有些研究者报道,HAMLET中起生长抑制作用的成分为OA,例如α-LA-OA可以抑制HL-60细胞和人宫颈癌细胞(Hela)的生长,但相应浓度的OA(0~100 μmol/L)也有细胞生长抑制作用[12-13]。因此,对于OA以及OA与蛋白质复合物的物化特性和细胞生长抑制作用还需进一步研究。
在本研究中,以人结肠癌细胞(Caco-2)为模型,分析研究OVA-OA的HAMLET样细胞生长抑制作用以及OA对OVA-OA的细胞生长抑制作用的贡献。通过LDH法、流式细胞技术分析OVA-OA对细胞膜、细胞生长周期和细胞凋亡的影响。
1 材料与方法
1.1材料与仪器
卵白蛋白(纯度≥99%,Ca. No. 1021845)和油酸(纯度≥99.5%,Cat. No.112-80-1)均购于成都格雷西亚化学技术有限公司;DMEM(Dulbeco’s modified eagle medium)购于美国Invitrogen公司;胎牛血清(Fetal bovine serum,FBS)购于北京鼎国生物技术有限公司;胰蛋白酶、噻唑蓝(Thiazolyl blue tetrazolium bromide,MTT)、不含DNA的RNA酶、碘化丙啶(Propidium iodide,PI)、辅酶I(β-Nicotinamide adenine dinucleotide,NADH)均购于美国Sigma公司;青霉素/链霉素溶液购于碧云天生物技术研究所;Annexin V-FITC/PI凋亡试剂盒购于上海贝博生物;其他试剂为国产分析纯;实验用水为高纯去离子水(deionized water,18 Ω;dH2O);人结肠癌细胞(Caco-2)购于中国科学院上海生命科学研究院细胞资源中心;细胞培养皿、培养板均购于无锡耐思生物科技有限公司。
Model 680型酶标仪美国BIO-RAD公司;FACSCalibur II型流式细胞仪美国BD公司;MCO-15AC型二氧化碳培养箱日本Sanyo(三洋)公司;BSC-1500 II A2-X型生物安全柜济南市鑫贝西生物技术有限公司;pHs-3C+型酸度计成都世纪方舟科技有限公司;XB220A型电子天平瑞士Precisa Gravimetrics AG公司;Vortex-Genie 2漩涡振荡器美国Scientific Industries公司;FM200型实验室分散乳化机上海弗鲁克液体机械制造有限公司。
1.2实验方法
1.2.1OVA-OA的制备用pH8.0的磷酸盐缓冲溶液(Phosphate buffer solution,PBS)配制10 mg/mL的OVA储备液,离心(1460×g,10 min)后取上清4 ℃储存备用。用无水乙醇溶解OA配制成1 mol/L的储备液,4 ℃储存备用;使用前用PBS将OA稀释为1 mmol/L的工作液,再用乳化机均质(8000~10000 r/min,1 min),制成OA混悬液。将不同体积的OA混悬液加入到含有2 mL,OVA储备液(10 mg/mL)的离心管中,再加入不同体积的PBS至10 mL,漩涡振荡均匀,配制成不同摩尔比的OA与OVA的混合溶液,其中OVA浓度恒定为2 mg/mL。再将其置于70 ℃水浴加热20 min,水浴结束后置于冰水中迅速冷却,待测。同时将OVA,OA加热,研究加热对两者细胞生长抑制活性的影响。
OVA-OA组中OVA的浓度为2 mg/mL(45.5 μmol/L),OA的浓度分别为0、91、182、273 μmol/L(OA与OVA的摩尔比分别为0∶1、2∶1、4∶1、6∶1),乙醇浓度低于0.5%;OA组浓度分别为0、91、182、273 μmol/L。
1.2.2细胞生长抑制检测将Caco-2细胞以1×105个/mL的密度接种于96孔板,每孔加入100 μL细胞悬液,置于37 ℃,5% CO2培养箱中培养至细胞覆盖孔底面积的70%后弃去培养基,每孔加入100 μL的样品溶液,置于培养箱孵育1、2、3 h后弃去样品,加入100 μL的DMEM10(含有10%胎牛血清的细胞培养基),于CO2培养箱继续培养24 h后弃去培养基,每孔加入70 μL含0.5 mg/mL MTT的DMEM,避光孵育3 h后小心弃去上清,加入70 μL盐酸-异丙醇,在vortex上振荡(800 r/min,10 min)。测定其在570 nm处吸光值[14-15]。根据公式(1)计算经不同样品作用后的细胞存活率。
细胞存活率(%)=A样品570 nm/A对照570 nm×100
式(1)
1.2.3乳酸脱氢酶释放率检测Tris-pyruvate-NADH反应液配制:使用前,取100 mL Tris-EDTA缓冲液(pH7.4),分别加入1 mL丙酮酸钠储备液(135 mmol/L)和1 mL NADH储备液(17 mmol/L),混匀,并在37 ℃水浴中孵育15 min以上,备用。
将Caco-2细胞以1×106个/mL的密度接种于直径为100 mm的细胞培养皿中,每皿加入10 mL的细胞悬液,置于37 ℃,5% CO2培养箱中培养至细胞覆盖孔底面积的80%~90%后弃去培养基,每孔加入3 mL的样品溶液,置于培养箱孵育3 h后收集样品溶液,离心(400×g,10 min)取上清,待测。取70 μL上清液与700 μL预热(37 ℃)的Tris-pyruvate-NADH反应液(其中Tris,pyruvate,NADH的终浓度分别为50、1.22、0.154 mmol/L)快速混合,立即测定其在340 nm处吸光值,每隔30 s记录一次,连续记录3 min,以反应最初吸光值下降最快部分(如0~1 min或0~2 min)求线性回归方程(时间为横坐标,吸光值为纵坐标),其斜率绝对值即为每分钟Abs340 nm的减少值(ΔAbs340 nm)。根据公式(2)计算LDH释放率[14]。

表1 加热对OVA与OA对Caco-2细胞的生长抑制作用的影响
注:样品作用时间为3 h,不同大写字母A~C表示同列不同均数差异显著(p<0.05);不同小写字母a~f表示同行不同均数差异显著(p<0.05);表2、表3同。
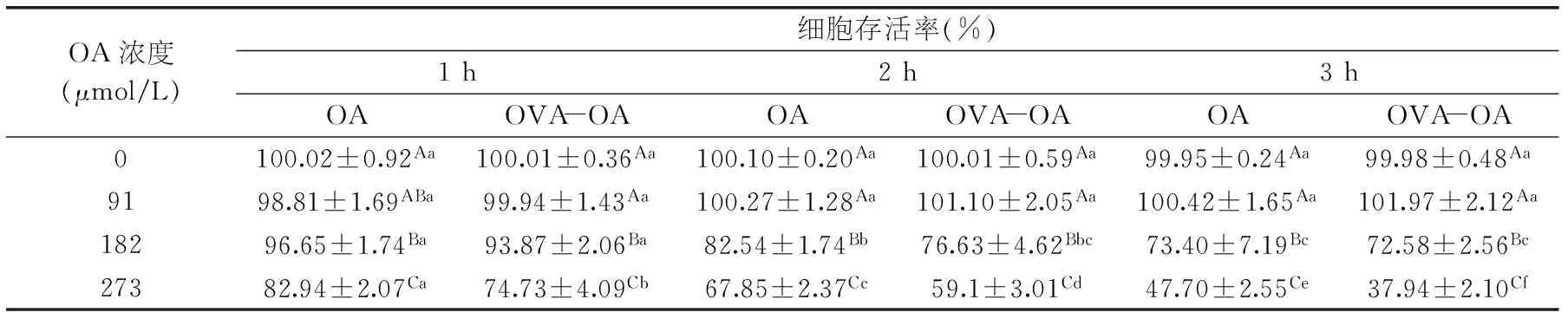
表2 在不同浓度和不同作用时间时OVA-OA及OA对Caco-2细胞的生长抑制作用
LDH释放率(%)=ΔAbs340 nm,sample/ΔAbs340 nm,control×100
式(2)
式中ΔAbs340 nm为反应体系每分钟Abs340 nm的减少值。
1.2.4细胞凋亡检测按照1.2.3中的方法进行种盘和样品处理,样品处理结束后弃去样品,每皿加入8 mL的DMEM继续培养24 h后,消化,离心(100×g,5 min)收集细胞,用预冷(4 ℃)的PBS洗涤细胞两次,洗净胰酶和EDTA。用400 μL Annexin V结合液悬浮细胞,并转移到流式管中,加入5 μL Annexin V-FITC染色液,轻轻混匀,于2~8 ℃避光孵育15 min;上机检测前加入10 μL PI染液,轻轻混匀,于2~8 ℃避光条件下孵育5 min,上机检测[16]。另用未染色的及Annexin V单染的对照组细胞对仪器进行校准。
流式细胞仪采用激发波长488 nm,发射波长530 nm检测FITC和620 nm检测PI,FITC的绿色荧光通过FITC通道(FL1)检测,PI红色荧光通过PI通道(FL2)检测。用Cell Quest软件分析得到不同凋亡期细胞的百分比。
1.2.5细胞周期检测按照1.2.4中的方法处理细胞至预冷PBS洗净胰酶和EDTA后,加入300 μL PBS并重悬细胞,缓慢加入700 μL预冷(-20 ℃)的无水乙醇(乙醇终浓度为70%),-20 ℃固定1 h;离心(100×g,5 min)弃上清,用5 mL预冷的PBS洗涤细胞两次;加0.25 mL PBS重悬细胞,并转移到流式管中,加入13 μL 10 mg/mL的RNA酶(终浓度0.5 mg/mL),37 ℃避光孵育1 h;加入14 μL 1 mg/mL的PI(终浓度50 μg/mL),4 ℃避光30 min左右后,用流式细胞仪收集细胞(激发波长488 nm,发射波长620 nm),并用Modfit软件分析得到不同生长周期细胞的百分比[17]。
1.2.6统计学分析所有实验均重复3次,数据以Mean±SD表示。采用Minitab 17.1.0软件进行单因素方差分析(analysis of variance,ANOVA),进一步用Turkey多重比较确定各组数据间的显著性差异,显著水平为设定为p<0.05。
2 结果与分析
2.1OVA-OA对Caco-2细胞的生长抑制作用
采用不同摩尔比的OA与OVA(OVA 2 mg/mL;OA与OVA的摩尔比为0∶1、2∶1、4∶1、6∶1)制备OVA-OA复合物。首先研究加热对OVA与OA对Caco-2细胞的细胞生长抑制作用的影响(表1);再同时用OVA-OA和与OVA-OA中相应浓度的OA(0、91、182、273 μmol/L)作用于Caco-2细胞,比较两者的细胞生长抑制作用(表2)。
由表1可知,未加热时,OVA对Caco-2细胞没有生长抑制作用;浓度为91 μmol/L时,OA也没有生长抑制作用;182 μmol/L时,对细胞有显著的(p<0.05)生长抑制作用,且273 μmol/L时抑制作用增强。加热后,OVA、OA对细胞的生长抑制作用均与未加热时没有显著性差异。所以,加热并不会影响OVA和OA对Caco-2细胞的生长抑制作用。
当OVA-OA中OA的浓度为91 μmol/L时,对Caco-2细胞无生长抑制作用(1~3 h);182 μmol/L时,对细胞有显著的(p<0.05)生长抑制作用,273 μmol/L时抑制作用增强,且随着作用时间的延长而增强。在浓度较低(91、182 μmol/L)时,OA与OVA-OA对细胞的生长抑制作用相当;但当OA浓度为273 μmol/L时,其生长抑制作用明显弱于OVA-OA的;作用时间相同时,OA的细胞生长抑制率比OVA-OA低8%~10%。
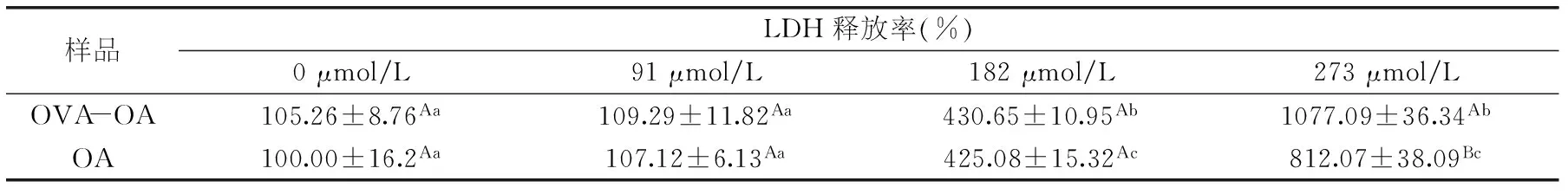
表3 不同浓度OVA-OA及OA对Caco-2细胞的LDH活性和释放率的影响
研究发现α-LA-OA对肺、肾、结肠、膀胱、前列腺[1]、肝脏、乳腺[18]、喉[19]等来源的肿瘤细胞均有生长抑制作用。本研究显示,OVA-OA对人结肠癌细胞(Caco-2)也有HAMLET样生长抑制作用。Zhu等[20]研究OA对人类神经母瘤SH-SY5Y细胞的生长抑制作用,发现OA致SH-SY5Y细胞生长抑制与时间和浓度呈依赖性,当OA的浓度为200 μmol/L,作用3 h时,细胞的抑制率约为35%;作用6 h时,细胞的抑制率约为55%。Lima等[21]也发现OA对淋巴瘤细胞(Jurkat)和恶性淋巴瘤细胞(Raji)有生长抑制作用。在本实验中,OA对Caco-2细胞的生长抑制也呈时间和浓度依赖,在273 μmol/L时作用3 h可以抑制细胞生长率至47.7%。
Brinkmann等[12]研究α-LA-OA对HL-60细胞的生长抑制作用,发现OA(浓度为0~100 μmol/L)与α-LA-OA对细胞表现出相似的细胞生长抑制作用,且α-LA-OA的生长抑制作用略高于OA。Permyakov等[19]研究发现α-LA-OA对人喉头癌细胞(HEp-2)的半抑制率浓度为(IC50值)240 μmol/L(用OA的浓度表示),而OA单独存在时IC50值为300 μmol/L,α-LA单独存在时没有细胞生长抑制作用。所以α-LA-OA中发挥细胞生长抑制作用的成分主要是OA,而α-LA可能主要起增加OA溶解度与运输OA的作用。在本实验中OVA本身没有细胞生长抑制作用,OA具有细胞生长抑制作用,且浓度相同时OVA-OA生长抑制作用强于OA,所以在OVA-OA中发挥细胞生长抑制作用的成分是OA,OVA可能主要通过增加OA溶解度或运输OA来提高OA自身的细胞生长抑制作用。
2.2OVA-OA对Caco-2细胞膜的破坏作用
根据表2可知样品作用时间为3 h时,OVA-OA及OA对细胞的生长抑制作用最强,所以选择作用3 h研究其对细胞膜的破坏作用(表3)。
当OVA-OA中的OA浓度为91 μmol/L时,细胞的LDH释放率没有显著(p<0.05)变化;182 μmol/L时,细胞的LDH释放率显著增大,增大为对照组的4.5倍;273 μmol/L时LDH的释放率进一步增大,为对照组的10.8倍。在浓度较低(91和182 μmol/L)时,OA与OVA-OA对细胞LDH释放率的影响相当;但当OA浓度为273 μmol/L时,OA对细胞LDH的释放率明显低于OVA-OA,约低25%。
乳酸脱氢酶(lactate dehydrogenase,LDH)是存在于细胞内,参与糖酵解最后一步即丙酮酸和乳酸相互转化的一种酶,当细胞膜受损伤时,释放的LDH会增加,故细胞膜释放的LDH增加通常反映细胞膜受损伤,膜通透性增大[14]。所以OA浓度为182,273 μmol/L时,OA与OVA-OA对Caco-2细胞的膜造成了损伤,致使LDH释放,且273 μmol/L时OVA-OA对细胞膜的损伤程度更大。Mossberg等[21]用蛋黄磷脂酰胆碱或大豆卵磷脂组成单膜囊泡模仿荧光分子标记的α-LA-OA与细胞膜的相互作用,发现α-LA-OA能够结合人造细胞膜,增大膜的流动性,同时会破坏细胞膜的完整性,导致细胞内的一些物质泄漏到细胞外,而未结合OA的α-LA并没有对细胞膜产生破坏作用,与本研究的结果一致。Mossberg等[21]也研究了α-LA-OA与从肺癌细胞A549中提取的质膜的作用,发现α-LA-OA也可以与其结合,但与人造细胞膜不同的是α-LA-OA在质膜中的分布不均匀,这说明癌细胞的膜中可能有α-LA-OA特定的高亲和位点。
2.3OVA-OA对Caco-2细胞凋亡的影响
根据表2可知样品作用时间为3 h时,OVA-OA及OA对细胞的生长抑制作用最强,所以选择作用3 h研究OVA-OA和OA对Caco-2细胞凋亡的影响,探讨经样品处理后不同时期凋亡的细胞百分比变化(图1和表4)。
当OVA-OA复合物中OA的浓度为91 μmol/L时,细胞的凋亡没有显著(p<0.05)变化;182 μmol/L时,晚期凋亡和坏死的细胞百分比开始显著增大,增大了约12%,而早期凋亡的细胞百分比没有变化;273 μmol/L时晚期凋亡和坏死的细胞百分比进一步增大,增了约24%,早期凋亡细胞百分比也增大了3%左右。当OA浓度为91,182,273 μmol/L时,OA对细胞凋亡的影响均与OVA-OA一致。所以,OVA-OA和OA可以增大晚期凋亡和坏死的细胞百分比,且高剂量时(273 μmol/L)OVA-OA也可以使早期凋亡细胞百分比增多。
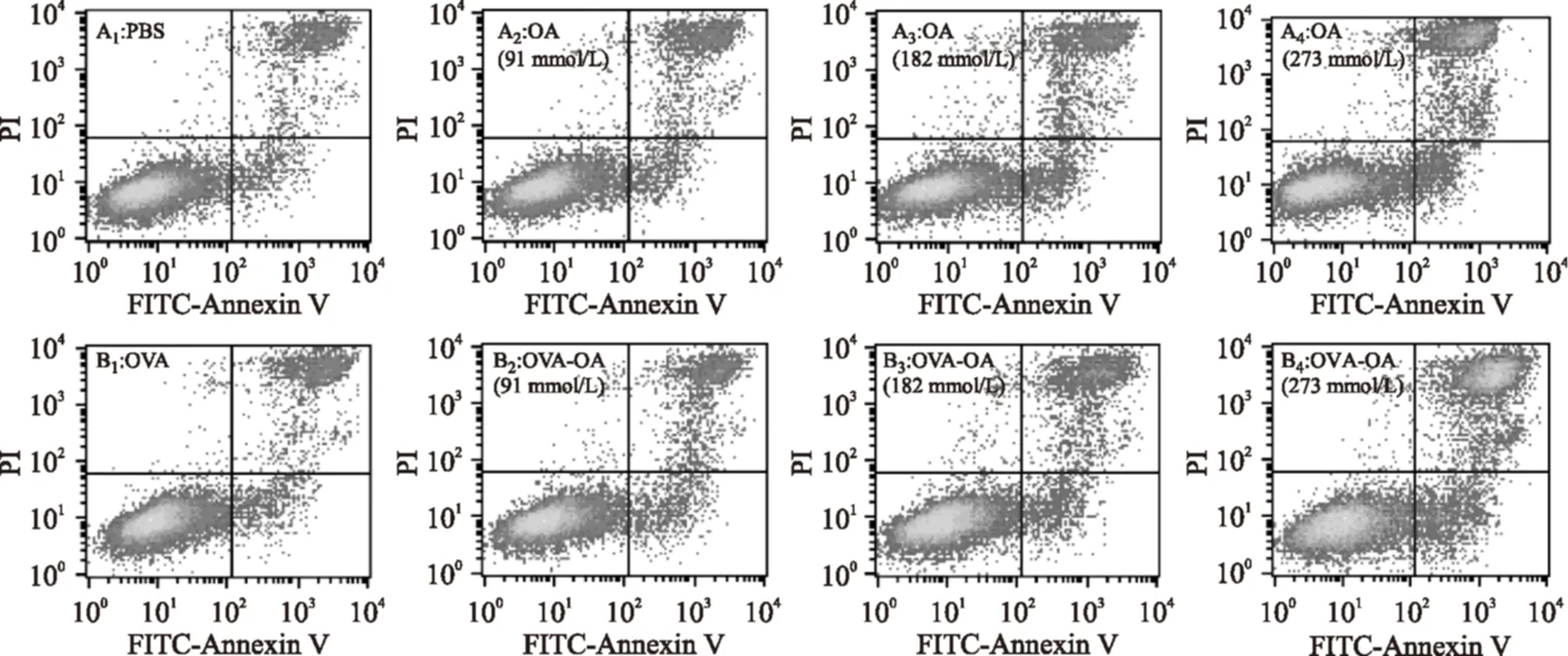
图1 不同浓度OVA-OA及OA对Caco-2细胞凋亡的影响Fig.1 Cell apoptosis effects of OA and OVA-OA at different concentrations注:A:不同浓度的OA组;B:含不同浓度OA的OVA-OA组。左上象限显示机械性损伤细胞(damaged),为Annexin V-/PI+;右上象限显示凋亡晚期或者继发性坏死细胞(late apoptosis/necrosis),为Annexin V+/PI+;左下象限显示活细胞(viable),为Annexin V-/PI-;右下象限显示早期凋亡细胞(early apoptosis),为Annexin V+/PI-。

表4 不同浓度OVA-OA及OA对Caco-2细胞凋亡的影响
注:不同字母小写字母表示同列不同均数差异显著(p<0.05);表5同。
OVA-OA和OA可以使晚期凋亡和坏死的细胞数增多,而晚期凋亡和坏死细胞的膜遭到破坏[22],说明OVA-OA和OA可以破坏Caco-2的细胞膜,与LDH实验的结果一致。Fang等[11]用α-LA-OA作用Caco-2细胞24 h后,细胞的凋亡率约为50%,其中晚期凋亡和坏死的细胞数占39.54%。Brinkmann等[12]研究α-LA-OA作用3 h后对人急性单核细胞白血病细胞(THP-1)凋亡的影响,也得出了相似的结论。所以蛋白质和油酸的复合物可以增大晚期凋亡和坏死的细胞百分比。

表5 不同浓度OVA-OA及OA对Caco-2细胞生长周期的影响
2.4OVA-OA对Caco-2细胞生长周期的影响
根据表2可知,样品作用时间为3 h时,OVA-OA及OA对细胞的生长抑制作用最强,所以选择作用3 h研究OVA-OA和OA对Caco-2细胞周期的影响,探讨经样品处理后处于细胞周期不同阶段的细胞百分比变化(图2和表5)。

图2 不同浓度OVA-OA及OA对Caco-2细胞生长周期的影响Fig.2 Cell cycle distribution effects of OA and OVA-OA at different concentrations注:A:不同浓度的OA组;B:含不同浓度OA的OVA-OA组。
当OVA-OA复合物中OA浓度为91 μmol/L时,细胞周期分布没有发生变化;而浓度为182,273 μmol/L时,G2期和M期的细胞百分比显著(p<0.05)降低,降低了10%左右,G0和G1期、S期细胞百分比均有增加的趋势。当OA浓度为91、182、273 μmol/L时,OA对细胞周期的影响均与OVA-OA一致。所以OVA-OA和OA主要通过减少G2期和M期的细胞百分比,使细胞周期阻滞在G0/G1期和S期来影响细胞周期分布。
细胞周期是指一次有丝分裂结束到下一次有丝分裂的结束,细胞由一个分裂为两个子细胞的过程,包括休眠期/DNA合成前期(G0/G1期)、DNA合成期(S期)、DNA合成后期(G2期)和细胞分裂期(M期)[23-24]。OVA-OA及OA处理Caco-2细胞后,可以显著减少G2期和M期的细胞百分比,说明经OVA-OA及OA的处理会影响细胞DNA的合成,使细胞难以进入DNA合成后期和分裂期,进而影响细胞分裂。方冰[16]研究α-LA-OA对HT-29细胞周期的影响,发现α-LA-OA会影响染色体的分裂,使细胞阻滞在G2/M期,与本实验结果不同。
3 结论
卵白蛋白和油酸复合物(OVA-OA)对人结肠癌Caco-2细胞具有HAMLET样的生长抑制作用,其中OA起主要作用。OVA-OA中的OA剂量越大、作用时间越长,则细胞生长抑制作用越强。OVA-OA的癌细胞生长抑制作用是通过损伤细胞膜导致LDH释放率增大;使细胞周期阻滞在G0/G1期和S期从而阻滞细胞生长周期;使晚期凋亡和坏死的细胞百分比增多来实现的。
[1]Hakansson A,Zhivotovsky B,Orrenius S,et al. Apoptosis induced by a human milk protein[J]. Proceedings of the National Academy of Science,1995,92(17):8064-8068.
[2]Svensson M,Hakansson A,Mossberg AK,et al. Conversion ofα-lactalbumin to a protein inducing apoptosis[J]. Proceedings of the National Academy of Science of the United States of America,2000,97:4221-4226.
[3]Tolin S,Franceschi GD,Spolaore B,et al. The oleic acid complexes of proteolytic fragments ofα-lactalbumin display apoptotic activity[J]. The FEBS Journal,2010,277:163-173.
[4]Wilhelm K,Darinskas A,Noppe W,et al. Protein oligomerization induce by oleic acid at the solid-liquid interface-equine lysozyme cytotoxic complexes[J]. The FEBS Journal,2009,276:3875-3989.
[5]Liskova K,Auty MAE,Chaurin V,et al. Cytotoxic complexes of sodium oleate with beta-lactoglobulin[J]. European Journal of Lipid Science and Technology,2011,113(10):1207-1218.
[6]Fang B,Zhang M,Tian M,et al. Bovine lactoferrin binds oleic acid to form an anti-tumor complex similar to HAMLET[J]. Biochimica et Biophysica Acta,2014,1841:535-543.
[7]Huntington JA,Stein PE. Structure and properties of ovalbumin[J]. Journal of Chromatography B,2001,756(1-2):189-198.
[8]Kaspersen JD,Pedersen JN,Hansted JG,et al. Generic structure of cytotoxic liprotides:nano-sized complexes with oleic acid cores and shells of disordered proteins[J]. Chembiochem,2014,15(18):2693-2702.
[9]Sponton OE,Perez AA,Carrara CR,et al. Linoleic acid binding properties of ovalbumin nanoparticles[J]. Colloids and Surfaces B:Biointerfaces,2015,128:219-226.
[10]Kamijima T,Ohmura A,Sato T,et al. Heat-treatment method for producing fatty acid-bound alpha-lactalbumin that induces tumor cell death[J]. Biochemical and Biophysical Research Communications,2008,376:211-214.
[11]Fang B,Zhang M,Jiang L,et al. Influence of pH on the structure and oleic acid binding ability of bovineα-lactalbumin[J]. Protein Journal,2012,31:564-572.
[12]Brinkmann CR,Heegaard CW,Petersen TE,et al. The toxicity of alpha-lactalbumin made lethal to tumor cells is highly dependent on oleic acid and induces killing in cancer cell lines and noncancer-derived cells[J]. FEBS Journal,2011(278):1955-1967.
[13]Delgado Y,Cruz MM,Figueroa CM,et al. The cytotoxicity of BAMLET complexes is due to oleic acid and independent of theα-lactalbumin component[J]. FEBS Open Bio,2015,5:397-404.
[14]Popovich DG,Kitts DD. Structure-function relationship exists for ginsenosides in reducing cell proliferation and induce apoptosis in the human leukemia(THP-1)cell line[J]. Archives of Biochemistry and Biophysics,2002,406(1):1-8.
[15]Sargent J,Taylor C. Appraisal of the MTT assay as a rapidtest of chemosensitivity in acute myeloid leukaemia[J]. British Journal of Cancer,1989,60(2):206-210.
[16]Alday E,Valencia D,Carreno AL,et al. Apoptotic induction by pinobanksin and some of its ester derivatives from Sonoran propolis in a B-cell lymphoma cell line[J]. Chemico-Biological Interactions,2015,242:35-44.
[17]张永奎,李建民,王东隶,等. 大蒜素对体外人骨肉瘤细胞周期和凋亡的影响[J]. 肿瘤,2015,55(5):214-222.
[18]方冰. 乳白蛋白-油酸复合物的制备及其抗肿瘤机理研究[D]. 北京:中国农业大学,2013,53.
[19]Permyakovz SE,Knyazeva EL,Khasanova LM,et al. Oleic acid is a key cytotoxic component of HAMLET-like complexes[J]. Biological Chemistry,2012,393(1-2):85-92.
[20]Zhu Y,Schwarz S,Ahlemeyer B,et al. Oleic acid cause apoptosis and dephosphorylates bad[J]. Neurochemistry International,2005,46:127-135.
[21]Mossberg AK,Puchades M,Halskau O,et al. HAMLET interacts with lipid membranesand perturbs their structure and integrity[J]. Plos One,2010,5(2):e9384.
[22]Span LFR,Pennings AHM,Vierwinden G,et al. The dynamic process of apoptosis analyzed by flow cytometry using Annexin-V/propidium iodide and a modified in situ end labeling technique[J]. Cytometry,2002,47(1):24-31.
[23]高燕,林莉萍,丁健. 细胞周期调控的研究进展[J]. 生命科学,2005,17(4):318-322.
[24]Chiu A,Shi XL,Lee WKP,et al. Review of chromium(VI)apoptosis,cell-cycle-arrest,and carcinogenesis[J]. Journal of Environmental Science and Health,2010,28(3):188-230.
HAMLET-like cell-growth-inhibitory effect of ovalbumin-oleic acid complex on colon cancer cell
XING Xiao-juan,LIU Jian-lei,JING Hao*
(College of Food Science & Nutritional Engineering,China Agriculture University,Beijing 100083,China)
A complex ofα-lactalbumin and oleic acid has previously been shown to have growth-inhibitory effect on cancer cells(Human alpha-lactalbumin made lethal to tumor cells,HAMLET). Ovalbumin and oleic acid complex was prepared and its cell growth inhibition effect,along with contribution of oleic acid,were all evaluated on Caco-2 cell by using cell-growth inhibition,cellular membrane integrity,cell cycle and apoptosis assays. The result showed that OVA-OA significantly(p<0.05)inhibited cell growth at 182 μmol/L(OA),and the inhibitory effect was enhanced as the concentration was increased to 273 μmol/L. The inhibitory effect was also increased as incubation time was extended in a time-dependent manner. OA at 182 μmol/L also exhibited remarkable cell-growth-inhibitory effect in a similar pattern to OVA-OA,while its inhibitory effect was lower than that of OVA-OA at the same OA concentration of 273 μmol/L. Both OVA-OA and OA could increase LDH release rate,lead to cycle arrested at G0/G1and S phases,and induce apoptosis. In conclusion,the complex of OVA and OA has HAMLET-like cell-growth-inhibitory effect,which could be mainly contributed to OA. The mechanisms were associated with damage of cellular membrane integrity,arrest of cell cycle and induction of cell apoptosis.
ovalbumin;oleic acid;cell-growth inhibition;lactate dehydrogenase;cell apoptosis;cell cycle
2016-03-30
邢效娟(1992-),女,硕士研究生,研究方向:蛋白质与小分子相互作用,E-mail:x2010314024@163.com。
景浩(1957-),男,博士,教授,研究方向:分子营养与食品安全,E-mail:haojing@cau.edu.cn。
“十二五”农村领域国家科技计划课题子课题(2012BAD28B08)。
TS201.4
A
1002-0306(2016)18-0137-07
10.13386/j.issn1002-0306.2016.18.017

