分子对接模拟与光谱法研究没食子酸丙酯和牛血清白蛋白的相互作用
朱国飞,滕 腾,邓 斌
(1.贵州理工学院制药工程学院,贵州贵阳 550003;2.四川大学生命科学学院,四川成都 610065)
分子对接模拟与光谱法研究没食子酸丙酯和牛血清白蛋白的相互作用
朱国飞1,滕腾2,邓斌1
(1.贵州理工学院制药工程学院,贵州贵阳 550003;2.四川大学生命科学学院,四川成都 610065)
运用荧光光谱法、紫外吸收光谱法等方法对没食子酸丙酯(PG)与牛血清白蛋白(BSA)之间的相互作用进行了研究。荧光猝灭计算结果表明PG与BSA间的结合作用较强,猝灭机制为静态猝灭,测得其299 K时的结合常数KA为1.03×105L·mol-1,两者的作用距离为1.71 nm。热力学参数计算结果表明PG与BSA相互作用力主要为范德华力与氢键作用力。通过探针分子取代反应确定了PG在BSA上的结合位点是亚级结构域IIA。圆二色谱的测定结果表明PG的结合导致了蛋白中α-螺旋结构的减少以及无规则卷曲的增加。本文最后通过计算机模拟分子Dock的方法模拟出了PG与BSA的结合构象,所得到的结合参数与之前的计算结果相符。
没食子酸丙酯,牛血清白蛋白,荧光光谱法,相互作用
没食子酸丙酯[1](Propyl Gallate,PG),又称槠酸丙酯,化学名为3,4,5-三羟基苯甲酸丙酯。PG是一种常见的抗氧化剂,它的抗氧化性来源于它能自身氧化,从而降低周围环境的含氧量,它能与蛋白质结合抑制某些氧化酶的活性[2],还能提供氢原子与脂肪自由基进行结合,终止油脂的自动氧化连锁反应[3-4]。由于其安全无毒性抗氧化,因此已被广泛应用于食品行业,以防止食品的变质和腐败。此外,一些研究发现,PG对一些组织和细胞还具有生理活性,例如,PG可以作为抗氧化剂防止上皮细胞免除H2O2的损害[5],在小鼠耳肿胀实验中PG具有典型的抗炎活性[6],最近一些实验还发现,PG能抑制一些肿瘤细胞的生长,诱导肿瘤细胞的凋亡[7-9]。因此,PG在功能性保健食品开发中具有广泛的应用前景。
在血液中,血清白蛋白(Serum Albumin,SA)是血浆中含量最丰富的蛋白质,起着贮存外源小分子和内源代谢产物的重要作用,是最为重要的药物结合蛋白。它可与多种阳离子、阴离子和其他小分子物质结合,作为它们的载体。研究PG与SA之间的相互作用,有助于了解PG在体内的运输和分布情况,对阐明PG的生理活性有着非常重要的意义。研究表明,PG可通过疏水作用与人血清蛋白HSA(Human Serum Albumin)发生静态结合,结合位点位于HSA亚结构域IIA(药物结合位点I)处,同时研究表明,PG与HSA的结合会导致HSA二级结构发生变化,主要表现为α螺旋结构减少[10-11]。但是到目前为止,还没有关于PG与牛血清蛋白BSA(Bovine Serum Albumin)相互作用的文献报道。因此,作为PG与SA相互作用研究的补充,本文采用分子对接模拟以及光谱法等方法,详细研究了PG与BSA的结合过程,希望能进一步阐明PG在血液中的结合与运输,为PG作为食品抗氧化剂、功能性保健食品、新药组分等的设计和开发提供理论基础。
1 材料与方法
1.1材料与仪器
牛血清蛋白纯度≥98%,上海丽珠东风生物技术有限公司;没食子酸丙酯纯度≥98.0%,HPLC,美国Sigma公司;胆红素纯度≥95.0%,UV,美国Sigma公司;扑尔敏纯度≥99.0%,美国Sigma公司;其它化学试剂分析纯。
PHS-4C+型pH计成都方舟科技有限责任公司;高压灭菌锅上海申安医疗有限责任公司;Hitachi-F4500型荧光分光光度计日本日立公司;Unico 2808型紫外可见光分光光度计上海尤尼科仪器有限公司;AVIV Model 400型圆二色谱仪美国Aviv。
1.2实验方法
用50×10-3mol/L的磷酸盐缓冲溶液(pH=7.4)配制浓度为3.0×10-6mol/L的BSA溶液,备用。
1.2.1荧光发射光谱检测PG与BSA的相互作用取2 mL浓度为3.0×10-6mol/L的BSA溶液加入石英比色杯中,用微量进样器每次加入定量的PG溶液并充分混匀(保证总体积几乎不变的前提下使混合溶液中PG的终浓度分别为0、1、5、10、15、20、25×10-6mol/L),每次加入混匀静置作用10 min后开始进行检测。检测条件:激发狭缝5 nm,发射狭缝10 nm,激发电压700 V,激发波长分别为278 nm和295 nm,用荧光光谱仪扫描溶液在200~400 nm的荧光光谱数据。为了检测PG与BSA的结合方式,分别在299 K和309 K两个恒温温度条件下(299 K接近室温,309 K接近体温)测定其猝灭常数。每个浓度条件下测定5次,计算平均值,重复实验3次。样品光谱均扣除了缓冲液的背景光谱。
1.2.2PG与BSA结合距离的计算取2 mL浓度为3.0×10-6mol/L的BSA溶液加入石英比色杯中,用微量进样器加入PG溶液使混合溶液中PG的终浓度同样为3.0×10-6mol/L,充分混匀。荧光发射光谱检测:激发狭缝5 nm,发射狭缝10 nm,激发电压700 V,激发波长为278 nm,波长扫描范围300~400 nm,299 K恒温条件;紫外吸收光谱检测:波长扫描范围200~700 nm,299 K恒温条件。扫描次数5次,计算平均值,重复实验3次,样品光谱均扣除缓冲液的背景光谱。
1.2.3PG与BSA结合位点的判定取2 mL浓度为3.0×10-6mol/L的BSA溶液加入石英比色杯中,用微量进样器加入PG溶液使混合溶液中PG的终浓度同样为3.0×10-6mol/L,充分混匀。用微量进样器每次加入定量的胆红素(保证总体积几乎不变的前提下使混合溶液中胆红素的终浓度分别为0、3、6、9、12、15、18×10-6mol/L)每次加入混匀之后静置,299 K温度下充分作用10 min后开始进行检测。荧光发射光谱检测:激发狭缝5 nm,发射狭缝10 nm,激发电压700 V,激发波长为278 nm,波长扫描范围300~400 nm,299 K恒温条件。每个浓度条件下测定5次,计算平均值,重复实验3次,样品光谱均扣除了缓冲液的背景光谱。同种方法,以扑尔敏为探针,重复以上实验。
1.2.4金属离子对PG与BSA结合作用的影响取2 mL浓度为3.0×10-6mol/L的BSA溶液加入石英比色杯中,用微量进样器加入AlCl3溶液使混合溶液中Al3+的终浓度同样为3.0×10-6mol/L,充分混匀。再用微量进样器每次加入定量的PG溶液并充分混匀(保证总体积几乎不变的前提下使混合溶液中PG的终浓度分别为0、1、5、10、15、20、25×10-6mol/L),299 K温度下静置作用10 min后开始进行荧光发射光谱检测。检测条件:激发狭缝5 nm,发射狭缝10 nm,激发电压700 V,激发波长为278 nm,扫描波长范围200~400 nm。每个浓度条件下测定5次,计算平均值,重复实验3次,样品光谱均扣除了缓冲液的背景光谱。采用同种方法,重复以上实验检测Ca2+、Co2+以及Cu2+对PG与BSA结合作用的影响。
1.2.5同步荧光光谱测定PG对BSA构象的影响样品处理方法与荧光发射光谱检测(1.2.1)相同。检测条件:激发狭缝5 nm,发射狭缝10 nm,激发电压700 V,恒温299 K,波长扫描范围250~350 nm,分别记录Δλ=15 nm和Δλ=60 nm(Δλ=激发光波长-发射光波长)时的荧光光谱数据。每个浓度条件下测定5次,计算平均值,重复实验3次,样品光谱均扣除了缓冲液的背景光谱。
1.2.6圆二色谱测定PG对BSA二级结构的影响BSA样品浓度3.0×10-6mol/L,PG处理终浓度分别为0、3、15×10-6mol/L。在AVIV Model 400型圆二色谱仪上记录远紫外圆二色谱。扫描范围为200~260 nm,激发光和发射光狭缝均设为1 nm,扫描速度设为中速,光谱校正设为开启以消除光栅和检测器响应的波长依赖性。每个浓度条件下测定5次,计算平均值重复实验3次。
1.2.7结合模拟(Docking)采用Autodock软件(Scripps研究所),对PG和BSA的分子对接进行模拟。Docking工具采用Autodock 4.2版本(MGL Tools for win)。配体与受体文件分别来源于Protein Data Bank(www.rcsb.org)与Pubchem(pubchem. ncbi. nlm.nih.gov)。后期使用Accelrys-Discovery Studio进行分析和输出。
1.3数据处理
1.3.1Stern-Volmer方程计算荧光猝灭机制
F0/F=1+Kqτ0[Q]=1+Ksv[Q]
式(1)
其中:F0为未加猝灭剂时的荧光强度,F为加猝灭剂后的荧光强度,[Q]为猝灭剂浓度,Ksv为Stern-Volmer动态猝灭常数,Kq为动态荧光猝灭速率常数,τ0为生物大分子荧光平均寿命,大约为10-8s[10-11]。
1.3.2PG与BSA结合常数和结合数的计算
lg[(F0-F)/F]=lg KA+n·lg[Q]
式(2)
其中F0与[Q]同上,KA为结合常数,n为结合位点数[12]。
1.3.3结合模式的判定范氏霍夫方程:
lnΔ(K2/K1)=ΔH(1/T1-1/T2)/R
式(3)
ΔG=-RTlnK
式(4)
ΔS=-(ΔG-ΔH)/T
式(5)
其中T1、T2为不同温度,K1、K2为不同温度下药物与蛋白质结合的结合常数,R为气体分子常数,ΔH为焓变,ΔG为吉布斯自由能变化值,ΔS为熵变。在药物与生物大分子的反应中,其主要作用类型可根据反应前后热力学参数ΔH焓变和ΔS熵变的大小来判断。
当ΔH>0,ΔS>0时为疏水作用力;当ΔH<0,ΔS<0时为氢键和范德华力;当ΔH≈0,ΔS>0时为静电引力[13]。
1.3.4结合距离的计算Förster的偶极-偶极非辐射能量转移理论:
E=R06/(R06+r6)
式(6)
R06=8.8×10-25K2n-4ΦJ
式(7)
J=∑F(λ)ε(λ)λ4Δλ/∑F(λ)Δλ
式(8)
E是授体与受体间能量转移效率,F和F0分别为存在和不存在能量接受体时能量给予体的荧光发射强度,R0是转移效率为50%时的临界距离,K2为偶极空间取向因子,n为介质的折射指数,Φ为授体的荧光量子产率,J为授体的荧光发射光谱与受体的吸收光谱间的光谱重叠积分,F(λ)为荧光授体在波长λ处的荧光强度,ε(λ)为受体在波长λ处的摩尔消光系数,r为药物与蛋白质结合时结合位置处蛋白质分子中荧光发射基团之间的距离[14-15]。
1.3.5分子探针相关判定Sudlow等提出的探针取代计算方法[16]:
P(Probe displacement)(%)=F2/F1×100
式(9)
1.3.5结合模拟(Docking)相关软件及说明均来自http://autodock. scripps. edu/和http://accelrys. com/[10]。
2 结果与讨论
2.1荧光发射光谱检测PG与BSA的相互作用
不同的荧光基团在有特定的荧光激发波长的情况下能发出内源性荧光。在BSA中含有色氨酸、酪氨酸等氨基酸残基,均有内源荧光现象,并且它们的内源荧光对BSA的三级结构和构象稳定性的改变非常敏感,所以它们的光谱测定和分析可以作为研究BSA构象改变的工具。
如图1(A)所示,在298 K的温度条件下,当激发波长λex=278 nm时(色氨酸为荧光的主要贡献基团),BSA所发出内源性荧光的波峰位于342 nm左右,而PG本身在这附近没有荧光发射峰,表明其色氨酸残基处于一个相对疏水环境下[10-12]。固定BSA浓度,随着PG作用浓度的增加,BSA的内源性荧光强度发生了规律性的减弱,这说明PG与BSA发生了较强的相互作用并导致了BSA内源性荧光发生猝灭[10-12]。光谱学证明,荧光峰值的移动表明发色基团所处的微环境发生了空间构象变化。研究结果显示随着PG作用浓度的增加,本身位于342 nm处的荧光峰值有轻微蓝移(蓝移0.5 nm),这暗示了色氨酸残基周围微环境的疏水性有微弱增加[10-12],但是值得注意的是不管是波峰位置还是波形的变化都不是非常的明显,造成这一现象的原因可能是其它的荧光基团对色氨酸的荧光光谱产生了干扰,因此,在下文中将采用同步荧光光谱进行验证。当激发波长λex=295 nm时(图1B),与色氨酸的荧光光谱相似,随着PG作用浓度的增加,酪氨酸残基荧光强度也明显发生淬灭,波峰几乎没有发生移动,暗示PG与BSA发生了较强的相互作用,但是酪氨酸残基的微环境并没有发生明显变化。同时研究还发现,当检测温度为308 K(略)时,实验结果与299 K条件下相似。因BSA包含了两个色氨酸残基,分别位于其氨基酸序列的134位和213位上,134位Trp残基暴露于亲水环境中,而213位Trp残基则处于疏水腔中,并可与多种配体基团结合[16],所以后文将重点对激发光λex=278 nm时情况进行探讨。

图1 PG与BSA相互作用的荧光光谱图Fig.1 BSA fluorescence spectra in the presence of PG注:图A和图B分别是激发光为278 nm和295 nm时PG与BSA相互作用的荧光发射光谱。检测条件:pH=7.4,温度为298 K,BSA的浓度为3×10-6 mol/L,曲线1~7分别代表PG的作用浓度为0、1、5、10、15、20、25×10-6 mol/L。
2.2PG对BSA猝灭方式的判定
众所周知,根据荧光猝灭机制的不同,猝灭方式可分为动态猝灭和静态猝灭两种。在不同温度条件下检测样品体系的荧光特征,能够有效的区分这两种淬灭方式。简单的说,如果是动态淬灭,随着检测温度的升高,荧光物质分子与猝灭剂之间的有效碰撞次数、能量转移效率均会增加,从而导致淬灭常数升高;相反,假如是,静态淬灭随着检测温度的升高,会降低猝灭剂-荧光分子复合物的稳定性,从而导致淬灭常数的降低[10-11]。根据Stern-Volmer方程[公式(1)],将F0/F对[Q]作图,可求得Ksv与Kq。从图2中可以看到,在两个温度条件下,按Stern-Volmer方程作图分别得到一条直线,即斜率均是固定值,这表明在检测体系中只存在一种荧光体,并且对于淬灭体都是可接近的。随着温度的增加,拟合曲线的斜率减小,即猝灭常数变小,这表明由于PG与BSA形成了复合物,复合物在温度升高时稳定性降低导致荧光猝灭效应变弱,这是静态猝灭的标志性特点[17]。并且通过计算,Kq的数量级为1012(表1),远远大于最大扩散控制的碰撞猝灭速率常数为2.0×1010L·mol-1·s-1,从另一个方面证实了PG对BSA的荧光猝灭方式为静态猝灭[17]。
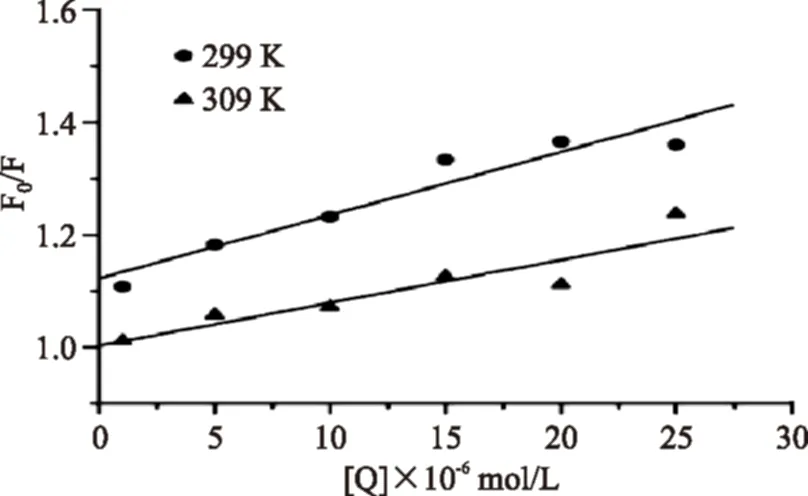
图2 不同温度下PG猝灭BSA的Stern-Volmer曲线Fig.2 The Stern-Volmer polts of BSA quenched by PG注:激发波长λex=278 nm,pH=7.4,直线1和2分别为检测温度为299 K和309 K时的Stern-Volmer拟合曲线。

温度(K)Ksv(×104L·mol-1)Kq(×1012L·mol-1·s-1)r2991.12501.12500.9873090.76300.76300.991
注:Ksv为Stern-Volmer动态猝灭常数,Kq为动态荧光猝灭速率常数,r是Stern-Volmer方程的相关系数。
2.3PG与BSA结合常数和结合数的计算
在蛋白和小分子相互作用的过程中,结合常数KA通常用来表示蛋白和小分子结合的强度,而结合数n表示小分子与蛋白结合作用时两者数量之比。它们的测算对于后续研究药物与蛋白的相互作用关系非常重要,而在静态猝灭过程中,它们之间的关系满足公式(2)[12]。以lg[(F0-F)/F]对lg[Q]作图,可以求出n和KA。
通过计算,在299 K条件下,PG与BSA的结合常数KA=1.0281×105L·mol-1(表2),明显比一般配体-蛋白的结合常数要大[18-19],这表明PG同BSA具有较高的亲和能力,发生了较强的相互作用,暗示PG能够通过BSA蛋白在体内进行储存和运输,同时也意味着PG在功能性食品开发中具有广泛的潜在应用前景。当测试温度升高到309 K时,研究发现PG与BSA的结合常数降低了接近10倍,表明在较高温度下,PG-BSA复合物发生了分解,进一步暗示PG与BSA作用方式为静态结合。同时通过计算还发现,在299 K和309 K两个温度条件下,PG与BSA的结合数n分别为0.848和1.035,这两个数值都非常接近于1,反映出PG与BSA可能采取1∶1分子比的方式进行结合,暗示在BSA上可能只有一个PG的结合位点[10]。
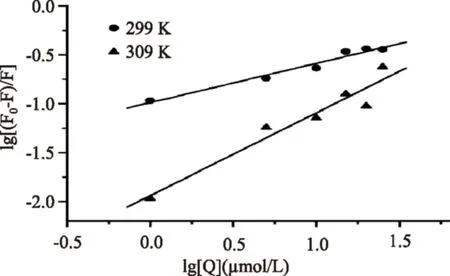
图3 利用双对数作图求得不同温度下PG与BSA的结合常数Fig.3 Double-logarithm plot of PG quenching effect on BSA fluorescence at different temperature

温度(K)KA(×105L·mol-1)结合数nr2991.02810.8480.9953090.11481.0350.992
注:检测条件:pH=7.4;激发波长λex=278 nm。KA为结合常数,n为结合位点数,r是方程的相关系数。
2.4PG与BSA结合作用力的判定
通过考察蛋白与小分子之间结合作用力的判定,可以对其结合作用进行更深入的阐释,它们相互之间的结合力主要有疏水作用力、静电作用力、范德华力及氢键作用等。Ross等[13]总结了一系列热力学的规则,并提出了判断生物大分子与小分子结合力性质和生物大分子自身结合力性质的模型。当反应温度变化在一个小范围的时候,反应的焓变ΔH可以视为一个固定的常数。因此根据热力学模型利用方程(3)~(5)求解,即可确定分子间作用力的类型与结合的模式.
计算结果见表3,可知ΔH<0且ΔS<0,这种情况通常是由氢键和范德华力引起[13],因此PG与BSA间的结合应该主要由氢键与范德华力进行维持。

表3 PG与BSA相互作用的热力学参数
注:检测条件:pH=7.4;激发波长λex=278 nm。ΔH为焓变,ΔG为吉布斯自由能变化值,ΔS为熵变。
2.5PG与BSA结合距离的计算
根据Förster的偶极-偶极非辐射能量转移理论,当给体与受体浓度相近时,如给体荧光光谱与受体紫外吸收光谱存在叠加且两者距离小于7 nm,那么有可能发生非辐射能量转移[14]。图4为299 K温度条件下BSA的荧光光谱与PG的紫外吸收光谱(309 K的图略),根据公式(6)~(8)可求出该PG与BSA的结合距离(表4)。当K2、n-4、Φ分别取2/3、1.36和0.15时[15],299 K温度条件下求出PG与BSA间能量转移效率为52.17%,转移效率为50%时的临界距离R0=1.74 nm,PG与BSA结合距离r=1.71 nm。当温度升高到309 K时,PG与BSA间能量转移效率下降到42.86%,同时结合距离r变大,造成这一现象的原因是在较高温度下,PG-BSA复合物的稳定性降低,结合常数下降。同时研究还发现,不同温度条件下所得r值均远远小于7 nm,这表明供体BSA色氨酸残基与受体PG在空间上靠的非常接近,暗示BSA与PG发生并形成了非辐射能量转移。

图4 BSA的荧光光谱与PG的紫外吸收光谱Fig.4 The overlap of the fluorescence spectrum of BSA and the absorbance spectrum of PG注:激发波长为278 nm;pH=7.4;T=299 K;CBSA=CPG=3.0×10-6 mol L-1。
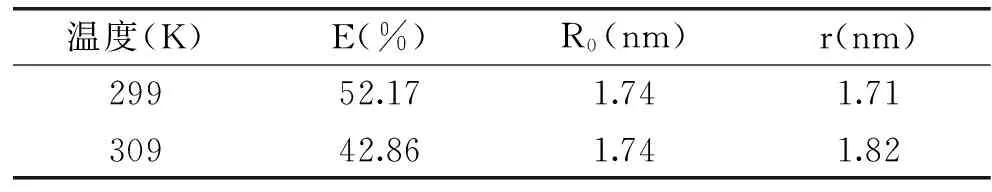
温度(K)E(%)R0(nm)r(nm)29952.171.741.7130942.861.741.82
注:E是授体与受体间能量转移效率,R0是转移效率为50%时的临界距离,r为PG与结合位置处BSA色氨酸荧光发射基团之间的距离。
2.6PG与BSA结合位点的判定
BSA包含了两个色氨酸残基,分别位于其氨基酸序列的134位和213位上。134位Trp残基暴露于亲水环境中,而213位Trp残基则处于疏水腔中,并可与多种配体基团结合[16]。Klaus J Fehske[20]的研究表明,药物在SA上的结合部位存在着以下三个:吲哚及苯二氮卓结合部位;华法令及阿扎丙宗结合部位;洋地黄毒甙结合部位,每个结合部位都包含了两个亚域。在控制药物浓度的前提下,通过使用结合部位已知的荧光探针(即标记配体),可以和对应的药物分子在蛋白的结合部位上进行竞争结合,以此便可以确定药物在蛋白质上的结合部位。按Sudlow等提出的探针取代计算方法[公式(9)][16],选择胆红素(结合位点为亚结构域IIA)和扑尔敏(结合位点为亚结构域IIIA)作为荧光探针[10],对PG是否被取代进行检测,从而判定PG在BSA上的结合位置。
由图5可以看出,探针浓度不断增大时,实验结果发生以下变化:加入扑尔敏探针后,反应体系的荧光强度并没有发生明显的变化;相反,在加入胆红素后,反应体系的相对荧光强度发生明显降低。实验结果表明胆红素很可能取代了PG在BSA上的结合,因胆红素在BSA上的结合位点位于亚结构域IIA上,这也就暗示PG在BSA上的结合位点也位于亚结构域IIA。
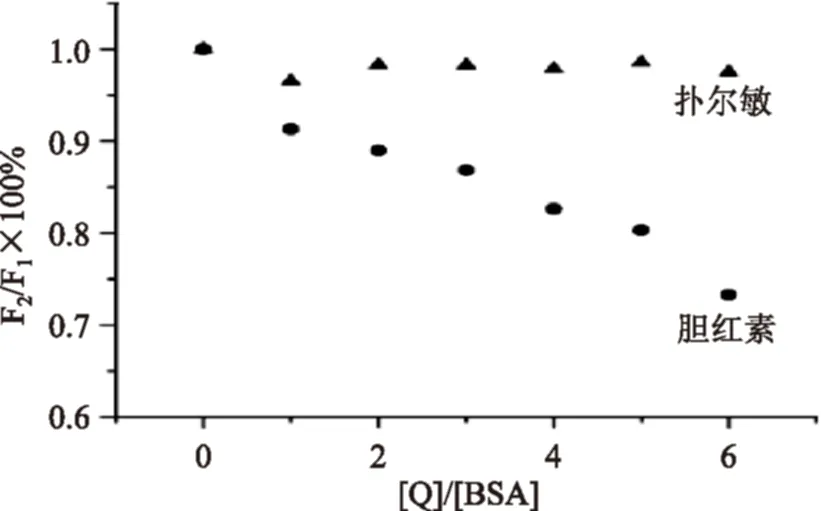
图5 以胆红素和扑尔敏为探针取代PG在BSA结合部位Fig.5 Probe displacement of PG-BSAby bilirubin and chlorpheniramine maleate注:激发光波长278 nm;温度298 K;pH=7.4;CBSA=CPG=3.0×10-6 mol/L;扑尔敏:C扑尔敏/CBSA=0、1、2、3、4、5、6;胆红素:C胆红素/CBSA=0、1、2、3、4、5、6。
2.7金属离子对PG与BSA结合作用的影响
PG含多个酚羟基,有较强的金属螯合能力,可与多种金属离子形成配合物,而且所得配合物均为多个PG分子与单个金属离子形成[12]。因此金属离子的存在对PG的活性可能存在影响,以下对常见的几种金属离子存在时的结合过程进行研究,得到的计算结果见表5。

表5 不同金属离子条件下PG与BSA的结合常数
注:激发波长278 nm;pH7.4;温度299 K;无金属离子存在条件下KA=1.03×105L·mol-1。
从表5中可以看到金属离子的存在对PG与BSA的结合存在一定程度影响,在有金属离子存在的条件下,PG与BSA的结合常数明显降低,表明PG与BSA的结合能力下降,其中,以Co2+降低最多,Cu2+降低最少。根据前面结合位点的判定,初步认为可能是由于多个PG分子与金属离子螯合形成配合物(其中以Co2+最易与PG形成配合物),使得PG分子结构增大,对其进入Trp213所在疏水腔产生一定阻碍作用,所以导致以上结合常数都有不同程度的降低。

表6 PG对BSA的二级结构的改变
注:采用CDNN软件对BSA二级结构进行估算,实验独立重复次数为3次。
2.8同步荧光测定PG对BSA构象的影响
在光谱学研究中发现,氨基酸残基的最大荧光波长与其所处环境的疏水性有关。如果氨基酸所处环境的疏水性降低,将对其荧光性质产生影响,表现为其最大发射波长红移,因此根据荧光波长的改变可判断蛋白质构象的变化。蛋白质内,多种内源荧光生色基团会产生不同荧光,而普通的荧光光谱中能检测到的发射峰存在一定程度的重叠,不易区分,而采用同步荧光光谱则可以将其区分开来,因此采用同步荧光光谱对BSA构象变化进行研究。
当BSA浓度一定,PG浓度不断增加时,采用同步荧光光谱记录Δλ=15 nm和Δλ=60 nm条件下荧光光谱数据,如图6所示。

图6 PG与BSA相互作用的同步荧光光谱Fig.6 Synchronous fluorescence spectra of PG-BSA注:测试温度299 K,pH=7.4,BSA浓度为3.0×10-6 mol/L;图A和图B分别为Δλ=15 nm和Δλ=60 nm时PG与BSA相互作用的同步荧光光谱;曲线1~7分别代表PG作用浓度为0、1、5、10、15、20、25×10-6 mol/L。
实验结果表明:当Δλ=15 nm时,随着PG的浓度增加,同步荧光波峰强度略微降低,降低幅度为9.20%,而波峰位置几乎没有发生任何变化,这表明BSA中的酪氨酸残基的疏水性和极性没有发生明显变化。而Δλ=60 nm时,同步荧光波峰强度明显降低,降幅为31.18%,并且最大发射波长位置出现轻微的蓝移(2 nm),这表明色氨酸残基的环境极性减弱、疏水性逐渐增强,肽键的伸展程度有所减弱,PG与BSA的作用改变了色氨酸残基的微环境,色氨酸残基“包埋”状态增加[10-11],这与前文激发光为278 nm时发射光谱的结果吻合。这也证明PG分子是可以进入BSA的立体结构中的,不但使色氨酸残基的荧光强度发生淬灭,而且还能导致色氨酸残基的微环境发生改变,疏水性增加。
2.9圆二色谱分析PG对BSA构象的影响
远紫外圆二色谱可以较为精确的测定蛋白二级结构的变化,因此本文采用Far-UV CD光谱对PG和BSA的结合过程进行了研究,以探讨PG是否能够诱导BSA的二级结构的变换。如图7所示,BSA在208 nm和222 nm处有两个负峰,属于典型的高比例α-螺旋结构蛋白。

图7 远紫外圆二色谱分析PG与BSA的结合作用Fig.7 The far-UV CD spectra of PG with BSA注:测试温度299 K,pH=7.4,BSA浓度为3.0×10-6 mol/L;曲线1~3分别代表PG作用浓度为0、3、15×10-6 mol/L。
通过CDNN软件对二级结构的估算发现,由于PG的结合导致了BSA中规则二级结构的减少以及无规则卷曲的增加,其中主要是α-螺旋结构的减少(表6)。天然状态下的BSA含有54.3%α-螺旋,9.8%β-折叠,14.1%β-转角以及21.8%无规则卷曲。而与PG进行结合后,α-螺旋所占比例降低到52.9%,而无规则卷曲比例增加到22.6%,β-折叠和β-转角的比例在结合前后没有显著的变化,这说明PG对其并未产生显著的影响。
2.10分子结合模拟
为研究PG与BSA的结合位点,还可以采用分子对接模拟的方法。配体与受体的相互作用是分子识别的过程,其中主要包括静电作用、氢键作用、疏水作用、范德华作用等。通过分子模拟,可以预测两者之间的结合模式、作用距离和作用力等,从而进行药物的虚拟筛选等研究工作[13]。Autodock是一套Scripps的Olson科研小组开发的分子对接软件包,采用模拟退火和遗传算法来寻找受体和配体最佳的结合位置,用半经验的自由能计算方法来评价受体和配体之间的匹配情况用来自动分子对接的软件,可以预测小分子是如何与已知三维结构的受体结合的[14]。通过Autodock软件,在之前研究的基础上,对PG和BSA的分子对接实现了模拟(图8)。

图8 PG与BSA结合的分子对接Fig.8 The docking result of PG with BSA注:A、B和C分别为PG与BSA结合分子对接的表面、二级结构以及微环境示意图。
在图8A、B中,通过展示分子表面,可以发现PG结合点位于BSA的Trp213附近的疏水腔内(即BSA的亚域结构IIA中),此位置可结合大多数的小分子药物。为进一步查看PG与BSA作用的微环境,列出了结合位点附近对结合作用贡献较大的氨基酸残基(图8C),分别是Aeg208、Ala209、Ala212、Trp213、Leu346、Ala349、Lys350和Glu353。其中PG与Trp213在空间上非常靠近,距离仅为1.84 nm,与之前计算得到PG-BSA的结合距离1.71 nm非常接近。这也解释了为什么PG与BSA结合会导致内源荧光发生淬灭的原因:PG通过结合到Trp213附近的疏水腔,引起周围氨基酸残基微环境发生变化,导致Trp213周围包埋度增加,空间结构更加严密,从而表现出BSA内源荧光的猝灭变化。
3 结论
利用光谱法对蛋白结构改变进行研究,是比较经典的技术手段,本文通过应用光谱法,对PG和BSA的相互作用进行了较为详细的考察和论述。研究发现PG对BSA的内源荧光产生了猝灭作用,进一步的光谱分析表明其猝灭机制是静态猝灭,两者通过形成药物-蛋白复合物,使得BSA荧光峰值发生蓝移。通过计算得到了其结合作用的结合常数、结合数等基本参数,在热力学模型的指导下,还进一步得出了其作用力类型主要是氢键和范德华力,结合距离约为1.71 nm。根据Sudlow等[16]提出的探针取代方法,利用胆红素和扑尔敏两种结合在BSA不同位点的探针,对PG进行竞争结合后表明其结合部位与胆红素一致,位于BSA上的亚域结构IIA,这一位点还可结合华法令、p-ABE、DNSA等小分子药物,位于Trp213附近的疏水腔内,这一结果,与先前PG与HSA相互作用的结果非常类似[10]。经过远紫外圆二色谱的测定发现PG对BSA的二级结构产生了影响。BSA是典型的α-螺旋结构为主的蛋白,氢键对其结构的稳定性维持是非常重要的,而远紫外圆二色谱的结果表明BSA在PG存在的情况下,α-螺旋结构发生减少,无规则卷曲结构增加。同步荧光光谱结果表明PG与BSA的结合导致BSA的构象发生了一定程度的变化,表现为色氨酸残基的环境极性减弱、疏水性逐渐增强,色氨酸残基“包埋”状态增加。这证明PG分子的确可以进入BSA的立体结构中,使得BSA构象发生变化。同时,采用分子对接的方式模拟PG与BSA的结合,通过计算自由能,推算了最佳结合构象,研究结果表明PG正是通过进入Trp213附近的疏水腔,与周围氨基酸残基相互作用,从而引起了BSA的上述一系列变化。其结合距离与之前热力学模型所得计算值较为相符,能够相互印证。此外本文还考察了在常见金属离子的存在情况下,PG与BSA结合作用受到的影响,提出了PG-金属螯合物的出现影响PG-BSA结合作用这一初步解释。
本文通过研究PG与BSA的结合过程,初步阐明了PG与BSA的相互作用的基本信息,为PG在血液中的结合与运输模式研究以及其作为食品抗氧化剂、药物的设计和开发工作提供了理论基础。
[1]Cui FL,Wang JL,Cui YR,et al. Fluorescent investigation of the interactions between N-(p-chlorophenyl)-N0-(1-naphthyl)thiourea and serum albumin:synchronous fluorescence determination of serum albumin[J]. Analytica Chimica Acta,2006,571(2):175-183.
[2]Ruddle DL,Yengoyan LS,Miquel J,et al. Propyl gallate delays senescence in Drosophila melanogaster[J]. Age,1988,11:54-58.
[3]Yin HJ,Jiang YR,Wu XH,et al. Effect of propyl gallate on activity of cyclooxygenase 1 and 2 in mice’s peritoneal macrophages[J]. Chinese Journal of Integrative Medicine,2004,10:213-217.
[4]Alessio A,Andrea M,Clara M,et al. Identification of Xenoestrogens in Food Additives by an Integrated in Silico andinVitroApproach[J]. Chem Res Toxicol,2009,22:52-63.
[5]Reddan JR,Giblin FJ,Sevilla M,et al. Propyl gallate is a superoxide dismutase mimic and protects cultured lens epithelial cells from H2O2insult[J]. Exp Eye Res,2003,76(1):49-59.
[6]McDonald-Gibson WJ,Saeed SA,Schneider C.The Local Antinociceptive and Topical Anti-inflammatory Effects of Propyl Gallate in Rodents[J]. Br J Pharmacol,1976,58(4):573-581.
[7]Han YH,Park WH. Propyl gallate inhibits the growth of HeLa cells via regulating intracellular GSH level[J]. Food Chem Toxicol,2009,47(10):2531-2538.
[8]Han YH,Moon HJ,You BR,et al. Propyl gallate inhibits the growth of HeLa cells via caspase-dependent apoptosis as well as a G1 phase arrest of the cell cycle[J]. Oncol Rep,2010,23(4):1153-1158.
[9]Chen CH,Lin WC,Kuo CN,et al. Role of redox signaling regulation in propyl gallate-induced apoptosis of human leukemia cells[J]. Food Chem Toxicol,2011,49(2):494-501.
[10]Zhu GF,Wang Y,Xi L,et al. Spectroscopy and molecular docking studies on the binding of propyl gallate to human serum albumin[J]. Journal of Luminescence,2015,159:188-196.
[11]Dolatabadi JEN. Spectroscopic and molecular modeling studies of human serum albumin interaction with propyl gallate[J]. Rsc Advances,2014,4(110):64559-64564.
[12]Kumar RS,Bergh HVD,Wagnières G. Probing the interaction between a surfactant-cobalt(III)complex and bovine serum albumin[J]. Solution Chem,2012,41(2):294-306.
[13]Ross PD,Subramanian S. Thermodynamics of steroid binding to the human glucocorticoidreceptor[J]. Biochemistry,1981,20:3096-3102.
[14]Förster T,Sinanoglu O.:Modern Quantum Chemistry[M]. New York:Academic Press,1996:93-138.
[15]Cyril L,Earl JK,Sperry WM. Biochemists’ Handbook[M]. London:E & FN Epon Press Ltd,1961:84-88.
[16]Sudlow G,Birkett DJ,Wade DN. The characterization of two specific drug binding sites on human serum albumin[J]. Mol Pharmacol,1975,12(6):1052-1061.
[17]Wang Q,Yan J,He J,et al. Characterization of the interaction between 3-Oxotabersonine and two serum albumins by using spectroscopic techniques[J]. Journal of Luminescence,2013,138(6):1-7.
[18]Yue Y,Liu J,Fan J,et al. Binding studies of phloridzin with human serum albumin and its effect on the conformation of protein[J]. Journal of Pharmaceutical & Biomedical Analysis,2011,56(2):336-342.
[19]Kratochwil NA,Huber W,Müller F,et al. Predicting plasma protein binding of drugs:a new approach[J]. Biochemical Pharmacology,2002,64(9):1355-1374.
[20]Fehske KJ,Zube I,Borbe HO,et al.β-Carboline binding indicates the presence of benzodiazepine receptor subclasses in the bovine central nervous system[J]. Naunyn-Schmiedebergs Archives of Pharmacology,1982,319(2):172-177.
Study on the interaction between propyl gallate and bovine serum albumin using fluorescence spectroscopy and molecular docking
ZHU Guo-fei1,TENG Teng2,DENG Bin1
(1.Guizhou Institute of Technology,Guiyang 550003,China;2.College of Life Sciences,Sichuan University,Chengdu 610065,China)
The interaction between propyl gallate(PG)and BSA was studied by the spectroscopy methodinvitro. The quenching mechanism was a static quenching procedure,and the binding constants KAbetween PG and BSA was obtained to be 1.03×105L·mol-1while the binding distance was calculated as 2.2 nm at 299 K. The thermodynamic calculations suggested the van der Waals interactions and the hydrogen bonds play a major part in the interaction between BSA and PG. The further study of binding site showed there was one PG-binding site in the subdomain IIA of BSA. CD spectroscopic further showed that drug complexation altered protein conformation by a major reduction ofα-helix inducing a partial protein destabilization. In addition,the result of autodocking for PG and BSA was simulated,and the parameters of the binding were accorded with the results of the calculation.
propyl gallate;bovine serum albumin;fluorescence spectroscopy;interaction
2016-04-11
朱国飞(1985-),男,博士,副教授,研究方向:生物化学与分子生物学,E-mail:1966243910@qq.com。
贵州省教育厅自然科学研究招标项目(黔教合KY字[2015]368);贵州省科技合作计划项目(黔科合LH字[2015]7102)。
TS202.3
A
1002-0306(2016)18-0158-08
10.13386/j.issn1002-0306.2016.18.022

