咸鱼中生物胺降解菌的筛选与降解特性研究
吴燕燕,钱茜茜,2,陈玉峰,2,杨贤庆,邓建朝
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300;2.上海海洋大学食品学院,上海 201306)
咸鱼中生物胺降解菌的筛选与降解特性研究
吴燕燕1,钱茜茜1,2,陈玉峰1,2,杨贤庆1,邓建朝1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300;2.上海海洋大学食品学院,上海 201306)
为获得用于咸鱼等腌制水产品的生物胺降解菌,本文采用生物胺初筛培养基与高效液相色谱技术分析,研究从传统方法加工的咸鱼中分离筛选具有降解生物胺的菌株,通过VITEK 2鉴定系统进行菌种鉴定,并分析菌株的生长曲线、降解生物胺动力学、温度、pH、盐度、生物胺底物浓度等特性,及在咸鱼中接种菌株对产品生物胺的影响。结果表明:从咸鱼中分离筛选到三株具有降解生物胺的菌株,分别是鼠李糖乳酸菌(Lactobacillusrhamnosus,Lr)、植物乳杆菌(Lactobacillusplantarum,Lp)、戊糖片球菌(Pediococcuspentosaceus,Pp);对生物胺降解的最适温度为30~35 ℃,最适pH为5.5~6.0,对食盐有较好的耐受性,在食盐浓度≤80 g/L时对生物胺的降解作用尤为明显,Lr与Lp之间无拮抗作用;接种了生物胺降解菌的咸鱼产品中腐胺、尸胺、组胺、酪胺等生物胺含量均显著性降低(p<0.05),而接种Lr∶Lp=1∶2的混合菌种的咸鱼产品生物胺含量下降幅度最大。
咸鱼,生物胺降解菌,分离,降解特性
腌制咸鱼是一种风味独特的传统水产品,深受广大消费者的喜爱。其传统生产工艺属自然发酵,发酵过程微生物种类复杂,产品的品质和安全性难以得到保证[1]。生物胺普遍存在于蛋白质含量丰富的发酵食品中,如发酵香肠、干酪、咸鱼、鱼露等[2]。当其在人体内积累到较高数量时就会出现一些诸如头痛、恶心、痉挛等一系列中毒性状,严重的甚至会危及生命[3]。生物胺含量是微生物分泌的氨基酸脱羧酶和生物胺氧化酶共同作用的结果,即脱羧酶催化氨基酸脱羧基,产生并积累生物胺,生物胺氧化酶则氧化并降解生物胺[4]。
长期以来,研究人员一直在尝试开发能有效控制生物胺的方法,大部分都是通过抑制食品中生物胺产生菌的数量或氨基酸脱羧酶的活性来减少生物胺的产生,如辐照[5]、低温贮藏[6]、真空包装[7]等,这些方法在一定程度上可以减少生物胺的产生,但不能消除已产生的生物胺。近年来,具有胺氧化酶的微生物成为研究热点,通过接种无氨基酸脱羧酶或含生物胺氧化酶的微生物制剂,使其在发酵过程中成为优势菌,从而降解生物胺或抑制生物胺的生成[8-9]。目前国内外对乳酸菌降解生物胺开展了相关研究。马宇霞等[10]从熏马肠中分离鉴定了6株生物胺氧化酶菌株,其中包括鼠李糖乳酸菌、戊糖片球菌和植物乳杆菌三株乳酸菌;Tosukhowong等[11]研究了植物乳杆菌BCC 9546作为一种降解菌对发酵香肠中生物胺的降解作用;Nie等[12]报道了银鱼香肠接种植物乳杆菌后会对其生物胺产生影响。
目前有关乳酸菌的降解特性还未见文献报道,因此,本实验室从传统腌干鱼制品中分离筛选具有生物胺降解活性的微生物,为腌干鱼加工过程中发酵剂的选择提供菌种来源,提高其可食用安全性,并探讨温度、pH、食盐浓度和生物胺底物浓度对生物胺降解的影响,为生物胺的控制研究提供理论依据,并为腌干鱼的工艺革新提供参考。
1 材料与方法
1.1材料与仪器
咸鱼传统法腌制[13],实验室自制;生物胺标准品:腐胺(PUT)(≥98%)、尸胺(CAD)(≥95%)、组胺(HIS)(≥99%)、酪胺(TYR)(≥99%)均购自美国Sigma公司;乙腈(色谱纯)、丹磺酰氯(Dns-Cl,≥99%)、甲醇(色谱纯)均购自上海安谱科学仪器有限公司;丙酮(色谱纯)购自美国Burdick&Jackson公司;MRS培养基、MRS肉汤培养基均购自广东环凯微生物科技有限公司;其它化学试剂均为分析纯,购于广州粤升试剂公司;实验用水均为超纯水。
Agilent 1100 高效液相色谱仪美国Agilent公司;立式蒸汽压力灭菌锅388型上海申安医疗器械厂;3K30冷冻离心机美国Sigma公司;SW-CJ-1FD超净工作台江苏苏净安泰公司;SPX-320生化培养箱宁波东南仪器厂;TU-1990 紫外-可见分光光度计北京普析通用仪器有限责任公司;T25高速均质机德国IKA公司;热泵除湿干燥箱上海一恒科技有限公司;VITEK 2 Compact菌种鉴定系统法国生物梅里埃公司。
1.2实验方法
1.2.1降解生物胺菌的筛选及鉴定在无菌条件下取咸鱼背部肌肉10 g,剪碎后放入装有90 mL无菌生理盐水的三角瓶中,混合均匀,用无菌生理盐水依次稀释为102、103、104倍,取1 mL上述不同浓度的稀释液涂布于MRS培养基中,然后置于30 ℃的恒温培养箱中培养48 h,挑单菌落以平板划线的方法多次纯化。将纯化后的单菌落分别接入到改良型MRS肉汤培养基中,以不接种菌的培养基作对照,30 ℃培养48 h后取样,测定培养基中的生物胺含量。将具有生物胺降解活性的乳酸菌接种于3 mL无菌盐水(4.5 g/L NaCl,pH4.5~7.0)中,混匀,用比浊仪配制相当于0.80~0.10麦氏单位的菌悬液,使用VITEK 2全自动微生物分析系统进行菌种鉴定[14]。
1.2.2生物胺降解菌的生长曲线测定将乳酸菌活化后,以2%的接种量接入MRS肉汤培养基中,于30 ℃条件下培养,在48 h内每隔6 h取一定量的菌液,稀释到适宜倍数,测定OD600值。
1.2.3菌株对混合生物胺的降解动力学研究将菌活化后,以2%的接种量分别接种于50 mL,pH为5.5的含四种生物胺(腐胺、尸胺、组胺和酪胺,浓度分别为100 mg/L)的MRS肉汤培养基中,分别置于30 ℃条件下恒温培养48 h,以未接种的培养基作空白对照,在48 h内每隔6 h取样检测实验组和对照组培养基中生物胺含量,根据公式1计算各生物胺的降解率,绘制菌株对混合生物胺的降解动力学曲线。
式(1)
式中:W0-对照组中生物胺的含量,mg/L;W1-实验组中生物胺的含量,mg/L。
1.2.4不同培养条件对菌株降解生物胺的影响
1.2.4.1温度对菌株降解生物胺的影响将菌活化后,以2%的接种量接入(pH5.5、食盐浓度和生物胺底物浓度均为0、含四种生物胺)MRS肉汤培养基中,分别置于温度(20、25、30、35、40、45 ℃)条件下培养24h。
1.2.4.2初始pH对菌株降解生物胺的影响将菌活化后,以2%的接种量接入(初始pH(4.5、5.0、5.5、6.0、6.5、7.0)、食盐浓度和生物胺底物浓度均为0、含四种生物胺)MRS肉汤培养基中,置于30 ℃条件下培养24h。
1.2.4.3食盐浓度对菌株降解生物胺的影响将菌活化后,以2%的接种量接入(食盐浓度(0、40、80、120、160g/L)、pH5.5、生物胺底物浓度为0含四种生物胺)MRS肉汤培养基中,置于30 ℃条件下培养24h。
1.2.4.4生物胺底物浓度对菌株降解生物胺的影响将菌活化后,以2%的接种量接入(生物胺底物浓度(25、50、100、200、300mg/L)、pH5.5、食盐浓度为0、含四种生物胺)MRS肉汤培养基中,置于30 ℃条件下培养24h。
分别取样,检测培养基中生物胺含量,以未接种的培养基作空白对照。

表1 生物胺降解菌鉴定结果
1.2.5菌株间的拮抗性实验用接种环挑取活化后的乳酸菌,在一定条件下培养至同一稀释(108CFU/mL)的不同菌悬液,在MRS平板上作相互垂直划线接种,于30 ℃恒温培养箱中培养48 h后,观察。如两垂直线交界处无菌生长,则说明这两菌株之间有拮抗性,即为阳性,否则为阴性。
1.2.6降解生物胺菌在咸鱼加工中的应用及效果测定在传统法咸鱼的加工工艺[13]基础上,加入具有生物胺降解能力的乳酸菌,制作5种不同类型的咸鱼:CK组为空白组;A组添加鼠李糖乳酸菌(Lr);B组添加植物乳杆菌(Lp);C组添加鼠李糖乳酸菌和植物乳杆菌混合菌液(Lr∶Lp=1∶2);D组添加鼠李糖乳酸菌和植物乳杆菌混合菌液(Lr∶Lp=2∶1)。发酵剂接种量为108CFU/mL。分别检测制作的5种咸鱼的8种生物胺含量。
1.2.7生物胺含量测定参照参考文献[15-16]中的Dns-Cl-柱前衍生HPLC-FLD法测定生物胺含量。
1.2.8数据处理采用Excel进行数据统计及作图,所有样品均作三次平行;另外显著性分析采用JMP软件中的Tukey法进行两两比较,以p<0.05 说明变化显著。
2 结果与分析
2.1降解生物胺菌株的筛选
通过对传统加工咸鱼中菌株的分离纯化,获得58株乳酸菌疑似菌株,对其进行单一菌种发酵后,Dns-Cl-柱前衍生HPLC-FLD法测定生物胺降解量。结果分离到3株具有生物胺降解能力的菌株,分别编号为MRS1、MRS2、MRS3。菌株鉴定结果见表1。其中MRS1经鉴定是鼠李糖乳杆菌(Lr),对腐胺的降解率为30.88%、对组胺的降解率为38.56%、对酪胺的降解率为32.63%;而MRS2为植物乳杆菌(Lp),其对腐胺的降解率为31.29%、对组胺的降解率为26.93%、对尸胺的降解率为35.56%;MRS3为戊糖片球菌(Pp),其对腐胺的降解率最大,达到35.23%、对酪胺的降解率为26.19%,对组胺为20.56%;说明乳酸菌中确实存在能降解生物胺的菌株,这与Almudena García-Ruiz[17]的研究结果相一致,但分离到的菌株其降解腐胺、组胺和酪胺的能力均比Almudena García-Ruiz[17]的从酒中分离到的乳酸菌株高。
2.2菌株生长曲线测定
由图1可知,在前18 h,Lp的生长速度略高于Lr和Pp,并且Lr和Pp的生长曲线保持高度一致,在18 h后才出现差异。18 h后Lr的生长速度要明显高于Lp和Pp,其生长曲线随着时间的增加与其他2个菌株的差异逐渐增大。生长曲线的测定有利于观察菌株在生长过程中菌体密度的变化,进而掌握菌体的活力变化,以确定菌体的最佳收获时间。菌体活力强,单位体积菌数多的培养时间为收获的最佳时间,也就是对数生长末期稳定生长前期。由图1可以看出,3个菌株的菌体密度随着培养时间的延长逐渐增大,在培养6 h左右,到达对数生长期,培养24 h后对数生长期结束达到稳定生长期,可见,此时是菌体收获的最佳时期。当菌株培养到30 h后,开始出现下降趋势,这是由于培养基中营养物质消耗殆尽或者菌株自身产生某些代谢毒素[18]。

图1 菌株的生长曲线Fig.1 Growth curve of three kinds of bacteria
2.3菌株对混合生物胺的降解动力学分析
从图2可以看出,分离到的三种菌均能够同时降解腐胺、尸胺、组胺和酪胺,在24 h内,菌对肉汤培养基中生物胺的降解率逐渐升高,并在24 h达到最大降解量,此后基本持平或略有下降。其中,菌株Lr对组胺和尸胺有较强的降解能力,最高分别可达37.87%和37.11%;菌株Lp对腐胺和尸胺有较强的降解能力,最高分别可达32.39%和36.39%;菌株Pp也表现出较强的腐胺和尸胺降解能力,最高分达36.92%和27.89%。由此可知,Lr、Lp和Pp在发酵食品中具有一定的应用潜力。由图1和图2可得出结论:24 h为菌体最佳收获时期同时也是菌体降解生物胺的最佳时期,如果发酵时间延长,菌体或多或少会产生一些有毒的代谢产物,这将影响鱼肉的品质安全性,所以合适的菌株发酵时间非常重要。
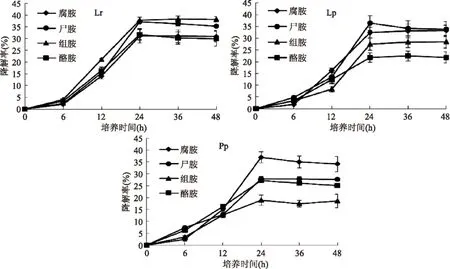
图2 三种菌对混合生物胺的降解动力学Fig.2 Degradation kinetics of mixed biogenic amines by three kinds of bacteria
2.4不同培养条件对生物胺降解菌的影响
2.4.1不同温度对生物胺降解菌的影响由图3可以看出,在不同的温度处理下,三株菌对生物胺都有不同程度降解,在30 ℃和35 ℃条件下对生物胺的降解率显著高于20、25、40、45 ℃时的降解率,这可能是由于3种菌都属于乳酸菌类,其最适生长温度为30~35 ℃[19]。Lr降解腐胺、尸胺、组胺的最适温度为30 ℃,最大降解率分别为40.68%、35.66%和42.36%,而对酪胺的最适降解温度为35 ℃,最大降解率为34.28%。Lp降解腐胺、尸胺、组胺和酪胺的最适温度均为30 ℃,最大降解率分别为43.69%、35.39%、36.28%和29.98%。Pp降解腐胺、尸胺、组胺和酪胺的最适温度也为30 ℃,最大降解率分别为38.09%、26.35%、21.01%和28.93%。故三株乳酸菌更适合在30~35 ℃的范围内降解生物胺。
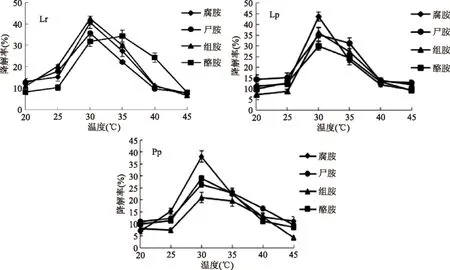
图3 温度对生物胺降解菌的影响Fig.3 The effect of temperature on biogenic amines degrading bacteria
2.4.2不同初始pH对生物胺降解菌的影响从图4可以看出,三种菌对生物胺的降解能力受培养基pH的影响很大,降解的最适pH是5.5,活性范围为5.0~6.5。如果pH不在这个范围内,降解能力均受到不同程度的抑制。Lr在pH=5.5时对腐胺、尸胺、组胺和酪胺的最大降解率分别为29.38%、38.96%、38.94%和31.63%;Lp降解腐胺、尸胺和酪胺的最适pH为5.5,其最大降解率分别达到39.74%、41.23%和26.89%,但是Lp降解组胺的最适pH是6.0,最大降解率为29.47%,这可能是由于分离到的Lp对组胺的降解以酶降解为主,酸降解发挥着次要作用。前期报道提出Natrinema gar HDS3-1也适宜在偏中性的环境中降解组胺[20]。Pp在pH=5.5时对腐胺、尸胺、组胺和酪胺的最大降解率分别为28.92%、27.92%、20.73%和26.18%。

图4 初始pH对生物胺降解菌的影响Fig.4 The effect of pH in initial period on biogenic amines degrading bacteria

图5 食盐浓度对生物胺降解菌的影响Fig.5 The effect of salt on biogenic amines degrading bacteria
2.4.3不同食盐浓度对生物胺降解菌的影响由图5可知,三株乳酸菌在食盐浓度为80 g/L的培养基中仍然保持着一定的生物胺降解能力,说明从传统加工咸鱼中分离出的三株菌具备一定的耐盐性,可应用于发酵食品加工中。当食盐浓度为0~40 g/L时,Lr、Lp和Pp对四种生物胺均表现出较高的降解率,而当食盐浓度达到一定程度(80 g/L以上),对该菌降解生物胺有明显的抑制作用。当食盐浓度达到160 g/L时,三种菌基本丧失了对四种生物胺的降解能力。这是由于高食盐浓度抑制了菌的生长从而影响菌对生物胺的降解,也可能影响了乳酸菌生物胺氧化酶的生成量或抑制了生物胺氧化酶的活性,而使降解能力下降。欧昌荣等[21]分析组胺降解酶的基本酶学性质,也得出不同温度、pH和食盐浓度会对酶活性造成很大影响。以上结果表明三种菌在食盐浓度低于40 g/L的体系中生物胺降解性能最佳,在食盐浓度40~80 g/L的体系中能发挥一定程度的生物胺降解性能,不适用于食盐浓度大于80 g/L的环境中。
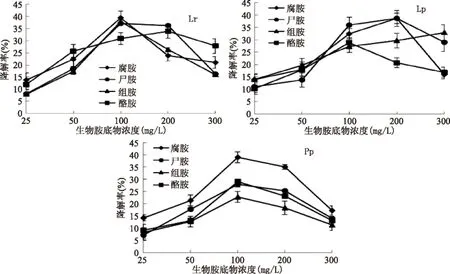
图6 生物胺底物浓度对生物胺降解菌的影响Fig.6 The effect of biogenic amines concentrations on biogenic amines degrading bacteria
2.4.4不同生物胺底物浓度对生物胺降解菌的影响由图6可知,三株菌随着生物胺底物浓度的增大,其对生物胺的降解率也明显增加,其中,Lr在底物浓度100 mg/L时对腐胺、尸胺和组胺有最大降解率,分别为39.38%、37.11%和37.87%,在底物浓度200 mg/L时对酪胺有最大降解率,为33.82%;Lp在底物浓度200 mg/L时对腐胺、尸胺和组胺有最大降解率,分别为38.73%、38.66%和29.73%,对酪胺的最大降解率出现在底物浓度100 mg/L时,最大降解率为28.83%;Pp在底物浓度100 mg/L时对腐胺、尸胺和组胺和酪胺均有最大降解率,分别为38.92%、27.95%、22.83%和29.18%。但是当底物浓度高于峰值时,三株菌对生物胺的降解率明显下降,可能由于菌株受生物胺的毒害作用,影响了菌株的生长,从而降低了降解能力。
2.5菌株间拮抗性实验
从表2可以看出,Lr和Pp、Lp和Pp之间存在拮抗作用,而Lr与Lp之间无拮抗作用,故本实验选择Lr和Lp的组合进行咸鱼生物胺降解初步应用。

表2 菌株间拮抗实验结果
注:Y表示有拮抗作用,N表示没有拮抗作用。
2.6生物胺降解菌对咸鱼中生物胺的降解效果
生物胺降解菌对咸鱼中生物胺降解效果如表3所示。

表3 生物胺降解菌对咸鱼中生物胺的降解效果
注:同一列相同字母表示差异不显著(p>0.05)。
C组和D组为混合菌组,从表3实验结果看,C组加工的咸鱼产品中腐胺、尸胺、组胺和酪胺含量降幅最明显,分别下降了7.27、6.2、15.78、2.23 mg/kg,降解率均达30%以上。因此,Lr∶Lp=1∶2的混合菌种具有应用于降解发酵食品中生物胺的潜力,为提高其对生物胺降解率,其混合比例和菌液浓度还需后续具体的工艺优化研究。
3 结论
3.1从传统方法加工的咸鱼中筛选出3株具有生物胺降解能力的菌株,经鉴定分别为鼠李糖乳酸菌(Lr)、植物乳杆菌(Lp)、戊糖片球菌(Pp),在作用24 h对生物胺的降解率均在20%以上。
3.2三株菌对生物胺降解的最适温度为30~35 ℃,最适pH为5.5~6.0,对食盐有较好的耐受性,在食盐浓度≤80 g/L时对生物胺的降解作用尤为明显;菌株Lr和Pp、Lp和Pp之间存在拮抗作用,而Lr与Lp之间无拮抗作用,所以Lp和Lr可以用作混合菌发酵实验。
3.3将分离得到的三株菌,在咸鱼加工过程接种至鱼体中,通过比较表明接种了生物胺降解菌的咸鱼产品中生物胺含量均显著低于对照组,接种Lr∶Lp=1∶2的混合菌种的咸鱼产品生物胺含量下降幅度最大,降解率均达到30%以上。该研究为下一步优化生物胺降解菌在咸鱼加工过程中的使用条件奠定基础,也为其在腌制水产品加工中应用提供理论依据。
[1]舒畅,吴春生,钟慈平,等. 发酵食品微生物多样性研究方法进展[J]. 食品科学,2013,34(15):397-402.
[2]吴燕燕,陈玉峰. 腌制水产品中生物胺的形成及控制技术研究进展[J]. 食品工业科技,2014(14):396-400.
[3]张月美,包玉龙,罗永康,等. 草鱼冷藏过程鱼肉品质与生物胺的变化及热处理对生物胺的影响[J]. 南方水产科学,2013,9(4):56-61.
[4]Martuscelli M,Gardini F,Torriani S,et al. Production of biogenic amines during the ripening of Pecorino Abruzzese cheese[J]. International Dairy Journal,2005,15(6):571-578.
[5]Rabie M A,Toliba A O. Effect of irradiation and storage on biogenic amine contents in ripened Egyptian smoked cooked sausage[J]. Journal of Food Science and Technology,2013,50(6):1165-1171.
[6]Komprda T,Smělá D,Pechová P,et al. Effect of starter culture,spice mix and storage time and temperature on biogenic amine content of dry fermented sausages[J]. Meat Science,2004,67(4):607-616.
[7]蔡秋杏,李来好,陈胜军,等. 液熏罗非鱼片在25 ℃贮藏过程中生物胺的变化[J]. 南方水产,2010(5):1-6.
[8]Latorre-Moratalla M L,Veciana-Nogués T,Bover-Cid S,et al. Biogenic amines in traditional fermented sausages produced in selected European countries[J]. Food Chemistry,2007,107(2):912-921.
[9]Zeng X,Xia W,Yang F,et al. Changes of biogenic amines in Chinese low‐salt fermented fish pieces(Suan yu)inoculated with mixed starter cultures[J]. Int J Food Sci Technol,2013,48(4):685-692.
[10]马宇霞,卢士玲,李开雄,等. 熏马肠中生物胺氧化酶菌株的筛选与鉴定[J]. 现代食品科技,2014(5):49-55.
[11]Tosukhowong A,Visessanguan W,Pumpuang L,et al. Biogenic amine formation in Nham,a Thai fermented sausage,and the reduction by commercial starter culture,Lactobacillus plantarum BCC 9546[J]. Food Chemistry,2011,129(3):846-853.
[12]Nie X,Zhang Q,Lin S. Biogenic amine accumulation in silver carp sausage inoculated with Lactobacillus plantarum plus Saccharomyces cerevisiae[J]. Food Chemistry,2014,153(9):432-436.
[13]任中阳,吴燕燕,李来好,等. 腌干鱼制品热泵干燥工艺参数优化[J]. 南方水产科学,2015,11(1):81-88.
[14]王瑞旋,耿玉静,冯娟,等. 杂色鲍哈维弧菌耐药质粒的鉴定和分析[J]. 南方水产科学,2012,8(2):1-6.
[15]陈玉峰,吴燕燕,李来好,等. 腌干鱼制品中8种生物胺测定方法的优化[J]. 中国渔业质量与标准,2014,4(4):41-48.
[16]杨贤庆,翟红蕾,郝淑贤,等. 高效液相色谱法测定生物胺衍生条件的优化研究[J]. 南方水产科学,2012,8(1):49-53.
[17]Almudena G,M G E,Begoa B,et al. Potential of wine-associated lactic acid bacteria to degrade biogenic amines.[J]. International Journal of Food Microbiology,2011,148(2):115-120.
[18]魏建铭. 微生物的生长曲线及其应用[J]. 上海调味品,1982(1):12-13.
[19]刘安军,何立蓉,郑捷,等. 发酵带鱼乳酸菌种的筛选及其工艺优化[J]. 现代食品科技,2010,26(9):948-951.
[20]Tapingkae W,Tanasupawat S,Parkin K L,et al. Degradation of histamine by extremely halophilic archaea isolated from high salt-fermented fishery products[J]. Enzyme and Microbial Technology,2009,46(2):92-99.
[21]欧昌荣,汤海青,张宇琼,等. 鲭鱼中组胺降解酶产生菌的分离筛选和基本酶学性质研究[J]. 宁波大学学报:理工版,2012,25(3):1-6.
[23]S C,R S,S F,et al. Identification of a novel enzymatic activity from lactic acid bacteria able to degrade biogenic amines in wine[J]. Applied Microbiology and Biotechnology,2013,98(1):185-198.
Screening and degradation properties of biogenic amines degrading strains in salted fish
WU Yan-yan1,QIAN Xi-xi1,2,CHEN Yu-feng1,2,YANG Xian-qing1,DENG Jian-chao1
(1.Key Lab of Aquatic Product Processing,Ministry of Agriculture;National Research and Development Center for Aquatic Product Processing;South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300,China;2.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
In order to obtain biogenic amines degrading strains which can be applied to salted aquatic products,strains were isolated from traditional salted fish by microbiological methods and high performance liquid chromatography(HPLC),identified by VITEK 2 strain identification system,and its degradation properties(growing curve,degradation kinetics of mixed biogenic amines,temperature,pH,salt concentration,the effects of adding strains to salted fish on biogenic amine production)were analyzed. The results showed three strains were obtained from traditional salted fish,which were identified asLactobacillusrhamnosus(Lr),Lactobacillusplantarum(Lp),Pediococcuspentosaceus(Pp). The optimal conditions for three strains degrading the biogenic amines were 30~35 ℃,pH5.5~6.0. Three trains had a good tolerate to salt concentration,and a significantly degradation for biogenic amines under 80 g/L salt concentration. There were no antagonism between Lr and Lp. Biogenic amines degrading strains fermentation could notably decrease the content of putrescine,cadaverine,histamine and tyramine(p<0.05),and the salted fish with Lr∶Lp=1∶2 fermentation had the lowest biogenic amines content.
salted fish;biogenic amines degrading strain;isolation;degradation properties
2016-03-11
吴燕燕(1969-),女,研究员,主要从事水产品加工与质量安全方面的研究,E-mail:wuyygd@163.com。
国家自然科学基金项目(31371800);广东省海洋渔业科技推广专项(A201301C01,A201501C02)。
TS254.1
A
1002-0306(2016)18-0173-07
10.13386/j.issn1002-0306.2016.18.025

