田口方法优化菌株产菊粉酶的培养条件
陈 晨,杨 革,李莉莉,秦 松
(1.曲阜师范大学生命科学学院,山东曲阜 273165;2.中国科学院烟台海岸带研究所,山东烟台 264003)
田口方法优化菌株产菊粉酶的培养条件
陈晨1,杨革1,李莉莉2,*,秦松2,*
(1.曲阜师范大学生命科学学院,山东曲阜 273165;2.中国科学院烟台海岸带研究所,山东烟台 264003)
鉴定一株从菊芋根际土壤中分离出的产外切型菊粉酶活力较高的菌株C-56。通过16S rDNA序列分析构建系统发育树,初步确定菌株的分类地位,利用单因素实验和田口方法优化培养基配方。实验发现菌株C-56属于伯克霍尔德氏菌属(Burkholderia),单因素实验确定菌株产酶的最佳碳源、氮源、无机盐分别为菊粉、酵母膏、MgSO4·7H2O。应用田口方法优化菌株的培养基,统计学分析发现菊粉对菌株产酶的影响最大,最佳培养基配方为菊粉50 g/L,酵母浸粉20 g/L,MgSO4·7H2O 6 g/L,pH6.0。在最佳条件下获得的菊粉酶活力为(29.34±1.95) U/mL,比初始菊粉酶酶活力(6.25±0.84) U/mL提高了3.69倍。
伯克霍尔德氏菌属,菊粉酶,菊粉,优化,田口方法
菊粉又称菊糖,是一种高分子碳水化合物,主要存在于菊芋、菊苣和大丽花等多种植物的根和块茎中[1]。其分子呈直链结构,由D-呋喃果糖残基通过β-1,2糖苷键脱水缩合而成,末端连接一个葡萄糖残基,聚合度为2~60[2]。菊粉作为一种相对廉价且丰富的生产果糖和低聚果糖的原材料,被广泛应用于食品、药品和保健品等领域[3]。
菊粉酶能够水解菊粉,根据其作用方式分为两种类型:外切型菊粉酶,主要产物为果糖;内切型菊粉酶,主要产物为低聚果糖[4]。果糖甜度比蔗糖高,水溶性好,粘度较低,这些特点使果糖作为一种甜味剂被广泛应用于食品加工工业。近年来果糖的重要性不断增加,与其他的糖类相比,食用果糖不容易引起龋齿。果糖所含热量较低,并且果糖在人体中的新陈代谢不依赖胰岛素,因此成为肥胖症和糖尿病患者的一种理想食物[5]。低聚果糖是一种优良的益生元,能选择性地刺激肠道中乳酸杆菌和双歧杆菌的生长[6]。由于微生物易于培养,繁殖快,周期短,酶产量高,因此工业上多用微生物来进行菊粉酶的生产。目前已发现的能合成菊粉酶的微生物有很多种,包括霉菌、细菌、酵母等均能生产菊粉酶[7]。但是目前已有的能够分泌菊粉酶菌株的活性均较低,无法实现进一步产业化应用的需要。
田口方法(Taguchi method)是由田口玄一博士创立的一种优化方法。通过适当的设计使实验结果对外界条件变化不敏感,将优化的过程提前到实验设计阶段[8]。传统的优化方法,每次实验只能研究一个因素的影响,实验次数多,耗费时间长,只能确定因素自身的显著性,而无法确定单个因素相对于其他所有因素对实验结果影响程度的相对大小[9]。与传统方法相比,田口方法体现出明显的优势。田口方法可同时研究多个因素,以及各因素之间的相互影响,使实验次数大大减少,节省了时间和材料,并且能够通过方差贡献率来确定各因素对实验结果影响的相对程度,用最少的实验次数找出影响最大的因素[10]。本实验针对目前面临的菊粉酶高活力生产菌株缺乏的问题,鉴定了一株菊粉酶生产菌株并且用田口方法对该菌株的产酶条件进行了优化。
1 材料与方法
1.1材料与仪器
菌种c-56是从山东烟台种植菊芋多年的根际土壤中分离筛选获得;菊粉青海威德特种糖业有限公司;3,5-二硝基水杨酸国药集团化学试剂有限公司;实验所用试剂均为分析纯;初筛培养基菊粉10 g/L,蛋白胨5 g/L,(NH4)2SO45 g/L,MgSO4·7H2O 2 g/L,琼脂20 g/L,pH5.0;斜面培养基葡萄糖20 g/L,酵母浸粉5 g/L,蛋白胨5 g/L,琼脂20 g/L,pH5.0;种子培养基葡萄糖20 g/L,酵母浸粉5 g/L,MgSO4·7H2O 2 g/L,pH5.0;发酵培养基菊粉20 g/L,酵母浸粉10 g/L,MgSO4·7H2O 2 g/L,pH5.0。
SW-CJ-2FD洁净工作台苏州净化设备有限公司;DHP-9082型电热恒温培养箱上海一恒科技有限公司;DHA-DA.大容量全温振荡器江苏太仓市实验设备厂;TU-1901双光束紫外可见分光光度计北京普析通用仪器有限责任公司。
1.2实验方法
1.2.1菌株的分子生物学鉴定提取菌株的基因组DNA,通过对16S rRNA基因PCR扩增和测序,然后进行序列比对和分析,利用MAGA5.1软件构建系统发育树,初步确定菌株的分类地位。
1.2.2菊粉酶活力测定采用3.5-二硝基水杨酸法:取1 mL酶液加入4 mL 2%的菊粉溶液(pH5.0、0.l mol/L醋酸缓冲液配制),55 ℃水浴条件下反应10 min;取反应液1 mL加入1 mL DNS混匀,100 ℃沸水浴5 min终止反应,迅速冷却并稀释至25 mL(在相同的条件下,用100 ℃灭活的粗酶液作为对照)。在波长540 nm处测定其吸光值,根据葡萄糖标准曲线计算样品中还原糖的含量[11]。
菊粉酶活力单位定义:在pH5.0,55 ℃条件下反应10 min,每分钟转化生成1 μmol还原糖所需的酶量为一个酶活力单位(U)。
1.2.3单因素实验
1.2.3.1碳源对菌株产酶的影响在其他培养基成分(碳源除外)相同的情况下,选取6种不同的碳源:菊粉、葡萄糖、果糖、蔗糖、玉米淀粉、麦芽糖进行产酶实验,每种碳源的量均为20 g/L,测定菌株的产酶活力。
1.2.3.2氮源对菌株产酶的影响在其他培养基成分(氮源除外)相同的情况下,以菊粉为碳源,选取6种不同的氮源:蛋白胨、牛肉膏、酵母浸粉、(NH4)2SO4、NH4H2PO4、NH4Cl进行产酶实验,每种氮源的量为5 g/L,测定菌株的产酶活力。
1.2.3.3无机盐对菌株产酶的影响在其他培养基成分(无机盐除外)相同的情况下,以菊粉为碳源,酵母浸粉为氮源,其他条件不变的情况下,选取7种不同的无机盐:NaCl、KCl、CaCl2、MgSO4·7H2O、CuSO4·5H2O、FeSO4·7H2O、ZnSO4·7H2O进行产酶实验,每种无机盐的量均为2 g/L,测定菌株的产酶活力。
1.2.4田口方法优化实验设计应用田口方法研究培养基中各组分之间的关系,并优化培养基各组分的质量浓度以及初始pH,提高菌株C-56产生的菊粉酶活力。本实验选取了四个因子进行优化,每个因子取三个水平值(表1)。利用Qualitek-4软件设计正交表,共进行九组实验,实验设计如表2所示。

表1 实验设计的4个因子及3个水平
发酵产酶过程在250 mL三角瓶中进行,每瓶装液量为50 mL,接种量10%。在温度30 ℃,转速200 r/min条件下,摇床培养48 h后测定菊粉酶活力。实验经过三次生物学重复。
1.2.5验证实验在优化后的最佳条件下,进行产酶实验,30 ℃,200 r/min,摇床培养48 h,测定菊粉酶活力值,将实验测得的实际值与预测值进行对比,评价优化方案。
1.3数据处理
利用Qualitek-4软件进行田口实验设计,并进行数据处理和分析。
2 结果与讨论
2.1菌株的分子生物学鉴定
通过16S rRNA基因进行序列分析和比对,BLAST分析发现菌株C-56与栖土伯克霍尔德氏菌(BurkholderiaterricolaR 8118)最为相似,相似度为99%。利用MAGA5.1软件,使用邻接法构建菌株C-56的系统发育树(图1)。分支上标注的数值为1000次bootstrap后的置信度。从系统发育树上可以发现菌株C-56与栖土伯克霍尔德氏菌(Burkholderiaterricola)聚为一枝,并且处在伯克霍尔德氏菌属(Burkholderia)进化枝中。初步确定菌株C-56属于伯克霍尔德氏菌属。
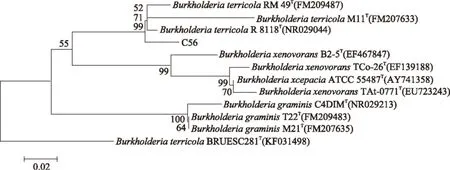
图1 菌株C-56系统发育树Fig.1 Neighbour-joining phylogenetic tree of strain C-56
2.2碳源对菌株产酶的影响
碳源对微生物产酶具有非常重要的影响,其是构成酶蛋白碳骨架以及合成能量的主要来源,并且还能诱导或阻遏酶的产生[12]。实验结果如图2所示。

图2 不同碳源对菌株产酶活力的影响Fig.2 Effect of different carbon sources on inulinase activity
从图2中可以看出,当以菊粉作为碳源时,菌株的产酶活力明显高于其他碳源。以果糖作为碳源时菌株的产酶活力最低,可能由于外切型菊粉酶的酶解产物多为果糖,而酶的合成是一个动态平衡的过程,当培养基中以果糖作为碳源时,会抑制酶的合成。而菊粉的存在却可诱导酶的合成,因此选用菊粉作为菌株产酶的最佳碳源。
2.3氮源对菌株产酶的影响
氮元素是构成细胞中核酸和蛋白质的重要元素,氮源是微生物生长必不可少的营养物质。氮源对菌株产酶影响的实验结果如图3所示。

图3 不同氮源对菌株产酶活力的影响Fig.3 Effect of different nitrogen sources on inulinase activity
从图3中可以看出,当以酵母浸粉作为氮源时,菌株产生的菊粉酶活力最高,酵母浸粉属于有机氮源,且酵母浸粉本身就是促进微生物生长繁殖的优质营养因子。因此选用酵母浸粉作为最佳氮源。
2.4无机盐对菌株产酶的影响
无机盐也是微生物生长不可缺少的物质,不同金属离子对微生物产酶有不同的影响,实验结果如图4所示。
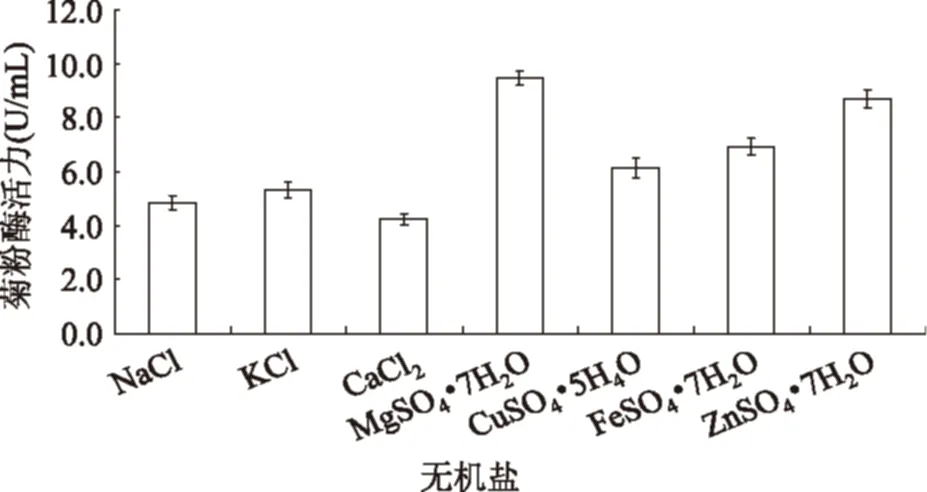
图4 不同无机盐对菌株产酶活力的影响Fig.4 Effect of different inorganic salt on inulinase activity
从图4中可以看出,当培养基中添加MgSO4·7H2O时,菌株产生的菊粉酶活力最高,其次为ZnSO4·7H2O,而添加CaCl2时产酶活力最低。因此选用MgSO4·7H2O作为菌株产酶的最佳无机盐。
2.5田口方法优化培养基
通过前期实验,选定A菊粉,B酵母浸粉,C MgSO4·7H2O,D初始pH作为进一步优化的因子,并确定因子的三个水平,如表1所示。按照Qualitek-4软件设计的方案进行实验,并将实验结果的响应值记录于表2中。

表2 田口方法实验结果

表3 方差分析表
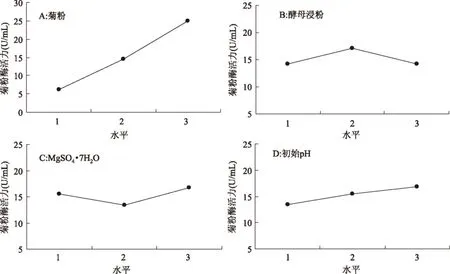
图5 四个因素的主效应图Fig.5 Main effect plots of four factors
利用Qualitek-4软件分析实验结果,对数据进行统计学分析,结果发现,四个因子的p值均小于0.001,即均为极显著性因素(表3),而通过方差贡献率的计算发现,菊粉的方差贡献率高达91.16%,与之相比,其他三个因子的方差贡献率较小,酵母浸粉只占2.87%,这就表明,在四个因素中菊粉对菌株产酶的影响程度最大,酵母浸粉的影响程度最小,这意味着菊粉是菌株产菊粉酶最显著最重要的影响因素。这与Pilanee Vaithanomsat等[13]的研究结果一致。
四个因子相关的均值主效应图如图5所示,主效应图显示了因子取不同的水平值对实验结果的影响。在每个因子的三个水平中只有一个水平能使实验的响应值达到最大。本实验中使响应值最大的因子水平分别为菊粉:3水平,酵母浸粉:2水平,MgSO4·7H2O:3水平,初始pH:3水平,即最优组合为A3B2C3D3。
因此,由田口方法确定的生产菊粉酶的最佳条件为菊粉50 g/L,酵母浸粉20 g/L,MgSO4·7H2O 6 g/L,pH6.0。进一步预测在最佳条件(A3B2C3D3)下进行菊粉酶的生产即可获得最大菊粉酶活力,即菊粉酶活力的预测值(Yexpected),可根据以下公式计算:
式(1)
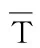
Yexpected=24.895+17.118+16.713+16.824-3×15.212=29.91
田口方法获得的最大菊粉酶活力的预测值为29.91 U/mL。
2.6验证实验
按照田口方法优化后获得的最佳条件,对菊粉酶的酶活力进行了3次验证实验,获得菊粉酶的活力值为(29.34±1.95) U/mL,这与预测值(29.91 U/mL)非常接近,且菊粉酶活力相对稳定,比初始菊粉酶酶活力(6.25±0.84 U/mL)提高了约3.69倍,说明由田口方法获得的优化方案达到了预期的效果。曹洪泽等[14]利用响应面法将一株黑曲霉的菊粉酶活力由3.27 U/mL提高到了7.26 U/mL,酶活力提高了1.22倍。李洁等[15]通过正交实验,在发酵96 h后将一株雅致放射毛霉的菊粉酶活力提高到了27.36 U/mL,酶活力提高了0.23倍。苟亚峰等[16]利用响应面法将一株霉菌的菊粉酶活力由15.88 U/mL提高到了24.62 U/mL,酶活力提高了1.55倍。
3 结论
通过16S rRNA基因进行序列分析和比对,确定所筛菌株C-56属于伯克霍尔德氏菌属。通过单因素实验确定,菌株C-56生产菊粉酶的最佳碳源、氮源、无机盐分别为菊粉,酵母浸粉,MgSO4·7H2O。
利用Qualitek-4软件分析发现,被优化的四个因子中,菊粉对菌株产酶的影响最大,是菌株C-56生产菊粉酶的过程中最显著最重要的影响因素,其方差贡献率高达91.16%,而酵母浸粉只占2.87%,田口方法优化后的最佳培养基配方为菊粉50 g/L,酵母浸粉20 g/L,MgSO4·7H2O 6 g/L,pH6.0。在此条件下获得的菊粉酶活力为(29.34±1.95) U/mL,比初始菊粉酶活力提高了3.69倍。应用田口方法获得的优化方案达到了预期效果,具有较好的稳定性,并且优化后菊粉酶活力提高的倍数高于传统优化方法。
[1]Chen H,Chen X,Chen T,et al. Extraction optimization of inulinase obtained by solid state fermentation of Aspergillus ficuum JNSP5-06[J]. Carbohydrate Polymers,2011,85(2):446-451.
[2]Vandamme E J,Derycke D G. Microbial inulinases:fermentation process,properties,and applications[J]. Advances in Applied Microbiology,1983,29(4):139-176.
[3]张扬,朱启忠,张瑞. 产菊粉酶细菌菌株的筛选及菌种鉴定[J]. 资源开发与市场,2014(4):392-393.
[4]徐艳新,张伟国,葛向阳. 黑曲霉产菊粉酶菌株的选育及培养基优化[J]. 生物加工过程,2014(2):17-23.
[5]Abd E A A,Wehaidy H R,Mostafa F A. Optimization of inulinase production from low cost substrates using Plackett-Burman and Taguchi methods[J]. Carbohydrate Polymers,2014,
102:261-268.
[6]Azadeh A,Sheikhalishahi M. An efficient Taguchi approach for the performance optimization of health,safety,environment and ergonomics in generation companies[J]. Safety and Health at Work,2015,6(2):77-84.
[7]Yen H Y,Li J Y. Process optimization for Ni(II)removal from wastewater by calcined oyster shell powders using Taguchi method[J]. Journal of Environmental Management,2015,161:344-349.
[8]Gibson G R,Probert H M,Loo J V,et al. Dietary modulation of the human colonic microbiota:updating the concept of prebiotics[J]. Nutrition Research Reviews,2004,17(2):259-275.
[9]Sheng J,Chi Z,Li J,et al. Inulinase production by the marine yeast Cryptococcus aureus G7a and inulin hydrolysis by the crude inulinase[J]. Process Biochemistry,2007,42(5):805-811.
[10]李昭阳,韩之俊. 试论田口参数设计与实验设计的区别[J]. 中国质量,2000(1):37-38.
[11]王琳,刘兆普,赵耕毛,等. 产菊粉酶菌株的筛选及其产酶条件的优化[J]. 南京农业大学学报,2007(2):73-77.
[12]赵洁,朱启忠,耿松,等. 产菊粉酶菌株的筛选及发酵条件研究[J]. 中国酿造,2012(9):107-110.
[13]Vaithanomsat P,Songpim M,Sirisansaneeyakul S. A statistical approach for culture condition improvement of invertase and inulinase from Candida guilliermondii TISTR 5844[J]. Kasetsart J,2011,45(6):1083-1093.
[14]曹泽虹,秦卫东,李超,等. 响应面法优化内切型菊粉酶发酵生产培养基[J]. 食品科学,2013(13):186-192.
[15]李洁,韩睿. 雅致放射毛霉YYS-15菌株产菊粉酶发酵条件的研究[J]. 中国酿造,2013(5):51-54.
[16]苟亚峰,王丹,孙丹,等. 一株产内切菊粉酶菌株培养条件的响应面优化[J]. 食品工业科技,2013(19):135-140.
Optimization of medium components for inulinase production of a strain using Taguchi method
CHEN Chen1,YANG Ge1,LI Li-li2,*,QIN Song2,*
(1.College of Life Science,Qufu Normal University,Qufu 273165,China;2.Yantai Institute of Coastal Zone Research,Chinese Academy of Sciences,Yantai 264003,China)
A strain with high inulinase productivity named C-56 which was isolated from Jerusalem artichoke rhizosphere soil was identified. Analysis of 16S rRNA gene sequence indicated that strain C-56 was belonged to genusBurkholderia. The optimal carbon sources,nitrogen sources,and inorganic salt were identified as inulin,yeast extract,MgSO4·7H2O through single factor test,respectively. The optimization of inulinase production from strain C-56 was studied by Taguchi method. Statistical analysis of the experimental data indicated that inulin was the most significant factor for inulinase production. The optimal medium compositions for maximizing the inulinase production were established as 50 g/L inulin,20 g/L yeast extract,6 g/L MgSO4·7H2O,initial pH6.0. Under optimum conditions,(29.34±1.95) U/mL of inulinase activity were obtained,which increased about 3.69 times compared with the initial enzyme activity(6.25±0.84) U/mL.
Burkholderiasp.;inulinase;inulin;optimization;Taguchi method
2016-02-17
陈晨(1988-),女,硕士研究生,研究方向:菊芋的综合利用,E-mail:cfy1022@126.com。
李莉莉(1982-),女,助理研究员,研究方向:菊芋的综合利用,E-mail:llli@yic.ac.cn。
秦松(1968-),男,研究员,研究方向:海岸带植物,E-mail:sqin@yic.ac.cn。
国家自然科学基金(21306221);“十二五”国家科技支撑计划(2013BAB01B00)。
TS201.3
A
1002-0306(2016)18-0192-05
10.13386/j.issn1002-0306.2016.18.028

