黑曲霉几丁质合成酶基因chs形态突变株的构建
孙小雯,郑之明,骆家玉,赵根海,刘 会,*
(1.安徽大学物理与材料科学学院,安徽合肥 230601;2.中国科学院离子束生物工程重点实验室,安徽合肥230031;3.安徽省国营沙河集林业总场白米山林场,安徽滁州239060)
黑曲霉几丁质合成酶基因chs形态突变株的构建
孙小雯1,郑之明2,骆家玉3,赵根海2,刘会2,*
(1.安徽大学物理与材料科学学院,安徽合肥 230601;2.中国科学院离子束生物工程重点实验室,安徽合肥230031;3.安徽省国营沙河集林业总场白米山林场,安徽滁州239060)
以一株产柠檬酸的黑曲霉菌株为研究材料,为了优化菌株的深层发酵形态,提高柠檬酸产量,采用RNA干扰的方法,使与形态建成相关的几丁质合成酶chs基因沉默。首先将酶切得到的chs基因片段与质粒pJL43-RNAi连接,构建成干扰载体。为提高干扰载体的转化率,对原生质体制备、再生和转化条件进行了优化。然后通过聚乙二醇(PEG)介导,将构建的干扰载体导入黑曲霉的原生质体中,经过转化,筛选出形态突变株,并进行深层发酵。结果表明,在36.5 ℃培养16 h的幼嫩菌丝最利于原生质体释放;而5 mg/mL的溶菌酶,10 mg/mL的蜗牛酶和10 mg/mL的纤维素酶组成的混合酶系为最优的酶组合;在30 ℃下,以100 r/min酶解3 h可使原生质体的最大产量达到5.11×106/mL。最优的再生培养基为完全培养基,可以使再生率达到35.33%。获得的3株转化株的chs基因表达量降低,同时在深层发酵过程中,菌球的分支频率降低,分支缩短,离散菌丝减少,柠檬酸产量也分别提高12.33%,24.17%和19.61%。通过分子改造的形态突变株具有良好的产酸性能,对推动柠檬酸发酵工业的进步有重要意义。
黑曲霉,原生质体,RNA干扰,几丁质合成酶,形态突变株
柠檬酸是种被广泛的应用于食品、医药、化妆品和化工行业中的重要有机酸。黑曲霉是柠檬酸发酵工业的主要菌种,作为一种常见的丝状真菌,在深层发酵过程中,菌丝体的形态和柠檬酸的合成代谢密切相关,因此通过形态基因的分子改造实现菌种发酵性能的优化,具有十分重要的研究和经济价值。
构建高效的遗传转化体系是菌种进行基因改造的关键,目前常用的丝状真菌的转化方法包括孢子电转化法、农杆菌介导转化法、原生质体介导的转化法等[1]。其中原生质体具有操作简单和材料易获得等特点,在转化体系的建立中有明显的优势[2]。丝状真菌细胞壁的结构和化学组成复杂,具有良好的完整性和机械强度,因此制备原生质体最大的挑战就是在保持质膜完整性和细胞活性的前提下高效地移除细胞壁[3-4]。Mania和Sukumar等的研究发现影响原生质体形成的因素有很多,其中主要包括菌龄、裂解酶、酶解时间、酶解温度、渗透压稳定剂等[5-6]。
丝状真菌的形态基因可调控菌丝体的形态建成,而发酵形态对产物的合成有重要的影响。丝状真菌的细胞壁主要是由几丁质、甘露聚糖和葡聚糖等多糖类物质交联而成[7],其中的关键酶几丁质合成酶可催化N-乙酰葡萄糖胺残基通过β-1,4-糖苷键连接成几丁质,以维持细胞壁的完整性和菌丝正常有序地极化生长。近年来,有大量关于丝状真菌几丁质合成酶基因在形态建成过程中的作用的相关研究。例如,Fujiwara等研究发现在构巢曲霉中chsA和chsC基因对细胞壁的完整性和分生孢子的正常发育有重要作用[8]。而在米曲霉中,chsB和chsC基因也对分生孢子和菌丝的发育有重要影响[9]。Liu等研究也发现调控chs4基因的表达可以优化产黄青霉的深层发酵形态,进而提高青霉素的产量[10]。但目前尚未有关于黑曲霉的几丁质合成酶基因对菌丝体形态以及柠檬酸合成影响的相关报道。
本实验通过正交实验法对黑曲霉原生质体制备和再生的条件进行优化,获得大量高质量的原生质体。然后采用RNAi技术,沉默黑曲霉chs基因的表达,将构建的干扰载体通过PEG的介导,成功地导入原生质体中,筛选出柠檬酸高产的转化株,并对转化株的深层发酵过程进行进一步地探究。同时初步建立一套高效的黑曲霉原生质体遗传转化体系,为黑曲霉工业菌株选育工作奠定了基础。
1 材料与方法
1.1材料与仪器
柠檬酸工业生产菌株黑曲霉(AspergillusnigerCBS 513.88)由日照金禾生化集团股份有限公司提供;大肠杆菌(Escherchiacoli)DH5α购自生工生物工程(上海)股份有限公司;质粒载体pJL43-RNAi由INBIOTEC的Juan F Martín教授馈赠;博来霉素、溶菌酶(22800 U/mg)、蜗牛酶、T4 DNA 连接酶(5 U/μL)、Ezup柱式真菌基因组DNA抽提试剂盒、Sanprep柱式质粒DNA小量抽提试剂盒、Sanprep柱式DNA胶回收试剂盒、Sanprep柱式PCR产物纯化试剂盒均购自生工生物工程(上海)股份有限公司;纤维素酶(10000 U/g)上海阿拉丁生化科技股份有限公司;NcoI(10 U/μL)、Dream Taq DNA 聚合酶(5 U/μL)、O’GeneRuler 1kb DNA Ladder、O’GeneRuler 100 bp DNALadder Fermentas公司;其他试剂均购自国药集团化学试剂有限公司。
TH4-200显微镜Olympus;2-16K冷冻高速离心机北京博励行仪器有限公司;DK-80电热恒温三孔水槽摇床上海双捷实验设备有限公司;HZ-2211K立式双层振荡培养箱华利达实验设备有限公司;Applied Biosystems 2720 Thermal Cycler上海宾智生物科技有限公司;HWS型恒温恒湿箱宁波东南仪器有限公司;DYY-6C型电泳仪北京市六一仪器厂;培清JS-2012自动对焦凝胶成像分析仪上海培清科技有限公司。
1.2实验方法
1.2.1培养基的配制PDA产孢培养基:按文献进行配制[11]。
发酵培养基:200 g玉米粉溶解于1000 mL蒸馏水,121 ℃灭菌20 min,温度降至60 ℃左右加入α-1,4-葡萄糖水解酶。
完全培养基:0.5% 胰蛋白胨,0.5% 酵母提取物,1% 葡萄糖,0.06% 硝酸钠,1.5% 磷酸氢二钾,0.52% 氯化钾,0.52% 七水硫酸镁,0.2% 微量元素溶液。
微量元素溶液(g/L)[12-13]:七水硫酸锌5 g,六水合硫酸铁铵1 μg,五水硫酸铜0.25 μg,四水合氯化锰0.06 μg,硼酸0.05 μg,二水合钼酸钠0.05 g。
再生培养基:完全培养基加入1 mol/L的蔗糖,上层培养基加1%的琼脂,下层培养基加2%的琼脂。
博来霉素(Zeocin,100 mg/mL):取1 mL无菌水溶解100 mg Zeocin粉末,过滤除菌(滤膜孔径0.22 μm),制成母液,-20 ℃保存。
1.2.2原生质体制备黑曲霉菌株在PDA斜面上,36.5 ℃培养7 d,收集孢子。刮取斜面上的孢子溶解于含有玻璃珠的无菌水中,100 r/min振荡2 h,使孢子被充分打散,用三层无菌纱布过滤,制备成孢子悬液,对孢子浓度进行计数,以5×104/mL的孢子浓度接种到含有50 mL发酵培养基的250 mL三角瓶中,在摇床上以36.5 ℃,270 r/min培养一定时间,获得菌丝体。
将菌液用无菌滤纸过滤吸干,取200 mg菌丝体溶解于10 mL酶解液中。酶解液按一定浓度和组合(表1)溶解于KMP溶液(0.02 mol/L 磷酸盐缓冲液,0.7 mol/L氯化钾和0.8 mol/L甘露醇,pH6.3)。菌丝体酶解一定时间后,放入4 ℃冰箱15 min,终止酶解反应。然后在得到的最佳酶组合的基础上,进一步研究菌龄和酶解条件等因素对原生质体形成过程的影响,正交实验设计见表2。

表1 酶组合的正交实验的因素水平表(mg/mL)

表2 菌龄和酶解条件的正交实验的因素水平表
1.2.3原生质体纯化酶解结束后,用四层无菌擦镜纸过滤,收集滤液,6000 r/min 离心5 min,弃上清液,用KMP溶液洗涤沉淀3次。将原生质体沉淀重悬于2 mL原生质体保存液(0.6 mol/L蔗糖,10 mmol/L氯化钙,10 mmol/L Tris-HCl,pH7.5),用血球计数板计数。
1.2.4原生质体再生向培养皿底部倒入10 mL原生质体下层再生培养基,待其凝固,再将原生质体与冷却至40 ℃左右的原生质体上层再生培养基轻轻混匀后,倒入上述平板中,置于36.5 ℃培养3 d,对平板上的再生菌落进行计数。原生质体再生率的计算公式如下:
原生质体再生率(%)=再生培养基上生长的菌落数/涂布原生质体数量×100
1.2.5原生质体转化将纯化后的原生质体以1×106/mL的浓度重悬于KMPC溶液(使用前向KMP溶液中加入氯化钙溶液至终浓度为50 mmol/L)。取100 μL原生质体悬液,和5 μg载体混匀,再加入50 μL过滤除菌的PPC转化溶液(40% PEG-MW3500,20 mmol/L磷酸盐缓冲液(pH6.3),使用前加50 mmol/L氯化钙),冰浴30 min。加入1 mL PPC转化溶液,轻轻吸打混匀后加入冷却至40 ℃ 左右,含有30 μg/mL博来霉素霉素的上层再生培养基中,轻轻混匀,倒入已凝固的底层再生培养基平板上,36.5 ℃培养7 d。
1.2.6干扰载体的构建用Ezup真菌基因组DNA提取试剂盒提取黑曲霉霉全基因组,并以之为模板,以chsF(5′-CATGCCATGGCGACAAACCGCATAC TGAAC-3′)和chsR(5′-CATGCCATGGACAAGGGC AAGCCTCTAATC-3′)为引物进行目的基因chs的PCR扩增。将干扰载体pJL43-RNAi转化到大肠杆菌后进行质粒提取后,用NcoI对质粒和扩增的chs基因进行酶切,再用T4 DNA连接酶将回收纯化的酶切载体与目的基因酶切片段连接,即为构建的干扰载体。
1.2.7转化株的mRNA表达水平检测提取转化株的总RNA,用M-MuLV第一链cDNA合成试剂盒将其反转录成cDNA,再以cDNA为模板,分别用设计的内参基因actin和chs基因两对引物序列进行PCR反应,actinF(5′-CATGCCATGGGGTCTGGAGAGCG GTGGTAT-3′)和actinR(5′-CATGCCATGGGAAGAA GGAGCAAGAGCAGT G-3′),扩增出目的基因片段。对PCR产物进行琼脂糖凝胶电泳,并用Image J软件处理电泳图,根据电泳条带亮度分析mRNA的相对表达量。
1.2.8转化株的深层发酵菌丝体形态观察和柠檬酸产量测定向装有50 mL发酵培养基的250 mL三角瓶按1×106/mL的接种量接种孢子悬液,在37 ℃下,250 r/min培养3 d,发酵结束后取100 μL发酵液用显微镜镜检观察菌丝体形态,并用斐林试剂法检测发酵液的总酸含量。
1.3数据处理
采用Primer premier 5.0软件设计目的基因的扩增引物,采用正交设计助手II V3.1和ImageJ软件对实验数据进行处理,采用Origin8.0软件作图。
2 结果与分析
2.1不同酶组合对原生质体形成的影响
丝状真菌细胞壁成分较为复杂,主要是由葡聚糖、甘露聚糖和几丁质等物质组成,而单一的裂解酶不能酶解细胞壁的所有组分,进而影响原生质体的形成和再生过程。许多研究表明裂解酶的种类和浓度是影响原生质体产量和质量的重要因素,而使用混合酶解液的效果优于单独使用一种酶[14-16]。蜗牛酶中由于含有几丁质酶,对裂解细胞壁有重要作用,而添加溶菌酶和纤维素酶可促进细胞壁的酶解,提高原生质体产量。最优的酶解体系需要高效地裂解细胞壁,同时不能对细胞膜造成损伤。为研究最适合黑曲霉原生质体形成的酶解体系,将溶菌酶、蜗牛酶、纤维素酶按一定的浓度组合成混合酶系,对菌丝体进行酶解,由表3可知,RA>RC>RB,即溶菌酶对酶解体系的影响最显著,纤维素酶次之,而蜗牛酶的影响最小;kA1>kA2表明A1是因素A是最优水平,同理可以得出B2和C2分别是因素B和C的最优水平;综上所述,5 mg/mL的溶菌酶,10 mg/mL的蜗牛酶和10 mg/mL的纤维素酶组成的混合酶系为最优的酶组合,原生质体产量达到3.7×106/mL。本研究成功建立溶菌酶、蜗牛酶和纤维素酶的混合酶解体系,并优化出合适的浓度用于黑曲霉原生质体的制备。

表3 酶组合的正交实验设计和结果
2.2不同菌龄和酶解条件对原生质体形成的影响
在优化出的最优酶组合的基础上,对菌龄和酶解条件对原生质体形成过程的影响进行了进一步研究。由表4可知,RC>RA>RB>RD,即这四个因素对原生质体形成影响的重要性依次是:酶解时间>菌龄>酶解温度>酶解转速。制备原生质体的最优的条件是A2B2C2D2,即酶解时间3 h,菌龄16 h,酶解温度30 ℃,酶解转速100 r/min,以此条件制备的原生质体产量可达到5.11×106/mL。

表4 菌龄和酶解条件的正交实验设计和结果
研究表明酶解时间是影响原生质体制备和再生的最关键的因素,酶解时间不足2 h不能完全破坏细胞壁,释放出原生质体,而适当的延长酶解时间可以有效地提高原生质体产量,但并不是酶解时间越长越好,酶解到4 h虽然原生质体产量有所提高,但此时去壁原生质体的细胞膜稳定性差,酶解液会对细胞膜造成不可修复的损伤,使原生质体的再生率显著降低,直接影响后续转化实验的效率。表4的结果表明酶解时间3 h最利于原生质体的制备和再生,并且酶解结束后最好立刻将酶解液放置低温环境终止反应,并及时过滤洗脱剩余的酶液,防止反应过度。
菌龄对黑曲霉原生质体的形成也起到重要的作用,随着菌龄变化,菌丝体的细胞壁组分也有所差异,因此对裂解酶的敏感性也有所不同。一般幼嫩的菌丝比成熟的菌丝和菌球更易被裂解酶酶解,由于菌球比菌丝的结合更紧密,与酶解液的接触面积也就相对减小,因此不利于原生质体释放。Mania等的研究表明培养10 h的构巢曲霉最适合制备原生质体[5],而产黄青霉培养24 h的效果最优[6]。本研究发现黑曲霉菌株培养16 h的菌丝体最适宜原生质体的释放。
酶解温度和酶解转速也是影响原生质体得率的因素,但是实验结果表明影响效果不显著,综合考虑几种酶的最适温度,较温和的反应温度利于酶解,低温和高温都会对酶活有不良的影响,最适宜的酶解温度是30 ℃。将酶解的样品放置在摇床上是为了使菌丝和酶解液充分接触混合,100 r/min是最适宜的转速,酶解转速过低,造成体系中只有部分菌丝可以一直与酶液接触,混合效果不理想,同时转速也不能过高,因为随着酶解反应的进行,细胞壁逐渐移除,暴露在酶解液中的细胞膜较脆弱,容易破裂,温和的混合体系最易于原生质体的释放和再生。
2.3不同种类再生培养基对原生质体再生的影响
原生质体的再生过程不仅受酶解时间的影响,同时也受再生培养基种类的影响。再生培养基在细胞壁再生过程中的作用除了是为细胞壁建成提供生长底物以外,固体琼脂还可避免可溶性的细胞壁物质从原生质体的表面扩散而被保留下来,作为有用的机体酶或自身组织而聚集成完整的细胞壁[17]。表5的结果表明,完全培养基是其中最优的再生培养基,再生率可达到35.33%,而相同条件下的PDA作为再生培养基,再生率仅16.37%,玉米液化液的再生培养基再生率也仅17.85%。完全培养基的组分相对于PDA和玉米液化液更为丰富,碳氮源比例以及微量元素的添加都更利于细胞壁重建,使其再生效果明显优于后两种再生培养基,再生率有显著提高。

表5 再生培养基对再生率的影响
此外,在原生质体再生过程中,单层平板的直接涂布法会使再生率降低,这是由于玻璃棒会对部分原生质体造成机械损伤,与之相比,双层平板法将原生质体悬液与上层再生培养基先混合再倒平板的方法,有效地避免了机械损伤,对提高再生率起重要作用[18]。
2.4原生质体形成过程的形态观察
菌丝体的细胞壁在酶解过程中菌丝的顶端等部位的细胞膜出现外凸现象,并逐渐膨大变形形成小球,之后内容物脱离菌丝成为原生质体(图1a)。经过过滤可以将大量菌丝片段滤去,主要仅剩透明小球状的破壁原生质体和少量酶解的菌丝碎片。酶解2 h后(图1c)可见大量原生质体形成,但酶解4 h时(图1e)发现虽然形成的原生质体数量大,但其中包含大量形状不规则的皱缩的原生质体,可能此时的原生质体不仅细胞壁被酶解,细胞膜也被酶解液造成不可逆的损伤,这也是该时期的原生质体再生率低的主要原因。

图1 原生质体形成过程Fig.1 Process of protoplast release 注:a.菌龄和酶解条件优化前,最优酶组合条件下的原生质体形态;b. 酶解1 h;c. 酶解2 h;c. 酶解3 h;d. 酶解4 h;e. 酶解5 h。

图2 质粒载体酶切电泳图Fig.2 Electropherogram of plasmid vector after NcoI digestion 注:M为O’GeneRulerT M 1kb DNA Ladder,1为酶切的pJL43-RNAi质粒载体。
2.5干扰载体的构建
pJL43-RNAi载体上含有一个博来霉素抗性基因(ble)和一个dsRNA表达盒,将载体转化大肠杆菌后进行质粒提取,载体中只有一个NcoI酶切位点,对其进行NcoI单酶切后变为线性,只有一条大小约为6 kb的条带(图2)。
以黑曲霉全基因组为模板,设计一对两端加上NcoI酶切位点的引物,PCR扩增出325 bp大小的chs目的基因片段,酶切后进行胶回收(图3),再将其与酶切质粒连接构建成待转化的干扰载体。

图3 目的基因酶切电泳图 Fig.3 Electropherogram of chs fragment after NcoI digestion 注:M为O’ GeneRulerT M 100 bp DNA Ladder,1为酶切的chs基因片段。
2.6转化株的chs基因沉默程度
RNAi是通过导入外源双链RNA而降解同源mRNA的过程,因此mRNA的表达水平可以反映基因的沉默程度,从图4可以看出挑选的3株形态突变株的chs基因的mRNA的表达水平比原始菌有不同程度的下降,说明对chs的基因的干扰是有效果的。

图4 反转录PCR检测各菌株chs基因表达水平Fig. 4 RT-PCR analysis of chs mRNA expression in the mutant strains
2.7chs基因对菌丝体的深层发酵形态的影响
丝状真菌在深层发酵过程中,随组织器官和培养条件的变化会出现不同的形态,而菌丝体的形态对目标产物的产率有显著的影响。其微观形态的发展决定了菌丝体最终的宏观形态,而菌丝体的形态发生过程是受形态基因调控的。几丁质作为细胞壁的主要成分,其合成过程复杂,而其中的关键酶是几丁质合成酶,它的作用是催化 N-乙酰葡萄糖胺残基通过β-1,4-糖苷键连接成几丁质,维持细胞壁的完整性和菌丝正常有序地极化生长。
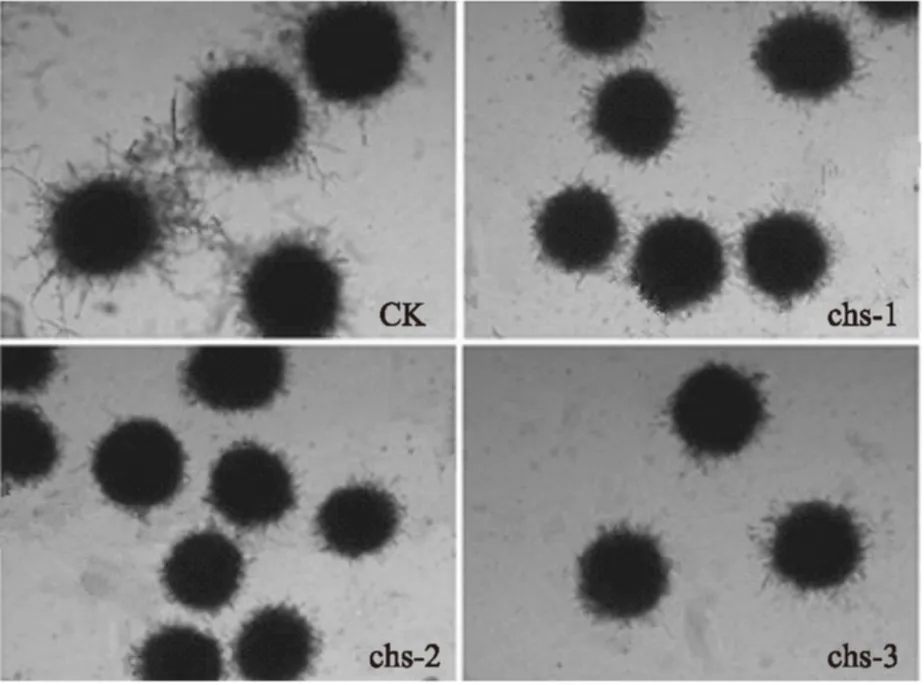
图5 显微镜观察各菌株的菌丝体形态(100×)Fig.5 Mycelium morphology of strains observed by microscope(100×)
本研究采用RNAi技术,使几丁质合成酶基因chs表达沉默,从图5可以看出该培养条件下,菌株均形成直径约80~100 μm的菌球,而chs基因沉默的转化株的菌球比原始菌株的分支频率小,并且没有离散菌丝,菌球的边缘较光滑。由此推断出chs基因在黑曲霉的形态建成过程中,尤其对菌丝的生长有重要作用。
2.8形态突变株的菌丝体形态和柠檬酸产量的相关性
柠檬酸深层发酵过程的菌丝体形态与柠檬酸产量密切相关,一般致密的菌球形态利于柠檬酸的积累[19-21],反之,离散菌丝和松散的菌球会降低产酸量,图6的结果也进一步验证其中的相关性,3株chs基因表达沉默的形态突变株的柠檬酸产量较原始菌株分别提高了12.33%、24.17%、19.61%,离散菌丝,菌球的粗糙度和菌丝的分支频率降低,都会降低发酵液的粘度,进而提高发酵液的传质和传氧效率,最终实现柠檬酸产量的显著提高,由此可以推断出chs基因沉默对柠檬酸的积累有很好的促进作用。

图6 chs基因对柠檬酸产量的影响Fi g.6 Effect of chs gene on citric acid yield
3 结论
建立了黑曲霉原生质体制备、再生和转化体系,优化的结果是:36.5 ℃培养16 h的幼嫩菌丝溶解于5 mg/mL的溶菌酶,10 mg/mL的蜗牛酶和10 mg/mL的纤维素酶组成的混合酶系中,在30 ℃下,以100 r/min酶解3 h可使原生质体的最大产量达到5.11×106/mL,以完全培养基作为再生培养基,可以使再生率达到35.33%,当原生质体数量达到1×106/mL时,利用PEG介导转化,可成功获得转化菌株。同时采用RNAi技术,构建chs基因的干扰载体,并进行转化,抗性筛选出3株柠檬酸产量提高的形态突变株,发现菌丝体的离散菌丝减少,菌球的粗糙度和菌丝的分支频率降低。揭示了黑曲霉深层发酵生产柠檬酸的过程中的菌丝体形态与柠檬酸产量之间的相关性,为柠檬酸工业生产中黑曲霉菌株的分子改造和代谢调控奠定了基础。
[1]张晓立,郑小梅,满云,等. 黑曲霉柠檬酸工业菌株原生质体制备与转化[J].生物技术通报,2015,31(3):171-177.
[2]Meyer V. Genetic engineering of filamentous fungi-Progress,obstacles and future trends[J]. Biotechnol Adv,2008,26(2):177-185.
[3]Chadegani M,Brink JJ,Shehata A,et al. Optimization of protoplast formation,regeneration,and viability inMicrosporumgypseum[J]. Mycopathologia,1989,107(1):33-50.
[4]Liu H,Wan g P,Hu YH,et al. Construction of an RNAi expression vector and transformation intoPenicilliumchrysogenum[J]. Ann Microbiol,2014,64(1):113-120.
[5]Mania D,Hilpert K,Ruden S,et al. Screening for antifungal peptides and their modes of action in Aspergillus nidulans[J]. Appl Environ Microbiol,2010,76(21):7102-7108.
[6]Sukumar M,Sundar M,Sivarajan M. Penicillin production from transformed protoplast of Penicillium chrysogenum by fermentation[J]. J Pharmacogenom Pharmacoproteomics,2010,1:102.
[7]Adams DJ. Fungal cell wall chitinases and glucanases[J]. Microbiology,2004,150:2029-2035.
[8]Fujiwara M,Ichinomiya M,Motoyama T,et al. Evidence that the Aspergillus nidulans class I and class II chitin synthase genes,chsC and chsA,share critical roles in hyphal wall integrity and conidiophore development[J]. J Biochem,2000,127:359-366.
[9]Müller C,McIntyre M,Hansen K,et al. Metabolic engineering of the morphology of Aspergillus oryzae by altering chitin synthesis[J]. Appl Environ Microbiol,2002,68:1827-1836.
[10]Liu H,Zheng Z,Wang P,et al. Morphological changes induced by class III chitin synthase gene silencing could enhance penicillin production of Penicillium chrysogenum[J]. Appl Microbiol Biotechnol,2013,97:3363-3372.
[11]杨勇,张凤英,陈岑. PDA培养基改良配方的研究[J]. 酿酒科技,2012,4:29-31.
[12]Crawford L,Stepan AM,McAda PC,et al. Production of Cephalosporin inter mediates by feeding adipic acid to recombinant Penicillium chrysogenum strains expressing ring expansion activity[J]. Biotechnology,1995,13:58-62.
[13]Vinayagam Ramesh VRM. Sequential Statistical Optimization of Media Components for the Production of Glucoamylase by Thermophilic Fungus Humicola grisea MTCC 352[J]. Korean Journal of Crop Science,2014,2014(2):317940-317940.
[14]Hamlyn PF,Bradshaw RE,Mellon F M,et al. Efficient protoplast isolation from fungi using commercial enzymes[J]. Enzyme Microb Technol,1981,3(4):321-325.
[15]Zhou X,Wei Y,Zhu H,et al. Protoplast formation,regeneration and transformation from the taxol-producing fungusOzoniumsp[J]. Afr J Biotechnol,2008,7(12):2017-2024.
[16]Ruiz-Díez B. Strategies for the transformation of filamentous fungi[J]. J Appl Microbiol,2001,92:189-195.
[17]周东坡,平文祥. 微生物原生质体融合[M]. 哈尔滨:黑龙江科学技术出版社,1990:278.
[18]刘国栋,秦玉琪. 黑曲酶N593原生质体形成、再生和转化的研究[J]. 中国科技论文在线,2012.
[19]Gómez R,Schnabe I,Garrido J. Pellet growth and citric acid yield of Aspergillus niger 110[J]. Enzyme Microb Technol,1988,10:188-191.
[20]Paul GC,Priede MA,Thomas CR. Relationship between morphology and citric acid production in submerged Aspergillus niger fermentations[J]. Biochem Eng J,1999,3:121-129.
[21]Papagianni M. Fungal morphology and metabolite production in submerged mycelial processes[J]. Biotechnol Adv,2004,22:189-259.
Optimization of protoplast formation,regenerationin and transformation inAspergillusniger
SUN Xiao-wen1,ZHENG Zhi-ming2,LUO Jia-yu3,ZHAO Gen-hai2,LIU Hui2,*
(1.School of Physics and Materials Science,Anhui University,Hefei 230601,China;2.Key Laboratory of Ion Beam Bioengineering,Chinese Academy of Sciences,Hefei 230031,China;3.White Rice Mountain Forest Farm State,Owned Shaheji Forestry General Station Anhui Province,Chuzhou 239060,China)
For improving the mycelial morphology and citric acid production ofA.niger,we construct a gene silencing vector by RNA interference technology to silence the chitin synthase gene. The fragments ofchsgene were amplified by PCR,which was ligated to plasmid pJL43-RNAi to generate the RNAi vector. In order to increase the transformation frequency,the effects of some factors on protoplast formation and regeneration from citric acid-producing fungusA.nigerwere investigated. The silencing vectors were introduced into purificatory protoplasts by a polyethylene glycol(PEG)-mediated transformation method. The results showed that the mycelia incubated for 16 h at 36.5 ℃ were most suitable for protoplast release,which digested by enzyme combination of 5 mg/mL lysozyme,10 mg/mL snailase and 10 mg/mL cellulase for 3 h as 100 r/min at 30 ℃,and a high yield of protoplasts(5.11×106/mL)were obtained. In addition,the maximum regeneration rate was 35.33%,while the complete medium as the regeneration media. After conversion,three morphological mutant strains are smoother and have less dispersed mycelia,which were distinct from the original strain in morphology. The transformantschs-1,chs-2 andchs-3 where citric acid production rise by 12.33%,24.17% and 19.61%,respectively. The morphological mutants of chs exhibited the excellent production potential during submerged culture,which had important significance for the development of the citric acid fermentation industry.
Aspergillusniger;protoplasts;RNAi;chitin synthase;morphological mutant
2016-03-04
孙小雯(1991-),女,硕士研究生,研究方向:丝状真菌的形态代谢工程,E-mail:sxw05580590@163.com。
刘会(1986-),女,助理研究员,研究方向:微生物发酵,诱变育种,E-mail:lhazrael@126.com。
国家高技术研究发展计划(2014AA021704)。
TS201.3
A
1002-0306(2016)18-0218-06
10.13386/j.issn1002-0306.2016.18.033

