光照强度和氮源匮乏培养对小球藻细胞生长和细胞组成的影响
阳需求,陈剑锋,郑向南,谢友坪
(福州大学生物科学与工程学院,福建福州 350108)
光照强度和氮源匮乏培养对小球藻细胞生长和细胞组成的影响
阳需求,陈剑锋,郑向南,谢友坪*
(福州大学生物科学与工程学院,福建福州 350108)
本研究考察了不同光照强度和氮源匮乏培养对小球藻细胞生长及其细胞组成的影响。结果表明,随光照强度的增强,小球藻生物量产率和碳水化合物含量可显著提高,而蛋白质含量和油脂含量则呈现缓慢下降趋势;在光照强度为750 μmol·m-2·s-1时,小球藻生物量产率、蛋白质产率和碳水化合物产率达最大值,分别为935.6、509.8、256.0 mg·L-1·d-1;而光照强度为450 μmol·m-2·s-1时,小球藻油脂产率达最大值,为105.0 mg·L-1·d-1。通过氮源匮乏培养来促进小球藻碳水化合物和油脂含量的积累,发现当氮源匮乏培养时间分别为2 d和4 d时,小球藻碳水化合物产率和油脂产率可进一步提高至471.1 mg·L-1·d-1和150.6 mg·L-1·d-1。
小球藻,光照强度,氮源匮乏,细胞组成
微藻具有培养简单、生长周期短等优势,因此,近年来使用微藻来生产高附加值产品和能源产品逐渐成为研究热点[1-2]。相关研究发现,在营养充足的光自养条件下,大多数藻种的藻细胞组成成分大都主要为蛋白质(30%~50%)、碳水化合物(20%~40%)和油脂(8%~15%)[3]。其中,较高的蛋白质含量使得藻体可用作健康食品和动物饲料添加剂[4]。另外,由于微藻碳水化合物主要为淀粉和纤维素,且不含木质素,因此很容易被水解为葡萄糖,进而被用作微生物酒精发酵的碳源来源[5]。而微藻油脂的脂肪酸组成主要为十六碳脂肪酸和十八碳脂肪酸,十分适宜用作生物柴油的合成[6]。由此可见,微藻的应用范围十分广泛,具有相当大的潜在应用价值。
微藻光合碳的流向会随环境以及培养条件的变化而改变,因此其细胞的生化组成,特别如蛋白质、油脂和碳水化合物等往往会有所不同[3,7]。对于光自养培养微藻来说,光照强度不仅影响藻体细胞生长,而且对其细胞组成成分也有着显著影响[7-10]。此外,相关研究发现微藻细胞需在氮源充足条件下才会积累蛋白质含量[11],而碳水化合物或油脂含量则需在氮源匮乏条件下才会快速积累[7,9,12-14]。截至目前,已有较多文献集中于微藻细胞单一成分(如蛋白质、油脂或碳水化合物等)的生产研究,如考察光照强度、氮源种类及浓度和培养策略等的影响[8,11,15-18]。但对于微藻的规模化应用,不应只限于单一细胞成分的开发利用。为减少微藻细胞的开发利用成本,应考虑对其进行多组分综合利用[19]。本实验以小球藻(ChlorellasorokinianaFACHB-275)为研究对象,考察光照强度和氮源匮乏培养对其细胞生长和细胞组成的影响,旨在为微藻有效成分的开发利用提供重要参考依据。
1 材料与方法
1.1材料和仪器
小球藻(ChlorellasorokinianaFACHB-275)购自中国科学院水生生物研究所;硝酸钠、七水硫酸镁、磷酸氢二钾、磷酸二氢钾、二水氯化钙、氯化钠等均为分析纯,国药集团。
AB104N电子天平德国Sartorius公司;UV-1700紫外分光光度计日本岛津公司;Minibeadbeater-16细胞破碎仪美国Biospec公司;Vario EL III型元素分析仪德国Elementar公司;TGL-15B高速台式离心机上海安亭科学仪器厂;Fd-1-50真空冷冻干燥机北京博医康实验仪器有限公司;RCT B S25型磁力搅拌器德国IKA公司;1 L光生物反应器德国Schott Duran公司。
1.2实验方法
1.2.1培养基及培养条件培养基为Modified Bristol’s Medium[7],培养基组成(g·L-1):NaCl 0.025,CaCl2·2H2O 0.025,NaNO30.750,MgSO4·7H2O 0.075,K2HPO40.075,KH2PO40.175,FeCl3·6H2O 0.005,微量元素1 mL。其中,微量元素组成(g·L-1):H3BO30.061,MnSO4·7H2O 0.169,ZnSO4·7H2O 0.287,(NH4)6Mo7O24·4H2O 0.00124,CuSO4·5H2O 0.0025。
使用1 L Schott Duran蓝盖瓶为光生物反应器,瓶口用开有四个孔的橡胶塞密封,四个孔分别用于通气、排气、温度测量和取样。1 L光生物反应器装1 L培养液,接种控制藻体初始浓度为70 mg·L-1,将反应器置于控温磁力搅拌器上,控制搅拌速率400 r·min-1、温度28 ℃,通入CO2浓度为2.5%的空气-二氧化碳混合气,通气量0.2 VVM。
1.2.2光照强度对小球藻细胞生长及细胞组成的影响使用荧光灯调节光照强度分别为:75、150、300、450、600、750、900 μmol·m-2·s-1,进行连续光照培养,每隔12 h取样测定藻体生物量、氮源浓度和藻体细胞组成成分,每组实验设计三组平行。
1.2.3氮源匮乏培养对小球藻细胞生长及细胞组成的影响固定光照强度为750 μmol·m-2·s-1,进行连续光照培养,每隔12 h取样测定藻体生物量和氮源浓度。当初始氮源浓度被耗尽时,每隔24 h取样测定藻体细胞组成成分,每组实验设计三组平行。
1.2.4藻体生物量测定待测藻液稀释0~20倍后,于685 nm波长条件下测定吸光度(OD685 nm)。使用已称重的醋酸纤维素膜(孔径0.45 μm,直径47 mm)过滤50 mL待测藻液,将过滤后的滤膜置于105 ℃烘箱中,烘干至恒重,计算过滤前后滤膜的干重,即得藻体细胞生物量。由于藻体生物量与其在特定波长下的吸光度存在线性关系,以OD685值为横坐标,藻体生物量为纵坐标,得标准曲线:y=0.255x-0.006(R2=0.997)。根据以下方程计算藻体生物量产率:
生物量产率(mg·L-1·d-1)=(t时刻藻体浓度-藻体初始浓度)/培养时间t
1.2.5氮源浓度测定由于硝酸根离子在220 nm波长处有最大的吸收值,因此采用紫外分光光度法测定培养基中硝酸钠的浓度[20]。
1.2.6藻体细胞组成的测定采用Fuentes等[21]报道的元素分析法测定藻体蛋白质含量。准确称取5 mg干藻体,使用元素分析仪测定藻体中的N元素含量,根据以下方程计算藻体蛋白质含量和蛋白质产率。
蛋白质含量(%)=6.25×氮元素含量
蛋白质产率(mg·L-1·d-1)=生物量产率×蛋白质含量
藻体碳水化合物含量测定:准确称取15.0 mg干藻体,置于2 mL离心管中,加入1 mL 72% H2SO4和0.5 g研磨珠,使用bead-beater破碎7 min后,在30 ℃条件下水浴1 h。将混合液转移至50 mL离心管中,再加入17 mL蒸馏水稀释至4% H2SO4,在121 ℃条件下灭菌20 min。混合液在6000 r·min-1条件下离心2 min后,采用苯酚-硫酸法测定上清液中的碳水化合物含量。根据以下方程计算藻体碳水化合物产率。
碳水化合物产率(mg·L-1·d-1)=生物量产率×碳水化合物含量
采用Blight-Dyer法提取测定油脂含量[22],根据以下方程计算藻体油脂产率:
油脂产率(mg·L-1·d-1)=生物量产率×油脂含量
1.2.7数据处理与分析分别采用SPSS 20.0和Oringin 8.5软件对数据进行分析和图形绘制。
2 结果与分析
2.1不同光照强度对小球藻细胞生长和氮源消耗的影响
由图1和图2可知,在不同光照条件下,培养初期的藻体生物量浓度均随培养时间延长而逐渐提高;当初始氮源浓度耗尽后,藻体生物量浓度还可持续提高,但细胞生长速率呈现降低趋势,之后藻体细胞生长进入稳定期。分析原因可能是氮源耗尽后,小球藻开始利用自身蛋白为氮源继续生长,但当自身蛋白降低至不足以维持细胞正常生长时,藻细胞开始进入稳定期。当光照强度由75 μmol·m-2·s-1增大至300 μmol·m-2·s-1时,小球藻的细胞生长速率和氮源消耗速率均明显提高,初始氮源浓度分别在培养时间为4.5、2.8、2.3 d时耗尽;但进一步增大光照强度时,藻细胞生长速率和氮源消耗速率均提高不明显。该结果表明,当光照强度小于300 μmol·m-2·s-1时,小球藻细胞处于光照限制条件;而当光照强度为300~900 μmol·m-2·s-1时,小球藻细胞处于光照饱和条件。Ho等[16]研究发现当接种量为20 mg·L-1时,光照强度高于75 μmol·m-2·s-1就会对小球藻Chlorella vulgaris FSP-E生长产生抑制作用,而当接种量为80~200 mg·L-1时,其生物量产率均在450 μmol·m-2·s-1达最大值。Yeh等[7]研究发现当采用LT5荧光灯培养小球藻Chlorella vulgaris ESP-31时,其光饱和强度为9~32 W·m-2。这说明光照强度对微藻细胞生长的影响主要与藻种自身特性和培养条件相关。而在本实验所采用的培养条件范围内,发现藻细胞生长未受抑制,说明该藻株可耐受较高的光照强度。
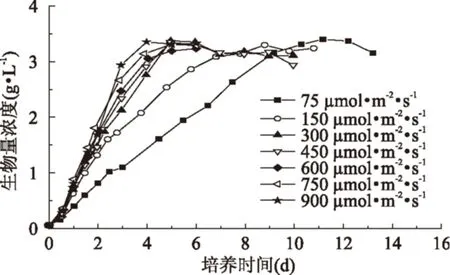
图1 不同光照强度对小球藻细胞生长的影响Fig.1 Effect of different light intensities on cell growth rate of Chlorella sorokiniana
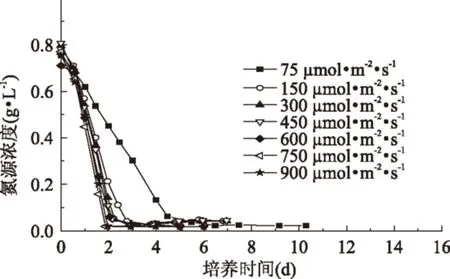
图2 不同光照强度对小球藻氮源消耗的影响Fig.2 Effect of different light intensities nitrogen consumption of Chlorella sorokiniana
2.2不同光照强度对小球藻细胞组成的影响
对于不同的光照培养条件,均在氮源耗尽的初始时间点,收集藻细胞并进行细胞组成成分分析,结果如图3所示。由图3可知,藻体细胞主要组成成分为蛋白质、油脂和碳水化合物,这三者可占到总细胞组成的90%左右,但在不同光照培养条件下,这三者分别占总细胞重量的比例会有所不同。当光照强度由75 μmol·m-2·s-1增大至900 μmol·m-2·s-1时,蛋白质和油脂含量分别由61.0%和13.9%下降至52.9%和8.2%,而碳水化合物含量由14.6%提高至29.3%。该结果表明,增大光照强度有利于小球藻碳水化合物的积累,但不利于积累蛋白质和油脂。Guedes等[8]研究表明增大光照强度也会降低微藻Pavlovalutheri的油脂含量,主要原因为油脂是叶绿体的重要组成成分,当光照强度较高时,微藻细胞就不需要较高的叶绿体活性来吸收光能量。Ho等[9]研究发现当光照强度由60 μmol·m-2·s-1增大至420 μmol·m-2·s-1时,也可明显提高微藻ScenedesmusobliquusCNW-N的碳水化合物含量。但也有研究表明,增大光照强度是否会促进藻细胞积累碳水化合物含量,主要是与微藻种类及其自身特性相关,藻细胞积累碳水化合物与光照强度不存在一定的正相关性[10]。
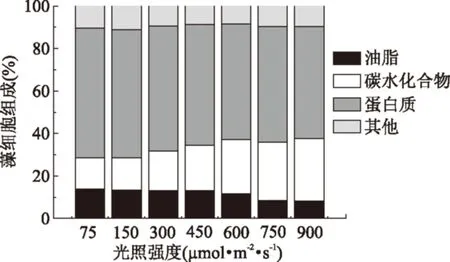
图3 不同光照强度对小球藻细胞组成的影响Fig.3 Effect of different light intensities on cell composition of Chlorella sorokiniana
2.3不同光照强度对小球藻生物量产率、蛋白质产率、油脂产率和碳水化合物产率的影响
对于不同的光照培养条件,均在氮源耗尽的初始时间点对生物量产率、蛋白质产率、油脂产率和碳水化合物产率进行分析,结果如图4和图5所示。由图4和图5可知,当光照强度由75 μmol·m-2·s-1增大至900 μmol·m-2·s-1时,小球藻生物量产率、蛋白质产率、油脂产率和碳水化合物产率均呈现先上升后下降趋势。虽然随光照强度的增大,藻体蛋白质和油脂含量呈现逐渐下降趋势,但由于生物量产量的明显提高,也使得其各自产率可在一定程度上有所提高。其中,当光照强度为750 μmol·m-2·s-1时,生物量产率、蛋白质产率和碳水化合物产率达最大值,分别为935.6、509.8、256.0 mg·L-1·d-1。而当光照强度为450 μmol·m-2·s-1时,油脂产率达最大值,为105.0 mg·L-1·d-1。
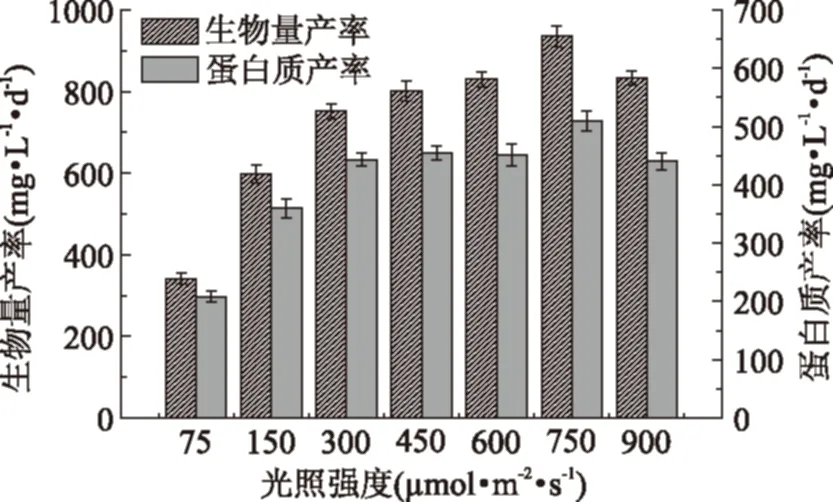
图4 不同光照强度对小球藻生物量产率和蛋白质产率的影响Fig.4 Effect of different light intensities on biomass productivity and protein productivity of Chlorella sorokiniana

表1 光自养条件下小球藻C. sorokiniana FACHB-275的生物量产率、碳水化合物产率和油脂产率与文献结果的比较

图5 不同光照强度对小球藻生物量产率和蛋白质产率的影响Fig.5 Effect of different light intensities on biomass productivity and proteinproductivity of Chlorella sorokiniana
2.4氮源匮乏培养对小球藻细胞组成的影响
在光照强度为750 μmol·m-2·s-1条件下,考察了氮源匮乏培养对小球藻细胞组成的影响,结果如图6所示。对于不同的氮源匮乏培养时间,其藻细胞组成成分也都主要为蛋白质、油脂和碳水化合物,同时这三者所占比例随培养时间不同而呈现明显变化。小球藻的蛋白质含量由54.5%下降至18.5%;油脂含量由8.5%上升至27.9%,相比氮源匮乏培养前提高了89%;而碳水化合物含量则呈现先上升后下降趋势,在氮源匮乏培养2 d(即总培养时间为4 d)时达最大值,为59.1%,相比氮源匮乏培养前提高了84%。

图6 氮源匮乏培养对小球藻细胞生长和细胞组成的影响Fig.6 Effect of nitrogen deprivation on cell growth and cell composition of Chlorella sorokiniana
分析原因主要是在氮源匮乏条件下,小球藻开始利用自身蛋白为氮源以维持细胞正常生长需求,同时引起其代谢转向非含氮储能物质的合成(如油脂和碳水化合物),以适应外界条件的变化[13]。此外,有研究表明,淀粉为大多数微藻主要的储能碳水化合物,并且其合成和油脂合成共用相同的前体物质[12]。而对于大多数微藻来说(特别是绿藻),在营养缺乏的初始阶段主要是合成淀粉来作为储能物质,而只有当营养源(特别是氮源)缺乏较长时间时,藻细胞才会由淀粉合成转变为更高储能物质油脂的合成[12-13]。因此,可发现在氮源匮乏条件下,小球藻达最高碳水化合物产率(471.1 mg·L-1·d-1)和油脂产率(150.6 mg·L-1·d-1)的时间点会有所不同,分别在氮源匮乏培养2 d和4 d时。由表1可知,当固定氮源匮乏培养时间为2 d时,小球藻生物量产率(797.1 mg·L-1·d-1)和碳水化合物产率(471.1 mg·L-1·d-1)优于大多数文献报道的结果,同时其油脂产率(104.4 mg·L-1·d-1)也相对较好。因此,通过此方法小球藻可同时用于碳水化合物和油脂的生产。
3 结论
随光照强度的增强,小球藻生物量产率和碳水化合物含量可明显提高,而蛋白质含量和油脂含量则呈现缓慢下降趋势;小球藻生物量产率、蛋白质产率和碳水化合物产率在光照强度为750 μmol·m-2·s-1时达最大值,而油脂产率则在光照强度为450 μmol·m-2·s-1时达最大值。通过氮源匮乏培养可明显促进小球藻碳水化合物和油脂含量的积累,发现当氮源匮乏培养时间分别为2 d和4 d时,小球藻碳水化合物产率和油脂产率可分别达最大值,相比氮源匮乏培养前,分别提高了84%和89%。而当固定氮源匮乏培养时间为2 d时,小球藻的生物量产率、碳水化合物产率和油脂产率优于大多数文献报道的结果。本研究可为利用小球藻同时生产碳水化合物和油脂提供一定的参考依据。
[1]Markou G,Nerantzis E. Microalgae for high-value compounds and biofuels production:A review with focus on cultivation under stress conditions[J]. Biotechnology Advances,2013,31:1532-1542.
[2]杨贤庆,武琼,胡晓,等. 微藻综合加工利用研究进展[J]. 食品工业科技,2015,36(10):360-364.
[3]Wang L,Li Y,Sommerfeld M,et al. A flexible culture process for production of the green microalgaScenedesmusdimorphusrich in protein,carbohydrate or lipid[J]. Bioresource Technology,2013,129:289-295.
[4]Spolaore P,Joannis-Cassan C,Duran E,et al. Commercial applications of microalgae[J]. Journal of Bioscience and Bioengineering,2006,101(2):87-96.
[5]Chen C Y,Zhao X Q,Yen H W,et al. Microalgae-based carbohydrates for biofuel production[J]. Biochemical Engineering Journal,2013,78:1-10.
[6]翟映雪,梁成伟,张伟,等. 微藻油脂的研究进展[J]. 食品工业科技,2014,35(17):370-374.
[7]Yeh K L,Chang J S,Chen W M. Effect of light supply and carbon source on cell growth and cellular composition of a newly isolated microalgaChlorellavulgarisESP-31[J]. Engineering in Life Sciences,2010,10(3):201-208.
[8]Guedes A C,Meireles L A,Amaro H M,et al. Changes in lipid class and fatty acid composition of cultures ofPavlovalutheri,in response to light intensity[J]. Journal of the American Oil Chemists’ Society,2010,87(7):791-801.
[9]Ho S H,Chen C Y,Chang J S. Effect of light intensity and nitrogen starvation on CO2fixation and lipid/carbohydrate production of an indigenous microalgaScenedesmusobliquusCNW-N[J]. Bioresource Technology,2012,113:244-252.
[10]Carvalho A P,Monteiro C M,Malcata F X. Simultaneous effect of irradiance and temperature on biochemical composition of the microalgaPavlovalutheri[J]. Journal of Applied Phycology,2009,21(5):543-552.
[11]Chen C Y,Lee P J,Tan C H,et al. Improving protein production of indigenous microalga Chlorella vulgaris FSP-E by photobioreactor design and cultivation strategies[J]. Biotechnology Journal,2015,10(6):905-914.
[12]Li Y,Han D,Sommerfeld M,et al. Photosynthetic carbon partitioning and lipid production in the oleaginous microalgaPseudochlorococcumsp.(Chlorophyceae)under nitrogen-limited conditions[J]. Bioresource Technology,2011,102(1):123-129.
[13]Procházková G,Brányiková I,Zachleder V,et al. Effect of nutrient supply status on biomass composition of eukaryotic green microalgae[J]. Journal of Applied Phycology,2013,26:1359-1377.
[14]Zhu S,Huang W,Xu J,et al. Metabolic changes of starch and lipid triggered by nitrogen starvation in the microalga Chlorella zofingiensis[J]. Bioresource Technology,2014,152:292-298.
[15]Dragone G,Fernandes B D,Abreu A P,et al. Nutrient limitation as a strategy for increasing starch accumulation in microalgae[J]. Applied Energy,2011,88(10):3331-3335.
[16]Ho S H,Huang S W,Chen C Y,et al. Characterization and optimization of carbohydrate production from an indigenous microalga Chlorella vulgaris FSP-E[J]. Bioresource Technology,2013,135:157-165.
[17]Ho S,Lai Y Y,Chiang C Y,et al. Selection of elite microalgae for biodiesel production in tropical conditions using a standardized platform[J]. Bioresource Technology,2013,147:135-142.
[18]Ho S H,Chen C N N,Lai Y Y,et al. Exploring the high lipid production potential of a thermotolerant microalga using statistical optimization and semi-continuous cultivation[J]. Bioresource Technology,2014,163:128-135.
[19]Markou G,Nerantzis E. Microalgae for high-value compounds and biofuels production:a review with focus on cultivation under stress conditions[J]. Biotechnology Advances,2013,31(8):1532-1542.
[20]Chiu S Y,Kao C Y,Tsai M T,et al. Lipid accumulation and CO2utilization ofNannochloropsisoculatain response to CO2aeration[J]. Bioresource Technology,2009,100(2):833-838.
[21]Fuentes M M R,Fernandez G G A,Perez J A S,et al. Biomass nutrient profiles of the microalgaPorphyridiumcruentum[J]. Food Chemistry,2000,70:345-353.
[22]Bligh E G,Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
Effects of light intensity and nitrogen limitation on cell growth and cell composition ofChlorellasorokiniana
YANG Xu-qiu,CHEN Jian-feng,ZHENG Xiang-nan,XIE You-ping*
(College of Biological Science and Engineering,Fuzhou University,Fuzhou 350108,China)
The effects of light intensity and nitrogen limitation on cell growth and cell composition ofChlorellasorokinianawas investigated in this study. The results showed that a high light intensity could significantly improve biomass productivity and carbohydrate content ofChlorellasorokiniana,but caused a slight decrease in lipid content and protein content. The highest biomass productivity(935.6 mg·L-1·d-1),protein productivity(509.8 mg·L-1·d-1)and carbohydrate productivity(256.0 mg·L-1·d-1)were achieved at a light intensity of 750 μmol·m-2·s-1,while the highest lipid productivity(105.0 mg·L-1·d-1)was obtained at a light intensity of 450 μmol·m-2·s-1. Moreover,nitrogen deprivation was employed to trigger the accumulation of lipid and carbohydrate. It was found that under nitrogen deprivation for 2 days and 4 days,the carbohydrate productivity and lipid productivity ofChlorellasorokinianacould be further increase to 471.1 mg·L-1·d-1and 150.6 mg·L-1·d-1,respectively.
Chlorellasorokiniana;light intensity;nitrogen deprivation;cell composition
2016-04-14
阳需求(1994-),男,硕士研究生,研究方向:生物化工,E-mail:2434949390@qq.com。
谢友坪(1986-),男,助理研究员,研究方向:生物化工,E-mail:ypxie@fzu.edu.cn。
福建省青年科技人才创新基金项目(2016J05077);福州市科技计划项目(2015-G-69);福州大学校人才基金项目(XRC-1464)。
TS201.3
A
1002-0306(2016)18-0246-05
10.13386/j.issn1002-0306.2016.18.038

