几种因素对大孔树脂纯化羊栖菜多酚效果的影响
曾 帅,周德庆,刘 楠,*
(1.中国水产科学研究院黄海水产研究所,山东青岛 266071;2.上海海洋大学食品学院,上海 201306;)
几种因素对大孔树脂纯化羊栖菜多酚效果的影响
曾帅1,2,周德庆1,刘楠1,*
(1.中国水产科学研究院黄海水产研究所,山东青岛 266071;2.上海海洋大学食品学院,上海 201306;)
以新鲜羊栖菜为研究对象,比较4种大孔吸附树脂对羊栖菜多酚的吸附与解吸效果,筛选出其中最适合分离纯化羊栖菜多酚的大孔吸附树脂。研究了pH、流速、样品浓度、洗脱剂浓度4种因素对大孔吸附树脂纯化羊栖菜多酚的影响。结果表明,AB-8型大孔吸附树脂对羊栖菜多酚吸附率和解吸率最高,在条件为pH 5,吸附流速1.5 BV/h,样品浓度70 μg/mL,洗脱剂乙醇浓度70%,洗脱流速1.5 BV/h及洗脱剂用量90 mL下,经树脂纯化后的羊栖菜多酚含量从溶剂萃取初步分离的31.24%提高至62.15%。
大孔吸附树脂,纯化,羊栖菜,多酚
羊栖菜(Sargassumfusiforme),也称玉海草、鹿角尖等,属褐藻门。羊栖菜富含多种功能性物质,如褐藻酸、多酚类化合物、甘露醇、褐藻多糖硫酸酯、维生素、碘、β-胡萝卜素和牛磺酸等[1],日本称其为“长寿菜”,用它为原料来开发保健品、调味品及方便食品等多种产品[2],具有较高的营养价值和经济价值。
近年来,葡萄多酚和茶多酚等多酚类物质受到广泛关注[3],而对羊栖菜多酚的研究中,存在多酚提取量较低、粗提液中多酚纯度不高等问题,影响羊栖菜多酚在食品、医疗及化妆品等领域的应用。羊栖菜多酚是一类重要的褐藻多酚化合物,褐藻多酚对自由基有较显著的清除能力[4],可以作为天然的抗氧化剂与自由基清除剂应用于医药、化妆品及保健食品等领域[5]。此外,现代药理学研究表明,褐藻多酚还具有化学防御[6]、抑菌[7]、抗凝血[8]、延缓衰老[9]、抗高血糖[10]、抗肿瘤[11]及促进睡眠[12]等多种生物活性功能。开展优化羊栖菜多酚分离纯化工艺研究对扩大其在食用、药用和保健等方面的应用具有重要意义。
溶剂萃取法和沉淀分离法作为传统的植物多酚分离纯化方法,存在一些不足,如成本高,纯化纯度较低等[13]。大孔吸附树脂具有诸多优点,如选择性强[14]、稳定性高、吸附容量大[15]、吸附条件温和、纯化纯度较高及再生简便[16]等,能弥补这些不足。近年来,大孔吸附树脂越来越广泛应用于动植物原料中活性物质的分离纯化。
本研究先对羊栖菜多酚进行溶剂萃取初步分离,然后再选用4种大孔吸附树脂对羊栖菜多酚进行进一步纯化,能避免树脂因杂质较多而出现堵塞及污染等问题,提高多酚的纯化效率。筛选出其中最适合分离纯化羊栖菜多酚的大孔吸附树脂,通过动态吸附和解吸实验研究pH、流速、样品浓度、洗脱剂浓度等几种因素对大孔吸附树脂纯化羊栖菜多酚的影响,为羊栖菜多酚的分离纯化应用于生产实践中提供一定的数据参考。
1 材料与方法
1.1材料与仪器
新鲜羊栖菜浙江省温州市洞头县乐雁美食坊公司;AB-8 大孔吸附树脂天津南开大学化工厂;DA-201大孔吸附树脂天津市海光化工有限公司;HP-20大孔吸附树脂日本三菱化学株式会社;D141大孔吸附树脂成都中兰晨光化工研究院;Folin-Ciocalteau试剂上海蓝季科技发展有限公司;没食子酸等国药集团化学试剂有限公司。
HW·SY21-K恒温水浴锅北京长风仪器仪表公司;KQ-300VDE电子天平北京赛多利斯科学仪器有限公司;T6新悦-可见分光光度计北京普析通用仪器有限公司;RE-52AA旋转蒸发仪上海亚荣生化仪器厂;TYS-200高速多功能粉碎机浙江省永康市红太阳机电有限公司;STARTER3100 pH计奥豪斯仪器有限公司。
1.2样品处理
将新鲜羊栖菜在自然条件下风干,然后经粉碎再过40目筛,得到的羊栖菜粉末含水量为3.6%±0.02%(干基),存放于4 ℃冰箱备用。
1.3羊栖菜多酚含量的测定
以没食子酸为标准品,采用福林酚法[17]绘制羊栖菜多酚含量的标准曲线,根据标准曲线方程计算羊栖菜多酚含量。
1.4羊栖菜多酚样品的制备
准确称取1.0000 g羊栖菜粉于带塞三角瓶中,用体积分数为40%的乙醇溶液以1∶55 g·mL-1料液比在70 ℃下水浴4.5 h,浸提2次,得到羊栖菜多酚粗提物,在45 ℃下减压旋蒸,得褐色膏状物,取羊栖菜多酚样品浸膏20 g,溶于100 mL去离子水中,按1∶1(V/V)分别通过正己烷、二氯甲烷、乙酸乙酯和正丁醇进行萃取[14],得到各自溶剂萃取液,在45 ℃下减压蒸干,使其含水量与羊栖菜粉末样品一致,然后称其质量,根据标准曲线方程计算各自羊栖菜多酚含量,用萃取效果最佳的溶剂对羊栖菜多酚粗提物进行初步分离,将得到的羊栖菜多酚膏状物用去离子水溶解,作为样品液。
1.5大孔吸附树脂预处理
用无水乙醇将4种大孔吸附树脂浸泡24 h,然后用去离子水进行反复清洗,直至无白色混浊现象,并无乙醇味。再进行酸碱处理,依次加入4倍体积5% HCl、去离子水和5% NaOH浸泡3 h后,用去离子水冲洗至中性。
1.6大孔吸附树脂的筛选
称取经预处理的AB-8、DA-201、HP-20及D141四种大孔吸附树脂各1 g,分别加入锥形瓶中,分别加入50 mL一定质量浓度C0(μg/mL)经萃取分离的羊栖菜多酚样品液。在25 ℃下水浴振荡24 h,测定上清液中羊栖菜多酚质量浓度Ce(μg/mL)。过滤得到的吸附树脂,用去离子水洗涤两次,再装入加有50 mL无水乙醇的锥形瓶中。在相同的条件下进行树脂解吸,测定解吸液中羊栖菜多酚的质量浓度Cd(μg/mL)。
根据以下公式计算4种大孔吸附树脂对羊栖菜多酚的吸附量、吸附率及解吸率,从而筛选出最合适的大孔吸附树脂。
吸附量(μg/g)=(C0-Ce)×V0/m
(1)
吸附率(%)=(C0-Ce)/C0×100
(2)
解吸率(%)=Cd/(C0-Ce)×100
(3)
式中,C0:经初步分离的羊栖菜多酚样品液初始质量浓度,μg/mL;Ce:树脂吸附平衡时样品液中羊栖菜多酚的质量浓度,μg/mL;Cd:树脂解吸后解吸液中羊栖菜多酚的质量浓度,μg/mL;V0:羊栖菜多酚样品液的体积,mL;m:树脂质量,g。
1.7羊栖菜多酚的静态吸附曲线
采用SPSS22.0进行数据处理。计数资料用以卡方检验,计量资料用以t值检验,以P<0.05判定组间差异有统计学意义。
称取1 g筛选的最合适树脂于锥形瓶中,加入50 mL 50 μg/mL经初步分离的羊栖菜多酚样品液,在25 ℃下水浴振荡吸附,分别在2、4、6、8、10、12和24 h取上清液,测羊栖菜多酚质量浓度,用公式(1)计算吸附量,绘制对羊栖菜多酚的树脂静态吸附曲线。
1.8几种因素对羊栖菜多酚纯化效果影响研究
1.8.1pH对树脂吸附羊栖菜多酚的影响用0.5 mol/L HCl溶液和0.5 mol/L NaOH溶液将50 mL 50 μg/mL经初步分离的羊栖菜多酚样品液调成不同的pH(3、4、5、6、7、8、9),以1.0 BV/h的速度过柱(以20 mL的筛选最适树脂湿法上柱),测定过柱后样品液中羊栖菜多酚质量浓度,按照公式(2)计算吸附率。
1.8.2吸附流速对树脂吸附羊栖菜多酚的影响用0.5 mol/L HCl溶液将50 mL 50 μg/mL经初步分离的羊栖菜多酚样品液调pH为5,分别以0.5、1.0、1.5、2.0、2.5、3.0、3.5和4.0 BV/h过柱,测定过柱后样品液中羊栖菜多酚质量浓度,按照公式(2)计算吸附率。
1.8.3样品液浓度对树脂吸附羊栖菜多酚的影响用0.5 mol/L HCl溶液将50 mL不同质量浓度(50、60、70、80、90、100、110 μg/mL)经初步分离的羊栖菜多酚样品液调pH为5,以1.5 BV/h过柱,测定过柱后样品液中羊栖菜多酚质量浓度,按照公式(2)计算吸附率。
1.8.4洗脱剂浓度对树脂解吸羊栖菜多酚的影响用0.5 mol/L HCl溶液将50 mL 70 μg/mL经初步分离的羊栖菜多酚样品液调pH为5,以1.5 BV/h过柱,测定过柱后样品液中羊栖菜多酚质量浓度。将柱中的吸附树脂转入锥形瓶中,分别加入50 mL 60%、70%、80%及90%的乙醇溶液,于25 ℃下水浴振荡解吸,并在2、4、6、8、10、12和24 h取解吸液,测定羊栖菜多酚质量浓度。
1.8.5洗脱流速对树脂解吸羊栖菜多酚的影响用0.5 mol/L HCl溶液将50 mL 70 μg/mL经初步分离的羊栖菜多酚样品液调pH为5,以1.5 BV/h过柱,测定过柱后样品液中羊栖菜多酚质量浓度。再用50 mL 70%的乙醇溶液分别以0.5、1.0、1.5、2.0、2.5、3.0、3.5和4.0 BV/h过柱进行解吸,测定解吸液中羊栖菜多酚的质量浓度,根据公式(3)计算解吸率。
1.9数据处理
采用Excel和SPSS 17.0软件对实验数据进行作图分析和统计分析,定义p<0.05时差异具有统计学意义。
2 结果与分析
2.1羊栖菜多酚含量的测定
以没食子酸为标准品,采用福林酚法绘制羊栖菜多酚含量的标准曲线,得到标准曲线方程为:Y=0.0161X+0.014,R2=0.9997,表明线性关系良好。
2.2羊栖菜多酚样品的制备
采用溶剂萃取对羊栖菜多酚粗提物进行初步分离,除去一些大分子蛋白及其他杂质,得到相对较为纯净的羊栖菜多酚样品,避免下一步纯化中树脂因杂质较多而出现堵塞及污染等问题,提高多酚的纯化效率。实验结果如图1所示。
由图1可知,羊栖菜多酚粗提物分别经四种溶剂萃取后,乙酸乙酯相中多酚含量最多,达到31.24%,根据相似相溶原理,溶剂乙酸乙酯更适合萃取羊栖菜多酚。因此,以乙酸乙酯萃取相中的羊栖菜多酚作为下一步树脂分离纯化的样品。
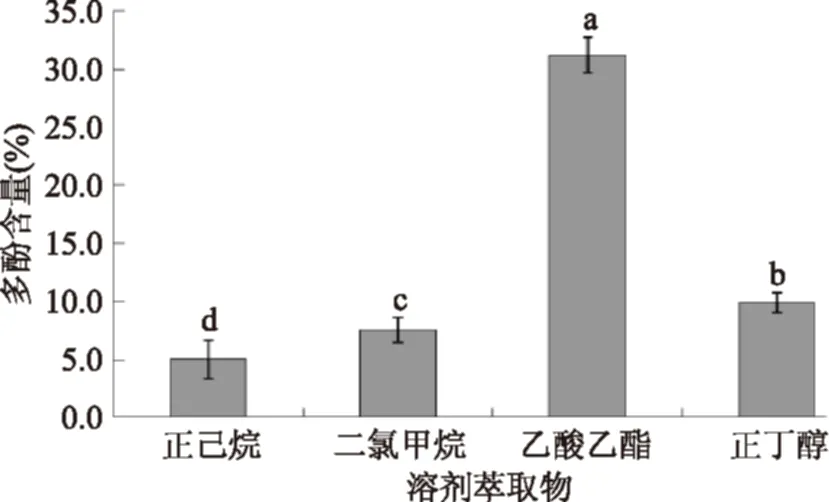
图1 溶剂分别萃取后各相质量及多酚含量测定结果Fig.1 Each phase quality after solvent extraction respectively and polyphenols content determination results注:图中所标不同字母表示相互之间差异显著(p<0.05),相同字母表示差异不显著(p>0.05)。图2同。
2.3大孔吸附树脂的筛选
不同大孔吸附树脂的结构与性质有所差异,因此吸附分离的效果也不一样。AB-8、DA-201、HP-20及D141四种大孔吸附树脂对羊栖菜多酚的吸附与解吸效果如图2所示。
大孔吸附树脂对目标物质的吸附与解吸效果由极性、结构和比表面积等多种因素综合决定。由图2可知,AB-8吸附树脂对羊栖菜多酚的吸附率和解吸率均高于其他三种树脂,可能是因为AB-8吸附树脂同羊栖菜多酚的极性较为接近,且具有适合的表面结构和较高的比表面积,因此选择AB-8吸附树脂对羊栖菜多酚进行进一步的纯化。

图2 4种大孔吸附树脂对羊栖菜多酚吸附与解吸效果Fig.2 Adsorption and desorption effect of four kindsmacroporous adsorption resin to Sargassum fusiforme polyphenols注:图中大写字母表示吸附率差异性,小写字母表示解吸率差异性。
2.4羊栖菜多酚的静态吸附曲线
由图3可知,AB-8树脂对羊栖菜多酚的吸附具有一定的时间依赖性。0~8 h内AB-8吸附树脂对羊栖菜多酚的吸附量随时间增加而增大,0~2 h和6~8 h吸附曲线上升明显,其中6~8 h吸附速度仍较快,表明AB-8树脂在吸附量较高时并不是理想的单分子层,可能是因为羊栖菜多酚中的酚羟基和苯环结构使其能够以氢键和疏水键发生分子间缔合,因此AB-8树脂对羊栖菜多酚的吸附量有所增加。8 h后吸附量缓慢上升,12 h达到较为稳定的状态,表明基本达到吸附平衡。
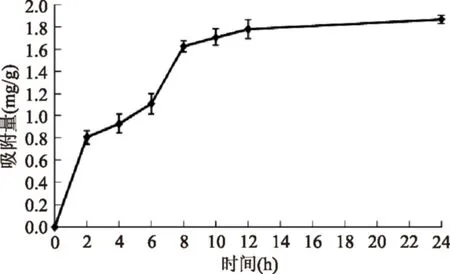
图3 AB-8吸附树脂对羊栖菜多酚的静态吸附曲线Fig.3 AB-8 adsorption resin for Sargassum fusiforme polyphenols static adsorption curve
2.5几种因素对羊栖菜多酚纯化效果影响研究
2.5.1pH对AB-8树脂吸附羊栖菜多酚的影响pH不同,溶液中化合物的电离状态也不同,一般情况下,分子状态的吸附质在吸附过程中更易于被吸附剂吸附。羊栖菜多酚样品液pH对AB-8树脂吸附羊栖菜多酚的影响如图4所示。
由图4可知,当羊栖菜多酚样品液pH在3~5之间,AB-8树脂对羊栖菜多酚的吸附率缓慢上升,可能是由于羊栖菜多酚具有酚羟基结构,显弱酸性,在弱酸性环境中以分子状态存在,因此吸附效果较好。而当羊栖菜多酚样品液pH大于5后,吸附率呈下降趋势,可能是因为pH升高促进盐结构的形成,不利于吸附。所以选择5作为树脂吸附羊栖菜多酚最合适的pH。
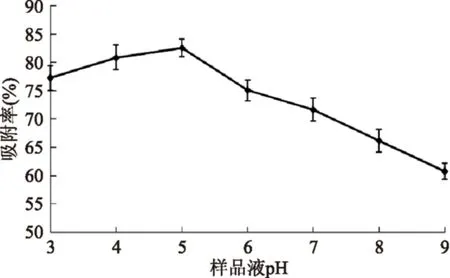
图4 样品液pH对AB-8树脂吸附羊栖菜多酚的影响Fig.4 The effect of sample liquid pH for AB-8 resin adsorption Sargassum fusiforme polyphenols
2.5.2吸附流速对AB-8树脂吸附羊栖菜多酚的影响由图5可知,样品液吸附流速越慢,吸附效果越好,其中在0.5、1.0和1.5 BV/h吸附流速下,AB-8树脂对羊栖菜多酚的吸附率都在80%以上,而当吸附流速超过2.0 BV/h,吸附率下降较明显,因为流速过快,树脂来不及完全吸附样品液中的羊栖菜多酚。吸附流速慢有利于样品溶液中的羊栖菜多酚在AB-8树脂床中充分扩散和吸附,但流速太慢会延长生产周期,因为树脂床体积为20 mL,样品液体积为50 mL,当吸附流速为1.0 BV/h,吸附时间便会比1.5 BV/h的吸附时间延长50 min;当吸附流速为0.5 BV/h,吸附时间便会比1.5 BV/h的吸附时间延长200 min。综合考虑选择1.5 BV/h的吸附流速。

图5 吸附流速对AB-8树脂吸附羊栖菜多酚的影响Fig.5 The effect of adsorption velocity for AB-8 resin adsorption Sargassum fusiforme polyphenols
2.5.3样品浓度对AB-8树脂吸附羊栖菜多酚的影响由图6可知,AB-8树脂对羊栖菜多酚的吸附具有一定的浓度依赖性。随着羊栖菜多酚样品浓度的增大,AB-8树脂对羊栖菜多酚的吸附率也随之提高,当样品液浓度为70 μg/mL时,吸附率达到最大。继续增大样品液浓度,吸附率呈逐渐下降趋势,因为随着样品液浓度的增大,与其竞争吸附的杂质也增多,多酚在树脂内部的扩散能力会随之降低,并且样品液浓度过高时,会出现些许絮状物或沉淀,导致树脂一定程度的堵塞,吸附能力下降。因此,在后续的吸附实验中,选择70 μg/mL作为羊栖菜多酚样品液浓度。
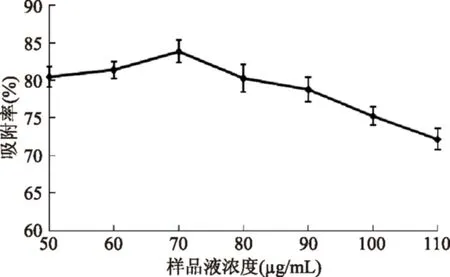
图6 样品浓度对AB-8树脂吸附羊栖菜多酚的影响Fig.6 The effect of sample concentration for AB-8 resin adsorption Sargassum fusiforme polyphenols
2.5.4洗脱剂浓度对AB-8树脂解吸羊栖菜多酚的影响由图7可知,四种浓度的乙醇洗脱液对AB-8吸附树脂的解吸趋势大致相同,70%乙醇解吸液中羊栖菜多酚浓度最高,解吸效果最好,可能是由于不同体积分数的乙醇溶液,极性大小不同,而70%乙醇的极性与羊栖菜多酚极性较为相近。60%乙醇解吸液中羊栖菜多酚浓度最低,80%和90%乙醇溶液对AB-8树脂解吸羊栖菜多酚的影响几乎一致,故选择70%为洗脱剂浓度。

图7 乙醇浓度对AB-8树脂解吸羊栖菜多酚的影响Fig.7 The effect of ethanol concentration for AB-8 resindesorption Sargassum fusiforme polyphenols
2.5.5洗脱流速对AB-8树脂解吸羊栖菜多酚的影响由图8可知,洗脱流速越大,AB-8树脂对羊栖菜多酚的解吸率越低,尤其在洗脱流速大于2.0 BV/h后,解吸率下降更为明显。当洗脱流速为0.5、1.0和1.5 BV/h时,解吸率比较接近,且均在90%以上,但流速太慢会延长生产周期,因为树脂床体积为20 mL,若洗脱液体积为50 mL,当洗脱流速为1.0 BV/h,洗脱时间便会比1.5 BV/h的洗脱时间延长50 min;当洗脱流速为0.5 BV/h,洗脱时间便会比1.5 BV/h的洗脱时间延长200 min。综合考虑时间与解吸率因素,选择1.5 BV/h的洗脱流速较为合适。
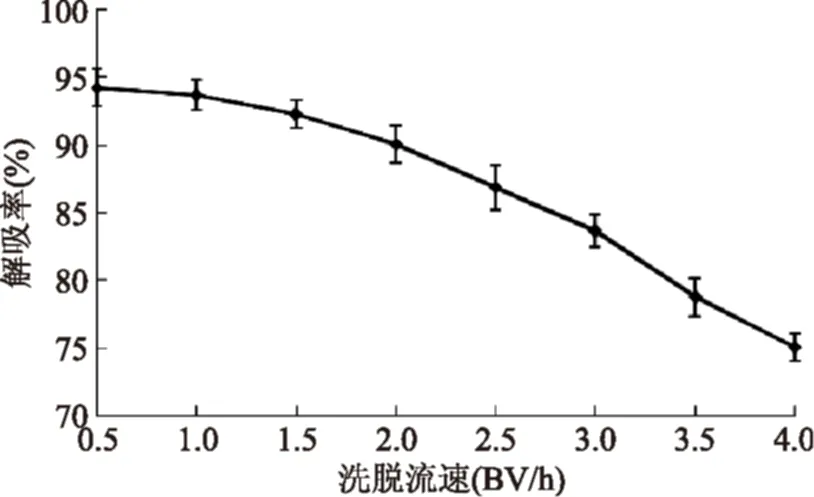
图8 洗脱流速对AB-8树脂解吸羊栖菜多酚的影响Fig.8 The effect of elution velocity for AB-8 resin desorption Sargassum fusiforme polyphenols
2.5.6洗脱剂用量对AB-8树脂解吸羊栖菜多酚的影响由图9可知,10~70 mL洗脱液中的多酚含量较高,当洗脱剂乙醇溶液用量达到40 mL时,AB-8树脂中羊栖菜多酚开始被大量洗脱下来,当洗脱剂用量达到90 mL时,洗脱液中羊栖菜多酚浓度已接近零,可认为已经基本洗脱完全,无拖尾现象。因此,用90 mL乙醇溶液进行洗脱最合适。
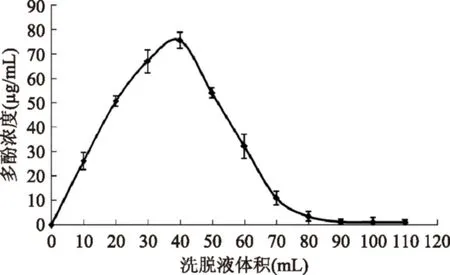
图9 洗脱剂用量对AB-8树脂解吸羊栖菜多酚的影响Fig.9 The effect of eluent dosage for AB-8 resin desorption Sargassum fusiforme polyphenols
2.6纯化后羊栖菜多酚含量的测定
在上述最佳吸附和解吸条件下,用AB-8吸附树脂对经初步分离的羊栖菜多酚样品液进行分离纯化,收集前90 mL洗脱液,在45 ℃下减压旋蒸,得褐色膏状物,使其含水量与羊栖菜粉末样品一致,然后称其质量,按照1.3的方法对羊栖菜多酚含量进行测定,实验结果如表1所示。
由表1可知,经AB-8吸附树脂纯化后的羊栖菜多酚含量达到62.15%,而溶剂萃取初步分离后羊栖菜多酚含量仅为31.24%,有明显提高。
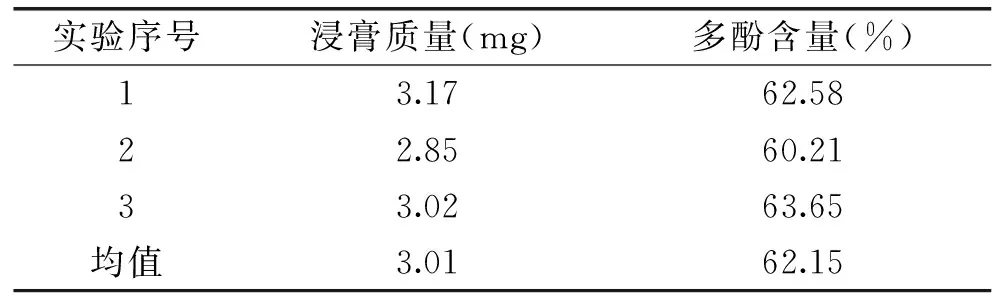
表1 AB-8吸附树脂对羊栖菜多酚的分离纯化效果
3 结论
通过比较4种大孔吸附树脂对羊栖菜多酚的吸附与解吸效果,筛选出AB-8型吸附树脂为最适合分离纯化羊栖菜多酚的大孔吸附树脂。通过动态吸附和解吸实验研究了几种因素对大孔吸附树脂纯化羊栖菜多酚的影响,得出最佳动态吸附条件为pH5,吸附流速1.5 BV/h,样品液浓度70 μg/mL;最佳动态洗脱条件为洗脱剂乙醇浓度70%,洗脱流速1.5 BV/h及洗脱剂用量90 mL。在最优条件下,经AB-8树脂吸附分离得到的样品中,羊栖菜多酚含量从溶剂萃取初步分离的31.24%提高至62.15%,具有较好的工业生产应用价值。
[1]何传辉,何传波,魏好程,等.羊栖菜多酚提取工艺优化[J].食品安全质量检测学报,2015,6(8):2896-2902.
[2]程忠玲,吴效楠.羊栖菜褐藻糖胶的抗凝血和促血管内皮细胞生长活性研究[J].食品研究与开发,2011,32(4):165-167.
[3]Spigno G,Faveri DM. Microwave-assisted extraction of tea phenols:A phenomenological study[J]. Journal of Food Engineering,2009,93(2):210-217.
[4]王君虹,郜海燕,葛林梅,等.微波辅助提取羊栖菜多酚的工艺研究[J].浙江农业学报,2013,25(6):1368-1372.
[5]吕成林,汪秋宽,宋悦凡,等.羊栖菜多酚的提取及纯化工艺研究[J].食品工业科技,2014,35(22):231-235.
[6]Pangestuti R,Kim SK. Biological activities and health benefit effects of natural pigments derived from marine algae[J]. Journal of Functional Foods,2011,3(4):255-256.
[7]Eom SH,Kim YM,Kim SK. Antimicrobial effect of phlorotannins from marine brown algae[J]. Food and Chemical Toxicology,2012,50(9):3251-3255.
[8]Li YX,Wijesekara I,Li Y,et al. Phlorotannins as bioactive agents from brown algae[J].Process Biochemistry,2011,46(12):2219-2224.
[9]Kang MC,Kim KN,Wijesinghe WAJP,et al. Protective effect of polyphenol extracted from Ecklonia cava against ethanol induced oxidative damageinvitroand in zebrafish model[J]. Journal of Functional Foods,2014,6:339-347.
[10]Pantidosa N,Boathb A,Lundc V,et al. Phenolic-rich extracts from the edible seaweed,ascophyllumnodosum,inhibitα-amylase andα-glucosidase:Potential anti-hyperglycemic effects[J]. Journal of Functional Foods,2014,10:201-209.
[11]YangYI,AhnJH,ChoiYS,et al. Brown algae phlorotannins enhance the tumoricidal effect of cisplatin and ameliorate cisplatin nephrotoxicity[J]. Gynecologic Oncology,2015,136(2):355-364.
[12]钱卓权,殷皓臻,黄晓林,等.三种海藻抑菌活性和抗氧化活性[J].浙江农业学报,2014,26(2):384-387.
[13]马乐,韩军歧,张润光,等.大孔吸附树脂在植物多酚分离纯化中的应用现状[J].食品工业科技,2015,36(12):364-367.
[14]侯晓丹,袁其朋,田海源.大孔吸附树脂法分离石榴籽中多酚及其抗氧化活性研究[J].食品科技,2010,35(1):194-198.
[15]吕群金,衣杰荣,丁勇.大孔吸附树脂对杨桃渣多酚吸附分离的优化[J].食品科学,2010,31(6):39-42.
[16]胡明明,张国文,何力.大孔吸附树脂分离纯化花生壳多酚的研究[J].食品科技,2011,36(11):197-200.
[17]张军,李江遐,陆翠珍,等. Folin-ciocalteu比色法测桑叶中多酚含量[J].激光生物学报,2012,21(2):131-135.
Factors affecting polyphenol purification of macroporous resin fromSargassumfusiforme
ZENG Shuai1,2,ZHOU De-qing1,LIU Nan1,*
(1.Yellow Sea Fishery Research Institute,Chinese Academy of Fishery Science,Qingdao 266071,China;2.College of Food Science & Technology,Shanghai Ocean University,Shanghai 201306,China)
To screen suitable polyphenol purifying macroporous resin from freshSargassumfusiforme,comparison of polyphenol adsorption and desorption capabilities was made among 4 macroporous resins. Effects of 4 factors,namely pH,flow rate,sample concentration and eluent concentration,were studied. The highest polyphenol adsorption and desorption rates were observed in resin AB-8 under the condition of pH 5,adsorption flow rate 1.5 BV/h,sample concentration 70 μg/mL,eluent ethanol concentration 70%,elution flow rate 1.5 BV/h and the dosage of eluent 90 mL. The polyphenols content increased from 31.24% of preliminary separation to 62.15%.
macroporous adsorption resin;purification;Sargassumfusiforme;polyphenols
2016-03-04
曾帅(1991-),男,在读硕士研究生,研究方向:海洋功能食品,E-mail:naxiaozizengshuai@163.com。
刘楠(1982-),女,博士,研究方向:海洋功能食品,E-mail:liunan@ysfri.ac.cn。
中央级公益性科研院所基本科研业务费(20603022015001);青岛市市南区科技发展资金项目(2014-14-008-SW)。
TS254.1
B
1002-0306(2016)18-0297-05
10.13386/j.issn1002-0306.2016.18.048

