还原型谷胱甘肽对四氧化二氮致小鼠肺损伤的防护作用
胡 杰,方 辉,李德远,*,乔 燕
(1.军事经济学院军需系,湖北武汉 430035;2.军事经济学院医院,湖北武汉 430035)
还原型谷胱甘肽对四氧化二氮致小鼠肺损伤的防护作用
胡杰1,方辉1,李德远1,*,乔燕2
(1.军事经济学院军需系,湖北武汉 430035;2.军事经济学院医院,湖北武汉 430035)
目的:探讨还原型谷胱甘肽(GSH)对四氧化二氮(N2O4)吸入致小鼠肺损伤的防护作用。方法:动物模型采取在120 L静式染毒柜内吸入N2O4的方法制作。雄性ICR小鼠64只,随机分为对照组,染毒组,GSH低、中、高剂量干预组(GSH低、中、高剂量+染毒),共五组,对照组8只,其余每组14只。染毒前,干预组分别灌胃GSH(1.25、2.50、3.75 g/kg bw·d),对照组和染毒组灌胃等体积生理盐水,连续7 d,第7 d灌胃1 h后染毒。脱臼处死动物,检测肺组织SOD、GSH-Px活性和MDA含量,观察肺病理改变。结果:与对照组比较,染毒组肺组织SOD、GSH-Px活性和MDA含量均极显著降低(p<0.01);与染毒组比较,GSH低、中剂量干预组肺组织SOD和GSH-Px活性均极显著提高(p<0.01),GSH低剂量干预组MDA含量极显著提高(p<0.01),GSH中剂量干预组MDA含量显著提高(p<0.05)。病理切片显示,GSH干预组比染毒组肺损伤程度轻。结论:GSH对N2O4吸入致小鼠肺损伤具有显著防护作用,其作用机制可能与其抑制氧化损伤有关。
还原型谷胱甘肽,四氧化二氮,肺损伤,防护作用
四氧化二氮(N2O4)是我国大型运载火箭液体推进剂的主要组分,具有强氧化性、腐蚀性和易挥发等特点,通过呼吸道吸入中毒可导致肺损伤,在各类火箭发射任务中,以N2O4为主的氮氧化物吸入中毒事故偶有发生[1-2]。目前,N2O4吸入致肺损伤的研究主要见于临床救治[3-4],而关于饮食防护的研究报道较少[5]。
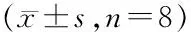
表1 小鼠肺组织SOD、GSH-Px活性和MDA含量
注:**:与对照组比较差异极显著,p<0.01;Δ:与染毒组比较差异显著,p<0.05;ΔΔ:与染毒组比较差异极显著,p<0.01。
谷胱甘肽是一种天然活性物质,存在于多种生物细胞中,以小麦胚芽、酵母和动物肝脏中含量较高[6]。谷胱甘肽以两种形式在体内存在,氧化型(GSSG)和还原型(GSH),还原型谷胱甘肽(GSH)约占95%,是谷胱甘肽的活性成分。GSH参与体内氧化还原过程,它具有抗氧化、解毒和细胞保护等多种生理功能,在医疗、保健品和食品等行业应用广泛[7]。GSH可作为一种生物活性添加剂,应用于抗肿瘤、增强免疫力和延缓衰老等保健食品中;还可作为营养强化剂,应用于乳幼儿和孕妇等的口服保健品中[8]。相关研究表明,GSH对急性肺损伤(ALI)具有重要保护作用。Buchler[9]证实,GSH对次氯酸盐诱导的家兔ALI有明显缓解作用。殷娜等[10]观察到,GSH能有效对抗盐酸吸入致大鼠ALI。但是关于GSH对N2O4中毒所致动物肺损伤的保护作用,还未见报道。研究表明,ALI和肺组织氧化应激关系密切[11-12]。谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)以及丙二醛(MDA),是反映体内过氧化损伤程度的常用指标。因此,本研究结合小鼠肺组织SOD和GSH-Px活性以及MDA含量的变化,探讨GSH对N2O4吸入致小鼠肺损伤的防护作用,为开发富含GSH的食品和保健品提供借鉴和参考。
1 材料与方法
1.1材料与仪器
雄性ICR小鼠、饲料体质量为21~24 g,清洁级,购自北京大学医学院实验动物中心,许可证号:SYXK(京)2006-0025;液态N2O4纯度>99.5%,由航天科技集团公司第101所提供;GSH食品级,西安瑞林生物科技有限公司;GSH-Px、SOD以及MDA检测试剂盒南京建成生物工程公司。
120 L静式染毒柜由军事医学科学院提供;防护面罩天津恩泽科技有限公司;NO2浓度检测管由总装备部军事医学研究所提供;UV-245型分光光度计日本岛津公司;3-16PK型高速冷冻离心机Sigma公司。
1.2实验方法
1.2.1动物建模借鉴刘松等的方法[13],采取在120 L静式染毒柜内吸入N2O4的方式。柜内设有温度计和微型风扇,温度始终保持(25±1) ℃。用微量注射器抽取液态N2O450 μL,由侧面专用小孔注入柜内,开动风扇使N2O4充分挥发并均匀扩散,每隔10 min向柜内补充2 μL N2O4,维持N2O4浓度。除对照组外,所有小鼠均在染毒柜内吸入染毒,时间0.5 h。染毒后将小鼠取出,正常饲养。
1.2.2实验分组ICR小鼠64只,适应性饲养7 d,饲养环境恒温(23±1) ℃,恒湿52%±3%,自由饮水和摄食。适应期后随机分为对照组,染毒组,GSH低剂量+染毒组,GSH中剂量+染毒组,GSH高剂量+染毒组,共五组,对照组8只,其余每组14只。染毒前,GSH三个剂量干预组分别灌胃给予1.25、2.50、3.75 g/kg bw的GSH[10,14],每只0.3 mL,每天1次,连续7 d,对照组和染毒组灌胃等体积生理盐水,第7 d灌胃后1 h,按照动物损伤模型染毒。染毒12 h后,每组取8只,脱臼处死,取肺组织,观察病理改变,并检测各项生化指标;染毒84 h后,观察染毒组和GSH干预组其余6只小鼠的肺病理改变。
1.2.3指标测定小鼠处死后,迅速取左肺组织,用冰生理盐水冲洗、称重,冰浴中匀浆,制备10%肺匀浆液。4 ℃条件下以3000 r/min离心10 min,取上清液。分别采用黄嘌呤氧化酶法测定SOD活性、二硫代二硝基苯甲酸法测定GSH-Px活性、硫代巴比妥酸法测定MDA含量[15-16]。
1.2.4病理观察处死动物,立即摘除右肺组织,置4%多聚甲醛溶液中固定,进行常规切片和HE染色处理,光镜观察病理学变化。
1.3统计学分析
2 结果与分析
2.1小鼠肺组织SOD、GSH-Px活性和MDA含量测定结果
如表1所示,染毒组小鼠肺组织SOD活性极显著低于对照组(p<0.01);与染毒组相比,GSH低、中剂量干预组SOD活性均极显著升高(p<0.01),GSH高剂量干预组SOD活性改变不明显。染毒组小鼠肺组织GSH-Px活性较对照组极显著下降(p<0.01),GSH三个剂量干预组GSH-Px活性较染毒组均极显著提高(p<0.01)。染毒组小鼠肺组织MDA含量极显著低于对照组(p<0.01),GSH低剂量干预组MDA含量极显著高于染毒组(p<0.01),GSH中、高剂量干预组MDA含量均显著高于染毒组(p<0.05)。
N2O4是中等毒性物质,其沸点较低,常温下可挥发分解为NO2。研究发现,氮氧化物吸入中毒损伤的靶器官是肺脏,严重时可导致ALI,表现为肺水肿,损伤程度取决于吸入剂量[1]。相关研究证实,肺组织氧化应激与ALI密切相关[11-12]。NO2本身为自由基,且具有高度活性,推测其导致ALI的作用机制与其直接参与对肺脏的氧化和过氧化损伤有关[13,17]。

本实验中,与染毒组相比,中、低剂量GSH干预组小鼠肺组织SOD、GSH-Px活性均显著提高,表明GSH对N2O4吸入所致小鼠ALI具有保护作用。GSH是生物体内重要的一种内源性抗氧化物,是肺泡上皮衬液中最重要的小分子类抗氧化物质[10],在多种原因引起的氧化应激所致肺损伤中,GSH起重要保护作用[21]。张宏等[22]发现,GSH可减轻内毒素致大鼠ALI症状,且越早应用GSH对肺脏保护作用越强。刘振威等[23]报道,GSH可显著提高ALI大鼠肺组织SOD活性,缓解肺损伤。袁鼎山等[24]证实,GSH可显著提升ALI大鼠肺组织GSH浓度,减轻氧化应激损伤。因此,GSH对N2O4致小鼠ALI保护作用的机制与其可有效抑制氧化损伤有关。但是,本实验中,与染毒组相比,GSH高剂量干预组小鼠肺组织SOD活性没有明显升高,其详细作用机制有待进一步研究。
2.2小鼠肺组织病理观察
组织病理观察结果表明,对照组小鼠肺组织正常(图1A);染毒组肺组织出现明显病变,可见部分出血灶,肺泡和肺间质水肿,大量炎性细胞浸润等典型ALI症状。染毒12 h后,染毒组肺组织肿胀、体积变大、部分淤血(图1B);84 h后,染毒组肺损伤更严重,显著出血,发白肿胀,有部分肺实变区出现(图1C)。与染毒组相比,GSH干预组肺组织病变均减轻,灶性出血、肺组织水肿、炎性细胞浸润等症状均得到缓解,而且随时间延长,肺损伤缓解效果更明显(图1D、E)。低剂量GSH(1.25 g/kg bw·d)对N2O4吸入致小鼠肺损伤的防护效果显著。

图1 小鼠肺组织病理图(HE,200×)Fig.1 The pathology picture of mice lung tissue(HE,200×)注:A:对照组、B:N2O4染毒组12 h后、C:N2O4染毒组84 h后、D:GSH低剂量干预组12 h后、E:GSH低剂量干预组84 h后。
3 结论
综上所述,GSH对N2O4吸入中毒所致小鼠ALI具有明显防护作用,其作用机制可能与清除自由基和活性氧,提高抗氧化酶活性,恢复机体氧化还原平衡,增强机体抗氧化损伤能力有关。本研究可为以GSH作为基料,为开发防护N2O4损伤的特殊功能性食品提供理论依据,为深加工富含GSH的食品提供参考,也可为N2O4中毒防护研究提供思路。
[1]曹巧玲,王中民,方志,等. 双组元火箭推进剂引起肺损伤的研究进展[J]. 职业与健康,2014,30(3):417-419.
[2]李建忠,刘志国,吴继华,等. 四氧化二氮吸入致肺损伤病理学改变及SMAD蛋白表达研究[J]. 西北国防医学杂志,2012,5(33):508-510.
[3]李胜亮,武志宏,张淑琴,等. 30例四氧化二氮群体吸入中毒急救分析[J]. 临床肺科杂志,2011,16(2):307-308.
[4]李建忠,刘志国,常李荣,等. 四氧化二氮吸入中毒致小鼠急性肺水肿药物干预实验研究[J]. 临床和实验医学杂志,2015,14(3):173-176.
[5]吴海寰,叶明亮,夏亚东. 蛋白质摄入量对四氧化二氮致肺水肿时心钠素的影响[J]. 航天医学与医学工程,2000,13(2):146-147.
[6]冮洁,单立峰. 谷胱甘肽的生产及其在食品工业中的应用[J]. 中国调味品,2009,34(2):40-43.
[7]代涛,李松涛,赵红玲,等. 谷胱甘肽的合成及其活性初步评价[J]. 天然产物研究与开发,2015,27:1140-1145.
[8]冷非凡,孙尚琛,魏清伟,等. 酵母谷胱甘肽的研究[J]. 粮油加工,2015(2):58-61.
[9]Buchler N. Tissue lipid peroxidation and reduced glutathione depletion in hypochlorite-induced lung injury[J]. American College of Chest Physicians,2002,121(2):573-581.
[10]殷娜,卢明军,邓小明,等. 还原型谷胱甘肽对大鼠盐酸吸入性肺损伤的保护作用及其机制探讨[J]. 山东医药,2013,53(44):25-27.
[11]Alastair G,Proudfoot,Danny F,et al. Human models of acute lung injury[J]. Dis Model Mech,2011,4(2):145-153.
[12]Perl M,Lomas-Neria J,Venet F,et al. Pathogenesis of indirect(secondary)acute lung injury[J]. Expert Rev Respir Med,2011,5(1):115-126.
[13]刘松,俞森洋. N-乙酰半胱氨酸对偏二甲基肼和四氧化二氮吸入性肺损伤的保护作用[J]. 中国危重病急救医学,2004,16(10):611-614.
[14]焦桂萍,赵兵,袁志柳,等. 还原型谷胱甘肽对大鼠肺缺血再灌注损伤的保护作用[J]. 中国临床保健杂志,2006,9(2):142-144.
[15]管娴月,戴传超,徐玉芬,等. 富硒轮梗霉与奶醋对小鼠降血脂和抗氧化作用的影响[J]. 食品科学,2009,30(17):319-323.
[16]王蕾,包谛,王振宇,等. 红豆越橘提取物对小鼠慢性应激损伤的防护作用[J]. 食品工业科技,2016,37(6):346-350.
[17]Lehnert BE,Archuleta DC,Ellis T,et al. Lung injury following exposure of rats to relatively high mass concentrations of nitrogen dioxide[J]. Toxicology,1994,89:239-277.
[18]宋蔚忠,夏亚东,郭绪益,等. 二氧化氮致大鼠急性肺损伤及其机理探讨[J]. 军事医学科学院院刊,1999,23(4):263-265.
[19]Sagai M,lchinose T,Oda H,et al. Studies on biochemical effects of nitrogen dioxide.Ⅱ. Changes of the protective systems in rat lungs and of lipid peroxidation by acute exposure[J]. Toxicol Environ Health,1982,9(5):153-164.
[20]宋蔚忠,夏亚东,郭绪益,等. 二氧化氮对肺组织匀浆某些生化指标的影响[J]. 卫生毒理学杂志,1999,13(4):70-271.
[21]孔令贵,文辉,杜宝青,等. 谷胱甘肽在预防呼吸机相关性肺损伤中的作用机制分析[J]. 中国基层医药,2015,22(8):1125-1127.
[22]张宏,刘文操. 谷胱甘肽对内毒素致大鼠急性肺损伤的保护作用[J]. 广东医学,2007,28(5):701-703.
[23]刘振威,李玉霞,方阅,等. 还原型谷胱甘肽对大鼠急性肺损伤的保护作用[J]. 中国临床医学,2012,19(6):605-607.
[24]袁鼎山,李爱林,包玉华. 还原型谷胱甘肽对脓毒症大鼠急性肺损伤的干预作用[J]. 中华危重症医学杂志,2013,6(6):353-358.
Protective effects of reduced glutathione on lung injury induced by N2O4in mice
HU Jie1,FANG Hui1,LI De-yuan1,*,QIAO Yan2
(1.Department of Quartermaster,Military Economic College,Wuhan 430035,China;2.Hospital of Military Economic College,Wuhan 430035,China)
Objective:To study the protective effects of reduced glutathione(GSH)on the lung injury induced by N2O4inhalation in mice. Methods:The mice lung injury model was established through exposing 64 mice to N2O4in a 120 L sealed cabinet. Sixty-four ICR male mice were randomly divided into five groups:the control group,the N2O4group,the low,medium and high dose GSH-treated groups,8 mice in control group,14 mice in the other groups. 1.25,2.50 and 3.75 g/kg bw·d GSH were ig administered to mice in GSH-treated groups respectively for 7 days before poisoning,equal volume of normal saline for control group and N2O4group. The GSH-treated groups and the N2O4group were exposed to N2O4in the cabinet 1 hour after ig administration on 7th day. The mice were killed by dislocation,and the activities of SOD and GSH-Px and the content of MDA in lung tissue were measured,and the pathology change of lung tissue was examined. Results:Compared with the control group,the SOD,GSH-Px activities and MDA content in lung tissue of N2O4group were significantly decreased(p<0.01). Compared with the N2O4group,the SOD and GSH-Px activities in lung tissue of low and medium dose GSH-treated groups were significantly increased(p<0.01),the MDA content in lung tissue of low dose GSH-treated groups was significantly increased(p<0.01),the MDA content in lung tissue of medium dose GSH-treated groups was increased(p<0.05).The pathology change of lung tissue showed that the injury in low dose GSH group was lighter than that in N2O4group. Conclusion:GSH has remarkably protective effects against the lung injury induced by N2O4inhalation in mice,and the mechanism may be related to its inhibitory effect against oxidative damage.
reduced glutathione(GSH);dinitrogen tetroxide(N2O4);lung injury;protective effects
2016-02-21
胡杰(1981-),男,博士,讲师,研究方向:军用食品,E-mail:cangqionghj1981@163.com。
李德远(1966-),男,博士,教授,研究方向:军用食品,E-mail:flycangqiong@sina.com。
TS201.4
A
1002-0306(2016)18-0359-04
10.13386/j.issn1002-0306.2016.18.060

