人源醛酮还原酶AKR7A与疾病关系研究进展
张明刚, 杨 军
(西安交通大学 第二附属医院输血科, 西安 710004)
人源醛酮还原酶AKR7A与疾病关系研究进展
张明刚, 杨 军
(西安交通大学 第二附属医院输血科, 西安 710004)
醛酮还原酶超家族(aldo keto reductase superfamily,AKRs)在生物界分布广泛,参与体内醛酮类化合物的清除代谢,使醛或酮上的羰基转化成醇,其活性与多种疾病的发生发展密切相关。AKR7A是一种在生物活化(bioaetivation)及生物解毒(biodetoxifieation)中起到重要作用的酶。AKR7A家族中表达于人体的有AKR7A2和AKR7A3,主要就关于它们的研究进展进行综述。
醛酮还原酶超家族;生物活化;生物解毒
醛酮还原酶(AKR)是烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)依赖型的氧化还原酶超家族的成员之一。醛酮还原酶超家族在生物界分布广泛,且进化上相对保守,主要参与体内醛酮类化合物的清除代谢,使醛或酮上的羰基转化成醇。目前,部分人源性AKR超家族成员已被确认。AKR成员在醛酮类化合物的解毒中起很重要的作用,而且AKR的底物谱很广,包括脂肪族的醛/酮和芳香族的醛/酮等,因此,AKRs成员可能在激素合成、药物代谢、炎症反应、致癌物解毒等生命活动中发挥重要作用。
由于AKR与多种疾病发生发展密切相关,因而,近来已引起了医学研究领域学者的极大兴趣和热切关注。显然,所有关于AKR的研究旨在解决以下问题:1)是否可以将AKR作为并且作为何种肿瘤早期特异性标志物?2) AKR是否可以作为化疗效果评估及化疗选药标志?3)哪些相应AKR抑制物可以作为临床治疗药物?
目前,关于AKR1家族的研究较多,而关于AKR7和KCNA家族的研究和相关文献报道较少。已知AKR7亚家族的AKR7A2和AKR7A3表达于人体,本文旨在对当前关于它们的研究进展及成果进行综述,为该方面进一步研究探讨提供基本参考。
1 AKR超家族的构成和基本结构
1.1 醛酮还原酶超家族的分类
AKRs包括16个家族,其中9个家族含有亚家族。目前发现,AKRs超过了190个成员,其中已确认的人源AKR成员共有15个[1]。
AKR成员广泛分布于原核生物和真核生物。由于进化上相对保守,不同家族成员的氨基酸序列同源性<40%,而同一个家族内的成员之间氨基酸序列同源性则>60%。家族成员的命名,如“AKR7A2”代表AKR家族7亚家族A中成员2。虽然AKR超家族成员在生物界中广泛存在,但是低等生物与哺乳动物之间在基因水平上却有很大的差异。低等生物AKR家族包括AKR2、AKR5和AKR8-13,而AKR1、KCNA、AKR7家族则主要表达于哺乳动物。
1.2 AKR的结构和功能
醛酮还原酶的本质是蛋白酶,需要 NAD(P)H 作为辅酶,AKRs成员具有相似的三维结构和还原羰基基团[2]。AKR单体分子质量在34~37 ku之间,具有320个氨基酸残基,折叠形成典型的(α/β)8桶状结构(8个α-螺旋和8个平行的β-折叠,β-折叠和α-螺旋交替,两者反向平行,见图1)。(α/β)8桶状结构空间结构稳定,在进化上高度保守。AKRs源于同一祖先,彼此间的差异是为了适应结构不同的底物。AKR起催化作用不需要金属离子参与,这与其他32个拥有TIM基序的蛋白酶超家族不同,后者需要金属离子参与才能发挥催化作用[3]。
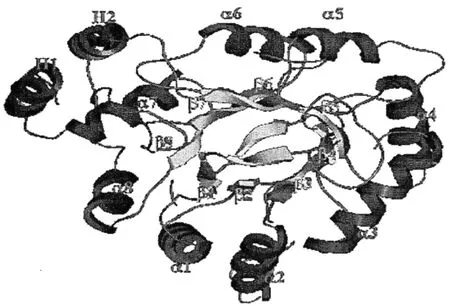
图1 醛酮还原酶的(α/β)8桶状结构[4]Fig 1 (α/β)8 barrel structure of aldo-keto reductases
大多数情况下,醛酮还原酶以单体形式在细胞质中起催化作用。目前所知,只有AKR2,KCNA和AKR7家族的成员为多聚体蛋白[5],但是多聚体结构是否影响酶的活性还不太清楚。
2 人源性AKR成员
目前已知,人源AKR成员共15个,主要来自AKR1、KCNA、AKR7家族,包括AKR1 A1(a1dehyde reductase,醛还原酶);AKR1B1、B10和B15(a1dose reductase,醛糖还原酶);AKR1C1、C2、C3和C4(hydroxysteroid dehydro-genase,羟基类固醇脱氢酶);AKR1D1(steroid5β-reductase,Δ4-3类固醇-5-β-还原酶);AKR1E2(1,5-anhydro-D-fructose reductase,果糖还原酶);KCNA家族(KCNAB1、B2、B3);AKR7A2和A3(aflatoxin aldehyde reductase,黄曲霉毒素还原酶)。编码基因分别位于人类1、3、7、10和17号染色体上。它们作用的底物不尽相同,却具有一定交叠,这可能因为家族成员之间具有较高的序列一致性。研究表明,人源AKRs成员与多种肿瘤发生发展具有相关性,其活性高低与肿瘤的进展及治疗效果密切相关。
3 AKR7A亚家族研究进展
目前发现的AKR7A亚族共有5个成员:表达于大鼠的 AKR7A1 和AKR7A4,表达于小鼠的 AKR7A5,以及表达于人体的AKR7A2 和 AKR7A3[6]。
AKR7A在生物活化及生物解毒中发挥着重要作用,其基因在转录水平上受与氧化胁迫相关的转录因子Nrf2所调控。nrf2是氧化应激基本表达的关键基因,属于CNC亮氨酸拉链转录激活因子家族,与抗氧化反应、抗炎反应及细胞保护作用等有关,受对乙酰氨基酚(aeetaminophen,APAP)及其中间产物N-乙酰基-p-苯基对苯二酮亚胺(N-aeetyl-p-benzoquinoneimine,NAPQI)强烈诱导。有实验研究证实,体外培养的人HepG2细胞(肝癌细胞)用APAP或NAPQI处理后,akr7a3的表达出现了显著上升。在APAP处理的鼠肝细胞中,akr7a1和akr7a5的表达量也显著增多[7]。
3.1akr7a2和akr7a3的定位图(图2、3)

图2 akr7a2定位(http://www.ncbi.nlm.nih.gov/gene/8574)Fig 2 Gene location of akr7a2
CAPZB:capping actin protein of muscle Z-line beta subunit(覆盖肌动蛋白的z线β亚基);PQLC2:包含2个PQ循环重复
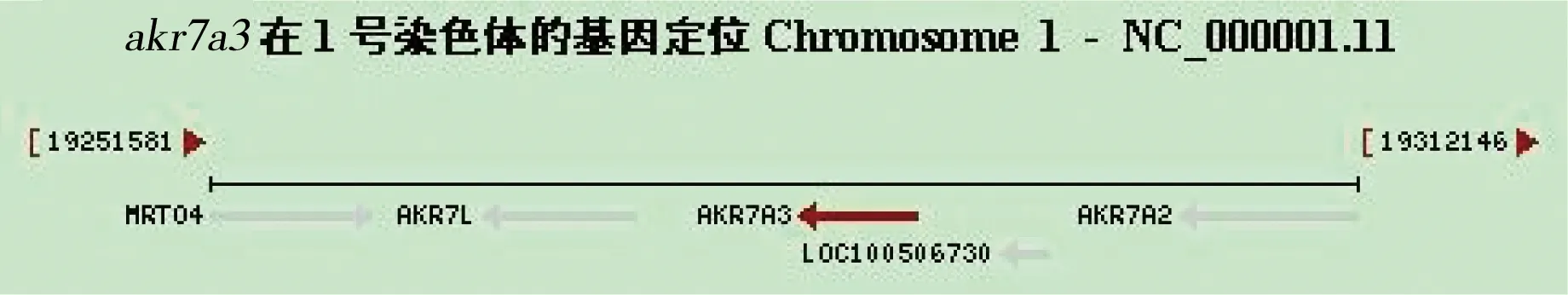
图3 akr7a3定位(http://www.ncbi.nlm.nih.gov/gene/22977)Fig 3 Gene location of akr7a3
MRT04:MRT4 homolog, ribosome maturation factor(MRT4同族体,核糖体成熟因子)
如图2、图3所示,akr7a2、akr7a3基因都定位于1号染色体短臂(1p36.13),GenBank公布的基因序列为:akr7a2为NC_000001.11 (19302708..19312146, complement);akr7a3为NC_000001.11 (19274325..19289346, complement)。
光合色素含量采用乙醇混合液法测定(高俊凤,2006);丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法(Hodges et al.,1999)测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定(Bortolin et al.,2014);可溶性蛋白含量采取考马斯亮蓝染色法测定(高俊凤,2006);超氧自由基(O2-·)产生速率采用盐酸羟胺法测定(高俊凤,2006);脱落酸(ABA)含量采用酶联免疫法(李莉等,2007)结合植物激素脱落酸ELISA检测试剂盒(上海茁彩生物科技有限公司)进行测定。
3.2 AKR7A2的研究
3.2.1 AKR7A2对黄曲霉素的解毒
1993年黄曲霉毒素( aflatoxin,AFT)被世界卫生组织(WHO)的癌症研究机构划定为Ⅰ类致癌物,是一种毒性极强的剧毒物质。天然污染的食物中黄曲霉毒素B1(aflatoxin B1,AFB1)最多,是目前已知最强的化学致癌物之一。AFB1化学结构是由双环呋喃结合在一个含戊醇环的香豆素上,可引起人和啮齿类、鱼类、鸟类等多种动物的肝癌。肝是AFT中毒的目标器官,组织病理学检测常常揭示肝小叶中心出血、坏死和门脉性肝硬化。目前AFT中毒尚无特效治疗药物,因此预防AFT中毒及干预AFT体内吸收与代谢具有重要的意义。
关于AKRs成员之一的人类AKR7家族分子克隆、表达和催化活性的研究证实,人类肝脏中这两种还原酶(AKR7A2、AKR7A3)与老鼠黄曲霉素B1还原酶是同系物,同为黄曲霉毒素还原酶[8]。
AKR7A2 和AKR7A3具有共同的染色体定位,主要功能为体内生物活化及生物解毒。AKR7A2几乎表达于所有正常组织,在AFBl解毒代谢中发挥重要作用[9]。
3.2.2 AKR7A2与人肝癌细胞毒性的对抗
甲基乙二醛(MG),是一种高活性二羰基代谢物,它通过形成DNA和蛋白质加合物,造成肝损害等一些疾病的进展。在实验中,敲除HepG2的akr7a2,进一步研究结果表明,对于HepG2中MG细胞毒性的防护,AKR7A2至少起到了超过50%的作用。实验还表明,MG能够诱导转录因子Nrf2在细胞核的易位,而Nrf2是MG保护性基因表达的关键[10]。
3.2.3 AKR7A2在神经退行性病变的意义
除参与黄曲霉毒素还原外,AKR7A2作为脑中琥珀半醛还原酶的功能已有较多研究[11]。 人源AKR7A2最早在脑中发现,是人类神经母细胞瘤SH-SY5Y细胞中琥珀半醛主要的还原酶, 能还原琥珀半醛为γ-羟基丁酸甲酯[11]。
AKR7A2在人类大脑皮层和海马,主要表达于神经胶质细胞、星形胶质细胞和小神经胶质细胞;在中脑,表达于神经胶质细胞以及水管周围灰质。AKR7A2发挥着潜在的双重作用——细胞保护和神经调节。AKR7A2能保护细胞免受多个有毒醛或酮的毒害,是体内重要的保护酶之一[8, 12]。这就提示我们应该定位和量化其在正常和病态情况下,于中枢神经系统的表达水平。
研究显示,醛糖还原酶(AKR1B家族成员)虽然存在于人类大脑海马神经元,但是在疾病过程中,醛糖还原酶的反应性表达变化仅局限于血液细胞中,在人类大脑皮层和海马中的变化并没有检测到,而AKR7A2对于琥珀半醛的还原活性比AKR1B家族成员高30倍。然而在神经退行性病变中AKR7A2高水平表达的意义目前还不是非常清楚。在人类和啮齿动物,影响中枢神经系统的药物,如GHB以及用于治疗痴呆症的麻醉药物是否会改变AKR7A的表达或定位,有待进一步研究。
3.2.4 AKR7A2对芳香族醛酮的催化
李丹等人采用酶活性实验检测纯化的重组 AKR7A2 蛋白对苯甲醛、双苯醌和反向-2,4-二烯-1,6-己二酮(trans,trans-muconaldehyde,MUC )的底物特异性。结果显示,AKR7A2对具有芳香环结构或双羟基结构的醛或酮具有一定催化活性,对苯甲醛有中等亲和力,对MUC 有较高的亲和力,但对双苯醌的亲和力较低[13]。这为探索苯的体内代谢途径提供了新思路,进一步的研究将有可能对相关职业病的防治等提供重要参考。
3.3 AKR7A3
与AKR7A2在人体内的广泛表达不同,AKR7A3仅在正常肝、肾等组织以及子宫内膜癌和腺癌组织表达。到目前为止,关于AKR7A3有定论的研究是其在黄曲霉素还原中的作用[14]。另外,在实验中,抑制Nrf2后发现akr7a3的表达下降,而肝细胞中高水平表达的AKR7A3显著促进氧化胁迫相关酶Nrf2表达量的上升,细胞的抗氧化力得到增强,这提示Nrf2可以促进akr7a3的表达,AKR7A3与APAP引起的肝毒性的保护显著相关。而且重组人AKR7A3也被证明对AFB1的转化能力强于鼠AKR7A1。
目前关于AKR7A3在癌组织中的表达水平变化研究甚少,这可以作为业内进一步研究的方向。
3.4 AKR7A家族其他成员的研究
AKR7A1:AKR7A1最早被鉴定为黄曲霉毒素 B1 还原酶,之后发现其对多种醛和酮化合物具有催化活性。AKR7A1可以调节AFB1的代谢从而防止大鼠肝癌发生。同样,在经过化疗药物治疗后的大鼠肝脏中,由于AKR7A1的作用,AFBl被转化,降低了肝毒性。实验中敲除大鼠体内肝组织的akr7a1也极大地增强了APAP引起的肝毒性。
关于AKR7A1在老鼠的实验研究中发现,AKR7A1在胎鼠肝脏低表达而在6周龄鼠的肝脏表达水平达到峰值,并且这一变化与性别无关。而成年雄性鼠肝脏AKR7A1表达水平要高于成年雌鼠。在经垂体切除术后,给予血清中持续雌性激素维持,也发现这样会降低AKR7A1的表达。同时研究发现,AKR7A1广泛分布于大鼠的肝、肾、小肠、睾丸等组织,起到抗氧化作用,但在鼻黏膜、骨骼肌、心脏、肾上腺、脑、脾等组织并未发现表达。
动物实验发现,高水平表达的大鼠 AKR7A1 能显著提高 V79-4 细胞对巴豆醛致畸作用的抵抗力[15]。
AKR7A5:AKR7A5除了可以催化醛代谢,还可以显著抑制人体4-羟基壬烯醛(4-HNE)凋亡,而作为人体内重要的氧化应激终产物4-HNE对细胞分化、增殖及凋亡起调控作用,是细胞内重要的信号传导分子[16]。
ROS(reactive oxygen species,活性氧)是机体需氧细胞在代谢过程中产生的一系列活性氧簇(reactive oxygen species,ROS),包括:O2-、H2O2及OH等。高浓度的ROS通过细胞氧化应激反应诱导细胞凋亡甚至导致其坏死。氧化应激反应就是由于ROS产生与清除的失衡。V79-4细胞高水平表达AKR7A5,能够降低过氧化氢和甲萘醌治疗后细胞的ROS水平,表明AKR7A5的重要性在于保护细胞免受氧化应激反应的伤害[17]。
另有实验结果显示,AKR7A5对萘醌的多个衍生物具有底物特异性,但对1,4-萘醌本身无催化活性。结合萘醌和其衍生物的结构差异分析,很可能AKR7A5 对萘醌类化合物的底物特异性与2,5位置的甲基和羟基有关[18]。
4 讨论
AKRs在体内的醛酮转化与解毒过程中发挥着重要作用。AKRs的许多成员均与人类细胞保护、肿瘤形成、诊断及治疗关系密切。各成员在这些过程中所起的作用和机制与各成员的特点和肿瘤的类型有关系。因此,对该家族成员在肿瘤形成、治疗及诊断中所起作用的探讨将具有很重要的意义。研究AKR在人体的生物作用,以及在疾病发展过程中表达水平的变化,尤其是它们在肿瘤发展过程的作用,有希望发现新的临床治疗途径,造福患者。
虽然关于AKRs的研究一直在进行,但是目前我们对于AKRs的了解仍然存在很多未知区域。尤其是关于AKR7A亚家族的研究相对较少,而且有很多实验结果只是一家之言,有待进一步重复与验证,更有待于进一步总结与探讨。对于AKRs与人类疾病的关系,除研究较早的醛糖还原酶与糖尿病相关,AKR7A2、AKR7A3在黄曲霉素还原中的作用比较明确外,其余研究还尚未有明确结论。那么,除此之外,AKRs在疾病的发生发展中扮演了什么样的角色?比如人体广泛分布的AKR7A2在肿瘤发生发展中表达变化如何?而正常分布范围较窄的AKR7A3在肿瘤发展过程中又有怎样的表达变化?它们是否可以作为监测肿瘤发展以及监测药物疗效的指标?AKR7A2与AKR7A3在人体的表达与分布是否像AKR7A1在动物实验中所反映的与性别相关呢?这些问题都值得进一步研究探讨。
[1]PENNING T M. The aldo-keto reductases(AKRs):Overview[J]. Chemico-Biological Interactions, 2015, 234:236-246.
[2]JEZ J M, BENNETT M J, SCHLEGEL B P, et al. Comparative anatomy of the aldo-keto reductase superfamily[J]. Biochem Journal, 1997, 326(Pt3):625-636.
[3]MINDNICH R D, PENNING T M. Aldo-keto reductase (AKR) superfamily: genomics and annotation[J]. Human Genomics, 2009, 3(4):362-370.
[4]SIMPSON P J, TANTITADAPITAK C, REED A M, et al. Characterization of two novel aldo-keto reductases from Arabidopsis:expression patterns, broad substrate specificity, and an open active-site structuresuggest a role in toxicant metabolism following stress[J]. Journal of Molecular Biology, 2009, 392(2):465-480.
[5]GULBIS J M, MANN S, MACKINNON R. Structure of a voltage-dependent K+channel βsubunit[J]. Cell, 1999, 97(7):943-952.
[6]BARSKI O A, TIPPARAJU S M, BHATNAGAR A. The aldo-keto reductase superfamily and its role in drug metabolism and detoxification[J]. Drug Metab Rev, 2008, 40(4):553-624.
[7]AHMED M M, WANG T, LUO Y, et al. Aldo-keto reductase-7A protects liver cells and tissues from acetaminophen-induced oxidative stress and hepatotoxicity[J]. Hepatology, 2011, 54(4):1322-1332.
[8]IRELAND L S, HARRISON D J, NEAL G E, et al. Molecular cloning, expression and catalytic activity of a human AKR7 member of the aldo-keto reductase superfamily: evidence that the major 2-carboxybenzaldehyde reductase from human liver is a homologue of rat aflatoxin B1-aldehyde reductase[J]. The Biochemical Journal, 1998, 332(Pt1):21-34.
[9]KNIGHT L P, PRIMIANO T, GROOPMAN J D, et al. cDNA cloning,expression and activity of a second human aflatoxin B1-metabolizing member of the aldo-keto reductase superfamily,AKR7A3[J]. Carcinogenesis, 1999, 20(7):1215-1223.
[10]LI D, MA S, ELLIS E M. Nrf2-mediated adaptive response to methyl glyoxal in HepG2 cells involves the induction of AKR7A2[J]. Chemico-Biological Interactions, 2015, 234:366-371.
[11]LYON R C, JOHNSTON S M, WATSON D G, et al. Synthesis and catabolism of gamma-hydroxybutyrate in SH-SY5Y human neuroblastoma cells:role ofthe aldo-keto reductase AKR7A2[J]. J Biol Chem, 2007, 282(36):25986-25992.
[12]LI D, FERRARI M, ELLIS E M. Human aldo-keto reductase AKR7A2 protects against the cytotoxicity and mutagenicity of reactive aldehydes and lowers intracellular reactive oxygen species in hamster V79-4 cells[J]. Chem Biol Interact, 2012, 195(1):25-34.
[13]李丹,初阳,刘雅茹,等. 人源醛酮还原酶 7A2 融合蛋白的纯化及其对苯代谢产物的催化活性[J]. 中国医科大学学报, 2013, 42(1):52-55.
[14]BODREDDIGARI S, JONES L K, EGNER P A, et al. Protection against aflatoxin B1-induced cytotoxicity by expression of the cloned aflatoxin B1-aldehyde reductases rat AKR7A1 and human AKR7A3[J]. Chemical Research in Toxicology, 2008, 21(5):1134-1142.
[15]李丹,张岐山,初阳. 过表达醛酮还原酶AKR7A1对巴豆醛致畸作用的影响[J]. 细胞与分子免疫学杂志,2012,28(10):1013-1015.
[16]李丹,马东初,张歧山,等. 醛酮还原酶AKR7A1在活性醛引起的V79-4细胞损伤中的作用[J].中国医科大学学报,2013,42(5):408-411.
[17]LI D, ELLIS E M. Aldo-keto reductase 7A5 (AKR7A5) attenuates oxidative stress and reactive aldehyde toxicity in V79-4 cells[J]. Toxicology in Vitro, 2014(28):707-714.
[18]李丹,刘雅茹,张岐山,等. 醛酮还原酶AKR7A5蛋白的纯化及其对萘醌类化合物的底物特异性研究[J]. 细胞与分子免疫学杂志,2012,28(8):825-827.
Research progress in relationship between AKR7A and disease
ZHANG Ming-gang, YANG Jun
(Department of Blood Transfusion, The Second Hospital of Xi’an Jiatong University, Xi’an 710004, China)
AKRs are widely distributed in nature,participates in the clear metabolism in the body and make the aldehyde or ketone carbonyl convert into alcohol, and their activityies are closely related to a wide variety of tumor. AKR7A is an enzyme,plays an important role in bioaetivation and biodetoxifieation.AKR7A2 and AKR7A3 are two members of AKR7 and express in human body. This article mainly reviewed the progress of the research.
AKRs; bioaetivation; biodetoxifieation
2016-02-04;
2016-03-14
国家自然科学基金(NSFC30872403);教育部新世纪优秀人才计划(NCET-10-0647)
张明刚,硕士研究生,专业方向为病理与病理生理学,E-mail:zmglang@163.com
杨 军,博士,教授,主要研究方向为肿瘤病理学,E-mail:yangjundr@163.com
Q55
文章编号2095-1736(2016)05-0090-04
doi∶10.3969/j.issn.2095-1736.2016.05.090

