饲料中添加Fortilin蛋白对凡纳滨对虾免疫反应和抗白斑综合征病毒感染的影响❋
耿小雪, 周 怡, 徐 玮, 张文兵, 麦康森
(中国海洋大学 水产学院,水产动物营养与饲料农业部重点实验室,海水养殖教育部重点实验室,山东 青岛 266003)
饲料中添加Fortilin蛋白对凡纳滨对虾免疫反应和抗白斑综合征病毒感染的影响❋
耿小雪, 周怡, 徐玮, 张文兵❋❋, 麦康森
(中国海洋大学 水产学院,水产动物营养与饲料农业部重点实验室,海水养殖教育部重点实验室,山东 青岛 266003)
为研究饲料中添加毕赤酵母表达的翻译控制肿瘤蛋白fortilin对凡纳滨对虾免疫反应和抗白斑综合征病毒(WSSV)感染能力的影响。以酵母表达上清冻干粉和酵母培养物冻干粉2种形式在基础饲料中分别添加100mg/kg的重组fortilin蛋白和空质粒重组蛋白,制成4种实验饲料,以基础饲料作为空白对照,设计5个实验组:基础饲料组(C)、酵母表达上清冻干粉组(P-1)、酵母培养物冻干粉组(P-2)、fortilin酵母上清冻干粉组(F-1)和fortilin酵母培养冻干粉组(F-2)。用5种饲料分别饲喂初始体重(4.87±0.26)g的凡纳滨对虾20d,随后进行WSSV攻毒实验。养殖实验表明,F-1组和F-2组中凡纳滨对虾血淋巴的血细胞数(THC)、呼吸爆发活性(RB)和血清酚氧化酶活性(PO)显著高于C组(P<0.05)。F-2组的THC、RB、PO和超氧化物歧化酶(SOD)活性均显著高于P-2组(P<0.05)。F-1组的PO和一氧化氮合酶(NOS)活性显著高于P-1组(P<0.05)。攻毒实验显示,饲料中添加fortilin蛋白显著降低了凡纳滨对虾的死亡率(P<0.05):F-1和F-2组的累计死亡率分别为19.2%和15.4%,P-1和P-2组的累计死亡率分别为56.0%和47.8%,C组累计死亡率为84.6%。研究结果表明,凡纳滨对虾摄食添加重组fortilin蛋白的饲料后,对虾的免疫力和抗WSSV感染的能力显著增强。
凡纳滨对虾;fortilin蛋白;白斑综合征病毒;免疫;饲料
引用格式:耿小雪, 周怡, 徐玮, 等. 饲料中添加fortilin蛋白对凡纳滨对虾免疫反应和抗白斑综合征病毒感染的影响[J].中国海洋大学学报(自然科学版), 2016, 46(10): 32-38.
GENG Xiao-Xue, ZHOU Yi, XU Wei, et al. Effect of dietary fortilin on immune response of white shrimpLitopenaeusvannameiand its resistance against white spot syndrome virus infection [J]. Periodical of Ocean University of China, 2016, 46(10): 32-38.
凡纳滨对虾(Litopenaeusvannamei)又称南美白对虾,是目前中国养殖产量最高的对虾品种。2013年中国凡纳滨对虾养殖总产量达到142.99万t,占全国虾养殖总产量的51.4%[1]。但是,白斑综合征病毒(WSSV)病的频繁发生给对虾养殖造成重大经济损失,这是限制凡纳滨对虾养殖业持续稳定发展的主要因素之一[2]。
Fortilin蛋白也称翻译控制肿瘤蛋白(Translationally controlled tumor protein,TCTP),是一种广泛表达、高度保守的真核蛋白,最初在小鼠艾氏腹水肿瘤细胞和红白血病细胞中发现。该蛋白的mRNA是以一种mRNA-蛋白复合体的形式存在,表达量在肿瘤细胞中高于正常细胞,并且它的表达还在翻译水平上受到高度的调控[3-4]。在哺乳动物中,TCTP具有钙离子结合功能[5]、微管蛋白结合功能[6]、参与细胞应激及细胞凋亡的功能[7]等。动物界中fortilin氨基酸序列相当保守[7],对虾fortilin与人类fortilin有64%的氨基酸是一致的。目前,研究者们已经克隆到多种对虾的fortilin/TCTP基因[8-10],并指出fortilin参与对虾抗白斑综合征病毒(White spot syndrome virus,WSSV)的反应,增强对虾抗WSSV感染的能力[11]。斑节对虾肌肉注射WSSV后,对虾的Pm-fortilin基因表达量上调[8],给斑节对虾注射重组Pm-fortilin蛋白后,进行WSSV攻毒,存活率高达 80%~100%,且通过巢式PCR检测发现,濒死对虾血淋巴的WSSV水平比存活对虾的高很多[12]。Pm-fortilin在昆虫细胞系中的过表达研究发现fortilin可以通过信号通路和转录控制来干扰WSSV的繁殖[11],但是具体的机制还不清楚。凡纳滨对虾的fortilin/TCTP基因也早已被克隆提交到NCBI中(GenBank: EU305625.1),但关于该基因所表达的蛋白抗WSSV感染的研究却不多。
近年来,关于抗WSSV蛋白疫苗和抗病毒蛋白的研究很多[13-14],这些都归功于重组蛋白体外表达的简便性和经济性。毕赤酵母表达系统是一种高效、安全的真核表达系统,具有表达外源蛋白用于规模化生产的优势。在对虾的规模化集约养殖过程中,难以通过注射的方式为对虾提供fortilin蛋白来达到抗病的目的。投喂饲料是对虾养殖的日常行为,以饲料为载体使养殖动物口服活性制剂,具有使用范围广、养殖成本低、可行性好等优点。本研究拟探讨投喂含有毕赤酵母表达的fortilin蛋白的饲料,对凡纳滨对虾免疫反应和抗病力的影响,以期为fortilin蛋白在凡纳滨对虾配合饲料中的使用提供基础数据。
1 材料与方法
1.1 重组蛋白干粉的制备
参照周怡等的方法[15],得到重组酵母X33/pGAPZαA-Fortilin和空载酵母X33/pGAPZαA。简单来说,根据Genbank中fortilin的基因序列设计引物,PCR扩增得到凡纳滨对虾fortilin目的基因片段,将fortilin基因连接到表达载体pGAPZαA中,获得酵母重组表达载体pGAPZαA-Fortilin,以pGAPZαA空载体作为对照,转化X-33毕赤酵母细胞。对阳性重组酵母表达产物的上清液进行聚丙烯酰胺凝胶电泳分析和质谱分析,来证明毕赤酵母能够成功表达fortilin蛋白。
取X-33/pGAPZαA和X-33/pGAPZαA-Fortilin菌液分别接种于1L的YPD培养基(1%酵母提取物,2%蛋白胨,2%葡萄糖)中,在温度30℃和转速220r/min条件下振荡培养约72h。培养结束后,取出500mL收集酵母培养物,剩余的500mL酵母培养物在温度为4℃和转速为10000r/min条件下离心3min后,收集酵母表达上清液。随后将酵母培养物和酵母表达上清液均于液氮中速冻后储存在-80℃冰箱,然后冷冻干燥成干粉。
1.2 实验饲料的制作
饲料中蛋白源主要是白鱼粉、豆粕和花生粕,脂肪源主要是鱼油和大豆卵磷脂,具体基础饲料配方见表1。在基础饲料中分别添加pGAPZαA-fortilin重组酵母的表达上清干粉和酵母培养物干粉,添加浓度为100mg/kg。同时,制作pGAPZαA重组酵母的上清干粉和酵母培养物干粉添加的饲料组,添加浓度也为100mg/kg。具体实验饲料设计见表2。

表1 基础饲料配方Table 1 Ingredients of the basal diet
注:1白鱼粉White fish meal:粗蛋白Crude protein 67.5%,粗脂肪Crude lipid 7.8%,均为干物质基础Dry weight basis。
2维生素预混料Vitamin premix(mg/kg):盐酸硫胺素Thiamin 90mg;核黄素Riboflavin 150mg;盐酸吡哆醇Pyridoxine HCl 210mg;VB120.03mg;VK350mg;肌醇Inositol 600mg;泛酸钙Calcium pantothenate 150mg;尼克酸Niacin acid 600mg;叶酸Folic acid 15mg;生物素Biotin 1.20mg;醋酸视黄醇Retinol acetate 32mg;VD312mg;VE 120mg;乙氧基喹啉Ethoxyquin 150mg。
3矿物质预混料Mineral premix(mg/kg) :KI 0.8mg;CoCl2·6H2O(1%) 40mg;CuSO4·5H2O 100mg;FeSO4·7H2O 450mg;ZnSO4·H2O 250mg;MnSO4·H2O 60mg;MgSO4·7H2O 4000mg;Ca(H2PO4)2·H2O 10600mg。
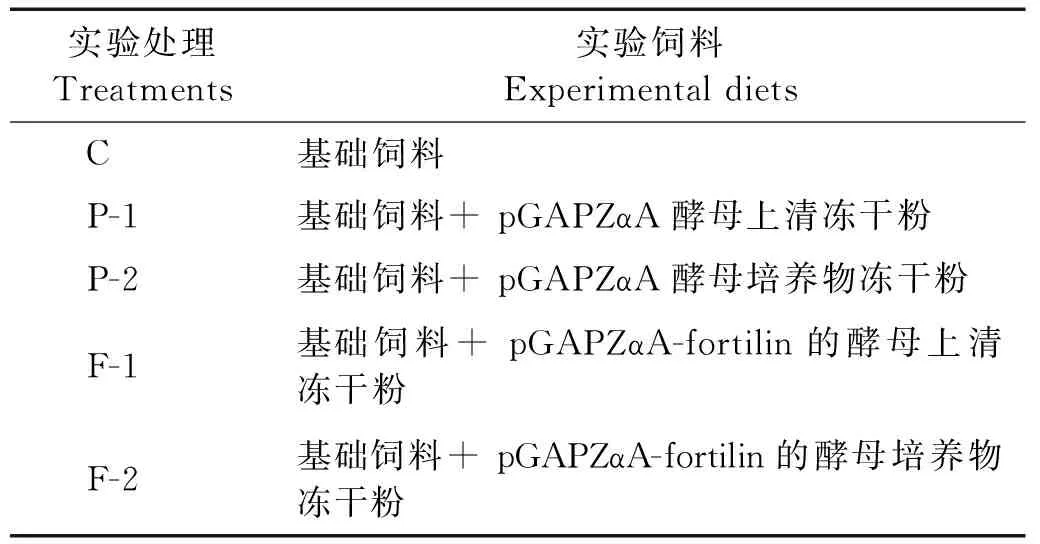
表2 各实验处理饲料组成Table 2 Formulation of the experimental diets
1.3 实验动物与饲养管理
实验用凡纳滨对虾为同一批孵化的虾苗,购于青岛宝荣水产科技发展有限公司。正式实验前,虾苗放于室内海水系统中暂养,期间饲喂基础饲料。暂养10d后,挑选个体大小均匀的健康对虾(体长5~6cm,体重(4.87±0.26)g)随机分配到中国海洋大学水产馆室内海水养殖系统中的15只容积为50L的玻璃缸中进行养殖实验。共设置5个处理,每个处理3个重复,每个重复12尾虾。Bai等给凡纳滨对虾连续投喂β-葡聚糖或甘草酸等单一的免疫增强剂,发现作用有效期为20d左右,更长的投喂会造成对虾免疫疲劳[16],因此本养殖实验持续20d。初始投饵量为对虾体重的5%~10%,然后根据对虾的实际摄食情况对投饵量进行适当的调整。每天分别在6:00、11:00和18:00喂饲对虾,投喂2h后吸去残饵和粪便。在养殖过程中需要连续充气,海水盐度为30~32,海水温度控制在24~28℃,pH为7.8~8.2,水中溶解氧不低于6.5mg/L。
1.4 攻毒实验
养殖实验结束后进行WSSV攻毒实验。参照Xie等的方法[17]提取病毒并做了一定得调整,取WSSV攻毒后病虾的血淋巴及鳃,鳃组织匀浆液和血淋巴离心后收集上清,将该上清在4℃条件下,30 000g离心30min,收集病毒颗粒沉淀,用PBS缓冲液(0.01mol/L Na2HPO4,0.01mol/L NaH2PO4,0.15mol/L NaCl,pH=7.2)重悬,即得到WSSV病毒的母液,于-80℃保存。用PBS缓冲液稀释病毒为10-1~10-6,预实验确定合适WSSV病毒攻毒浓度为1×10-5,通过肌肉注射感染凡纳滨对虾,每尾对虾注射50μL病毒稀释液。攻毒后继续投喂相应的实验饲料(C、P-1、P-2、F-1和F-2),对应的攻毒实验组分别是Control-WSSV、P-1、P-2、F-1和F-2,持续喂养10 d。同时以注射等量PBS的实验组(Control-PBS)作为阴性对照,投喂基础饲料。攻毒实验期间日常管理与养殖实验期间相同。攻毒实验结束后,对凡纳滨对虾的累计死亡率进行统计。
累积死亡率=Dt/D0× 100%。
式中D0和Dt分别为攻毒实验对虾初始尾数和累计死亡尾数。
1.5 对虾样品采集与分析1.5.1 对虾血淋巴的采集养殖实验结束后,从每个重复中随机取出3尾对虾,经过75%的酒精消毒后,用无菌注射器自腹血窦进行取血。吸取对虾血淋巴抗凝剂(10mmol/L EDTA·Na2,450mmol/L NaCl,10mmol/L KCl,10mmol/L HEPES,pH=7.3,调节渗透压至850mOsm/kg)[18]至抗凝剂与血淋巴的体积比为2∶1,混匀后即得到抗凝血。血细胞计数和呼吸爆发活性的测定用抗凝血,而酚氧化酶活力、总超氧化物歧化酶活力和一氧化氮合酶的活力用经离心后收集的血清。
1.5.2 对虾免疫指标的测定血细胞计数:取20μL抗凝血滴在血球计数板上,在普通光学显微镜(×200)下直接计数,然后折算出每毫升对虾血淋巴中血细胞的数量。
酚氧化酶(PO)活性的测定:血清PO活性的测定参考 Hernández-López 等的方法[19],以实验条件下每分钟每毫升血淋巴上清液对应的吸光值(492nm)增加0.001为一个酶活力单位。
呼吸爆发(RB)活性的测定:参考 Song 等的方法[20],以实验条件下每106个血淋巴细胞对应的吸光值(630nm)来表示RB活性。
总超氧化物歧化酶(T-SOD)活性的测定:血清T-SOD活力的测定采用黄嘌呤氧化酶法,使用南京建成试剂盒测定。SOD活性定义为每毫升反应液中SOD抑制率达到50%时所对应的SOD量为一个SOD活力单位。
一氧化氮合酶(NOS)活性的测定:血清NOS活力的测定采用化学比色法,使用南京建成试剂盒测定,NOS活力定义为每毫升样品每分钟生成1nmol一氧化氮为一个酶活力单位。
1.6 数据统计分析
用 SPSS 统计软件对实验各处理的数据进行单因素方差分析,当不同处理之间存在显著差异(P<0.05)时,采用 Tukey 检验进行多重比较。所有数值用平均值±标准误表示。
2 实验结果
2.1 重组酵母表达上清SDS-PAGE检测
如图1所示,经考马斯亮蓝R-250染色后,与空载质粒pGAPZαA的酵母发酵上清相比,重组酵母pGAPZαA-Fortilin发酵上清明显存在大小约为30kDa的目的蛋白条带(箭头标识)。质谱分析结果表明得到了fortilin肽段序列(见表3),说明fortilin蛋白成功分泌到发酵上清中。
综上所述,通过详细介绍了建筑室内装饰装修设计当中绿色环保设计理念的应用要点,本建筑工程室内装饰装修施工已经顺利完成,经过检验之后,建筑室内装饰装修各项指标满足相关要求,室内装修质量较高,说明以上措施可行,可以为相关工程提供良好借鉴。

(泳道1:蛋白质分子量标准(97.2、66.4、44.3、29.0和20.1kDa);泳道2~4:X-33/pGAPZαA-Fortilin;泳道5:X-33/pGAPZαA。Lane1: Protein molecular weight markers (97.2、66.4、44.3、29.0和20.1kDa);Lane 2~4:X-33/pGAPZαA-Fortilin;Lane 5:X-33/pGAPZαA.)

图1 重组酵母发酵上清SDS-PAGE电泳Fig.1 SDS-PAGE analysis of recombinant protein expression in P. Pastoris表3 Fortilin蛋白质谱检测Mascot分析结果Table 3 Mascot Search Results of MS/MS about Fortilin
2.2 血细胞计数
由表4可知,各处理组间血细胞数量有显著差异(P<0.05),所有酵母培养物及上清处理组(P-1、P-2、F-1和F-2)血细胞数均显著高于基础饲料组(C)。F-2组血细胞数(2.48×107cell/mL)显著高于P-2和P-1组(P<0.05)。F-1组血细胞数也显著高于P-2组(P<0.05),而其它组间的血细胞数没有显著差异。
2.3 酚氧化酶活性
由表4可知, F-2和F-1组酚氧化酶活性显著高于C、P-2和P-1组(P<0.05),其他各组之间均无显著差异。
2.4 呼吸爆发活性
由表4可知, F-2和F-1组呼吸爆发活性显著高于C组,并且F-2组呼吸爆发活性也显著高于P-2和P-1组(P<0.05);P-2和P-1组与C组却无显著性差异(P>0.05);其它酵母培养物和上清处理组间的呼吸爆发活性没有显著差异。
2.5 超氧化物歧化酶活性
由表4可知, F-2和F-1组超氧化物歧化酶活性显著高于P-2组(P<0.05),其他各组之间没有出现显著性差异。
由表4可知,F-1组一氧化氮合酶活性显著高于其他各个处理组(P-1,P-2,F-2和C)(P<0.05),其他各组之间均无显著性差异。

表4 饲料中添加fortilin对凡纳滨对虾免疫反应的影响(平均值±标准误)Table 4 Effects of dietary fortilin on the immune responses of L. vannamei (Mean ± SE)
注:表中同一列数据中具有相同上标字母表示差异不显著(P>0.05)。
Note:Means in each column with the same superscripts have no significant differences (P>0.05).
2.7 攻毒结果
病毒感染实验的数据及分析结果见图2,表明基础饲料中添加重组蛋白pGAPZαA-fortilin提高了WSSV攻毒后凡纳滨对虾的存活率。从图中可知,凡纳滨对虾攻毒后5~8 d死亡率大幅度增加,之后趋于稳定状态。与基础饲料攻毒组(Control-WSSV)相比,给凡纳滨对虾喂食含有pGAPZαA-fortilin重组蛋白的饲料后,可显著提高其抵抗WSSV侵染的能力(P<0.05),其中F-1和F-2组的累计死亡率分别为19.2%和15.4%; P-2组同样显著提高了对虾病毒感染后的存活率(P<0.05),而P-1组却无显著性差异,P-1和P-2的累计死亡率分别为56.0%和47.8%,然而基础饲料组(Control-WSSV)攻毒后累计死亡率高达84.6%。F-1组的累计死亡率显著性低于P-1组(P<0.05),而F-2组的累计死亡率虽然低于P-2组,却未出现显著性差异,说明fortilin蛋白对提高对虾抗WSSV侵染具有重要作用。
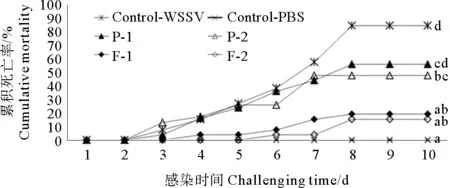
图2 WSSV攻毒后凡纳滨对虾的累积死亡率Fig.2 Cumulative mortality of shrimp challenged with WSSV
3 讨论
研究表明,对虾血细胞数与虾体健康状况密切相关。葡聚糖、脂多糖、灭活哈维氏弧菌和灭活鳗弧菌等免疫增强剂能显著提高对虾的总血细胞数量[21-22]。本研究饲料中添加100mg/kg的fortilin重组蛋白显著提高了凡纳滨对虾血细胞数,表明fortilin重组蛋白可能通过提高对虾血细胞数量来调节对虾细胞免疫。本实验同时还发现与基础饲料C组相比,P-1和P-2组的血细胞数显著增高,而F-1组的血细胞数虽然高于P-1组,但并未出现显著性的差异。这说明毕赤酵母本身也是一种免疫增强剂,这点在Burgents等的研究中也有体现[23]。
酚氧化酶活性的高低反映着对虾的免疫状态[24],病原体的入侵可以激活虾体的酚氧化酶原系统,从而杀死包括病毒在内的病原微生物,从而达到免疫的效果[25-27]。本研究中fortilin重组蛋白能显著提高凡纳滨对虾血清中PO活性,该结果与血细胞数的相符,均说明对虾血清PO活性的增强以及血细胞数目的增多可以看作是对虾免疫力增强的体现。而且无论是发酵上清组还是酵母培养物组,含有fortilin蛋白的实验组的PO活性均显著高于空载组,而P-1和P-2组的PO活性与空白对照组无显著性差异,说明fortilin蛋白作为外源物激活了酚氧化酶活性。
当对虾等甲壳动物受到外界病原刺激时,吞噬细胞会激活磷酸己糖支路代谢,从而引发呼吸爆发,产生大量活性氧,继而杀灭被吞噬的病原,这是吞噬作用消除入侵机体的病原的重要机制[28]。本研究发现fortilin重组蛋白能显著提高凡纳滨对虾血细胞的呼吸爆发活性,说明fortilin激活了呼吸爆发途径,但具体机制尚不清楚。这与周怡等进行的对虾血细胞体外培养实验证明fortilin不能激活活性氧生成的结果不一致[21],这可能是因为体外细胞实验与体内实际情况存在差异。呼吸爆发途径的激活会产生活性氧,但是大量活性氧对机体本身也会造成一定的氧化危害[29],超氧化物歧化酶可催化活性氧生成对机体无害的物质,从而消除活性氧对机体细胞的直接毒害[30],以达到增强对虾免疫力的目的。本研究发现fortilin重组蛋白可以提高凡纳滨对虾血清超氧化物歧化酶活性,但差异不显著,猜测fortilin蛋白提高RO活性产生的活性氧并未对机体产生损伤,因此不需要提高SOD活性消除活性氧来保护机体细胞,这可能是由于fortilin蛋白虽然是外源物质,但是并不像病原物那样引起机体强烈免疫应急 。但是空载酵母培养物组的SOD活性却显著低于fortilin的2个实验组,是否说明fortilin在提高SOD活性方面也具有重要作用,还需进一步确认。一氧化氮合酶系统在对虾疾病感染的早期起到一定防御作用[31],NOS也是对虾免疫相关的重要活性酶。本实验中,fortilin重组蛋白可以提高NOS的活性,特别是fortilin冻干上清组,显著高于基础饲料组和空载实验组,说明fortilin蛋白可以通过作用于一氧化氮合酶系统来提高对虾的免疫能力。
WSSV注射感染的实验结果与酶活免疫反应的结果一致,饲料中添加100mg/kg的fortilin重组蛋白增强了凡纳滨对虾的免疫力,提高了WSSV感染后对凡纳滨对虾的存活率。Tonganunt等给斑节对虾饲喂含原核表达的Pm-fortilin蛋白的饲料,WSSV攻毒后存活率仅有10%[10],本实验中F-1组凡纳滨对虾的存活率高达80.8%,可能因为实验中使用的是未纯化重组蛋白,酵母本身具有一定的免疫增强及抗病作用,且酵母表达蛋白的活性要优于原核表达蛋白,同时也可能与实验对虾品种的不同及投喂周期长短的不同有关。Sinthujaroen等研究发现,给凡纳滨对虾饲喂3 d含1%和5%毕赤酵母表达的Pm-fortilin重组蛋白饲料后,进行WSSV注射攻毒,最终存活率分别为66.7%和91.7%[32]。本实验也得到了相似的结果,饲喂F-2组的存活率为84.6%,与5%的Pm-fortilin组的91.7%的存活率相比,本研究中fortilin组的存活率稍低。究其原因,可能是由于fortilin蛋白的来源不同,或饲料中fortilin的添加量不同而造成,具体原因尚有待进一步研究。从本研究中可知,对虾累计死亡率:F-2 总的来说,饲料中添加100 mg/kg的重组fortilin蛋白可以通过提高总血细胞数、酚氧化酶活性和呼吸爆发活力以提高凡纳滨对虾的免疫力,同时提高其WSSV感染后的存活率。然而,凡纳滨对虾饲料中重组fortilin蛋白的最适使用量尚待进一步研究。 [1]农业部渔业局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2014: 28-30. Fisheries Service of Ministry of Agriculture. China Fishery Statistical Yearbook [M]. Beijing: China Agriculture Press, 2014: 28-30. [2]Escobedo-Bonilla C M. Application of RNA interference (RNAi) against viral infections in shrimp: a review[J]. Antivirals & Antiretrovirals, 2011, 9: 2. [3]Yenofsky R, Cereghini S, Krowczynska A, et al. Regulation of mRNA utilization in mouse erythroleukemia cells induced to differentiate by exposure to dimethyl sulfoxide [J]. Molecular and Cellular Biology, 1983, 3(7): 1197-1203. [4]Bohm H, Benndorf R, Gaestel M, et al. The growth-related protein P23 of the Ehrlich ascites tumor: translational control, cloning and primary structure [J]. Biochemistry International, 1989, 19(2): 277-286. [5]Xu A, Bellamy A R, Taylor J A. Expression of translationally controlled tumor protein is regulated by calcium at both the transcriptional and post transcriptional level [J].Biochemistry Journal, 1999, 342(3): 683-689. [6]Gachet Y, Tournier S, Lee M, et al. The growth-related, translationally controlled protein P23 has properties of a tubulin binding protein an associates transiently with microtubules during the cell cycle [J]. Journal of Cell Science, 1999, 112: 1257-1271. [7]Bommer U A, Thiele B J. The translationally controlled tumor protein (TCTP) [J]. International Journal of Biochemistry and Cell Biology, 2004, 36(3): 379-385. [8]Bangrak P, Graidist P, Chotigeat W, et al. Molecular cloning and expression of a mammalian homologue of a translationally controlled tumor protein (TCTP) gene fromPenaeusmonodonshrimp [J]. Journal of Biotechnology, 2004, 108(3): 219-226. [9]Chen D, He N, Lei K, et al. Genomic organization of the translationally controlled tumor protein (TCTP) gene from shrimpMarsupenaeusjaponicas[J]. Molecular Biology Reports, 2009, 36(5): 1135-1140. [10]Wang S, Zhao X F, Wang J X. Molecular cloning and characterization of the translationally controlled tumor protein fromFenneropenaeuschinensis[J]. Molecular Biology Reports, 2009, 36(7): 1683-1693. [11]Nupan B, Phongdara A, Saengsakda M, et al. Shrimp Pm-fortilin inhibits the expression of early and late genes of white spot syndrome virus (WSSV) in an insect cell model[J]. Developmental & Comparative Immunology, 2011, 35(4): 469-475. [12]Tonganunt M, Nupan B, Saengsakda M, et al. The role of Pm-fortilin in protecting shrimp from white spot syndrome virus (WSSV) infection [J]. Fish & Shellfish Immunology, 2008, 25 (5): 633-637. [13]Musthaq S K S, Kwang J. Evolution of specific immunity in shrimp-A vaccination perspective against white spot syndrome virus[J]. Developmental & Comparative Immunology, 2014, 48 (2): 342-353. [14]Pathan M, Gireesh-Babu P, Pavan-Kumar A, et al. In vivo therapeutic efficacy of recombinantPenaeusmonodonantiviral protein (rPmAV) administered in three different forms to WSSV infectedPenaeusmonodon[J]. Aquaculture, 2013, 376-379: 64-67. [15]周怡, 张文兵, 麦康森. 凡纳滨对虾翻译控制肿瘤蛋白Fortilin的毕赤酵母表达及其对血细胞免疫反应的影响[J]. 中国海洋大学学报(自然科学版), 2012, 42(1-2): 54-58. Zhou Y, Zhang W B, Mai K S. Secretion expression of fortilin in yeastPichiapastorisand its effects on immune responses of hemocytes in white shrimpLitopenaeusvannamei[J]. Journal of Ocean University of China,2012,42(1-2): 54-58. [16]Bai N, Zhang W B, Mai K S, et al. Effects of discontinuous administration of β-glucan and glycyrrhizin on the growth and immunity of white shrimpLitopenaeusvannamei[J]. Aquaculture, 2010, 306(1-4): 218-224. [17]Xie X X, Li H Y, Xu L M, et al. A simple and efficient method for purification of intact white spot syndrome virus (WSSV) viral particles [J]. Virus Research, 2005, 108(1): 63-67. [18]Vargas-Albores F, Guzmán M A, Ochoa J L. An anticoagulant solution for haemolymph collection and prophenoloxidase studies of penaeid shrimp (Penaeuscaliforniensis) [J]. Comparative Biochemistry and Physiology Part A: Physiology, 1993, 106(2): 299-303. [19]Hernández-López J, Gollas-Galván T, Vargas-Albores F. Activation of the prophenoloxidase system of the brown shrimp (Penaeuscaliforniensis) Holmes[J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1996, 113(1): 61-66. [20]Song Y L, Hsieh Y T. Immunostimplation of tiger shrimp (Penaeusmonodon) hemocytes for generation of microbicidal substances: analysis of reactive oxygen species[J]. Developmental & Comparative Immunology, 1994, 18(3): 201-209. [21]姜令绪, 潘鲁青, 肖国强. 氨氮对凡纳对虾免疫指标的影响[J]. 中国水产科学, 2004, 11(6): 537-541. Jiang L X, Pan L Q, Xiao G Q. Effects of ammonia-N on immune parameters of white shrimpLitopenaeusvannamei[J]. Journal of Fishery Sciences of China, 2004, 11(6): 537-541. [22]汪小锋,樊廷俊,丛日山,等.几种免疫促进剂对中国对虾血细胞数量、形态结构以及酚氧化酶产量和活性的影响[J].水产学报, 2005, 29(1): 66-73. Wang X F, Fan T J, Cong R S, et al. Effects of several immunostimulants on the number, ultrastructure of hemocytes and the yield, activities of phenoloxidase inPenaeuschinensis[J]. Journal of Fisheries of China, 2005, 29(1): 66-73. [23]Burgents J E, Burnett K G, Burnett L E. Disease resistance of Pacific white shrimp,Litopenaeusvannamei, following the dietary administration of a yeast culture food supplement[J]. Aquaculture, 2004, 231(1-4): 1-8. [24]Wang Y C, Chang P S, Chen H Y. Tissue distribution of prophenoloxidase transcript in the Pacific white shrimp(Litopenaeusvannamei)[J]. Fish & Shellfish Immunology, 2006, 20(3): 414-418. [25]Dziarski R. Peptidoglycan recognition proteins (PGRPs) [J]. Molecular Immunology, 2004, 40(12): 877-886. [26]Amparyup P, Charoensapsri W, Tassanakajon A. Two prophenoloxidases are important for the survival of Vibrio harveyi challenged shrimpPenaeusmonodon[J]. Developmental & Comparative Immunology, 2009, 33(2): 247-256. [27]Ai H S, Huang Y C, Li S D, et al. Characterization of a prophenoloxidase from hemocytes of the shrimpLitopenaeusvannameithat is down-regulated by white spot syndrome virus[J]. Fish & Shellfish Immunology, 2008, 25(1-2): 28-39. [28]Murphy R, DeCoursey T E. Charge compensation during the phagocyte respiratory burst[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2006, 1757(8): 996-1011. [29]Parihar M S, Javeri T, Hemnani T, et al. Responses of superoxide dismutase, glutathione peroxidase and reduced glutathione antioxidant defenses in gills of the freshwater catfish (Heteropneustesfossilis)to short-term elevated temperature[J]. Journal of Thermal Biology, 1997, 22(2): 151-156. [30]Fridovich I. Superoxide dismutases. An adaptation to a paramagnetic gas [J]. Biology Chemistry, 1989, 264(14): 7761-7764. [31]Jiang G, Yu R, Zhou M. Modulatory effects of ammonia-N on the immune system ofPenaeusjaponicasto virulence of white spot syndrome virus[J]. Aquaculture, 2004, 241(1): 61-75. [32]Sinthujaroen P, Tonganunt-Srithaworn M, Eurwilaichitr L, et al. Protection ofLitopenaeusvannameiagainst the white spot syndrome virus using recombinant Pm-fortilin expressed inPichiapastoris[J]. Aquaculture, 2015, 435: 450-457. 责任编辑朱宝象 Effect of Dietary Fortilin on Immune Response of White ShrimpLitopenaeusvannameiand Its Resistance Against White Spot Syndrome Virus Infection GENG Xiao-Xue, ZHOU Yi, XU Wei, ZHANG Wen-Bing, MAI Kang-Sen (The Key Laboratory of Aquaculture Nutrition and Feeds, Ministry of Agriculture, The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China) Fortilin, also called translationally controlled tumor protein (TCTP), is ubiquitously expressed in all eukaryotic organisms. This protein is proved to perform several functions including tubulin-binding, calcium-binding and anti-apoptotosis. It involves in many important cellular processes, such as cell growth, cell cycle and the protection of cells against various stress conditions and apoptosis. Since injection of Pm-fortilin reduces shrimp mortality caused by WSSV, there was potential application of fortilin in shrimp culture. The present study was designed to analyze the effect of dietary fortilin on immune response of white shrimpLitopenaeusvannameiand its resistance against white spot syndrome virus (WSSV) infection. The fortilin was expressed in yeastPichiapastoris. One hundred milligrams of the supernatants of the cultured fortilin recombinant yeast (F-1) or the recombinant yeast culture (F-2) were added into 1 kg basal diet. So did the null vector (P-1, P-2). Meanwhile, the basal diet was used as the control (C). Five experimental diets (F-1, F-2, P-1, P-2 and C) were made to feed white shrimps (initial weight (4.87±0.26)g for 20 days. After that, the shrimps were challenged with WSSV. Results showed that the total haemocyte count (THC), the respiratory burst (RB) and phenoloxidase (PO) activity in F-1 group were significantly higher than those in the control (P<0.05). Meanwhile, there was a significant difference in the THC, RB, PO and SOD between F-2 and P-2 group (P<0.05). Activities of the PO and nitric oxide synthase (NOS) in F-1 group were significantly higher than those in P-2 group (P<0.05). The results of WSSV infection experiment showed that cumulative mortality rate in F-1 and F-2 groups was significantly lower than that in the control (P<0.05). The mortality rate in F-1, F-2, P-1, P-2 and C were 19.2%, 15.4%, 56.0%, 47.8% and 84.6%, respectively. In conclusion, inclusion of recombinant fortilin in diet enhanced the immunity and the resistance of shrimp against the WSSV. Further work is needed to point out how to improve the immune stimulant effect of fortilin supplemented in shrimp diet. Litopenaeusvannamei; fortilin; white spot syndrome virus; immunity; feed 国家公益性行业(农业)专项经费项目(201103034)资助 2015-07-24; 2016-01-12 耿小雪(1990-),女,硕士,研究方向:水产动物营养与饲料。E-mail: gengxue2013@163.com ❋❋通讯作者: E-mail:wzhang@ouc.edu.cn S945.1 A 1672-5174(2016)10-032-07 10.16441/j.cnki.hdxb.20150269 Supported by the Special Fund for Agro-scientific Research in the Public Interest (201103034)

