干旱胁迫下甘蓝型油菜相关抗旱基因的表达分析
何巧丽, 张 喆, 冉春燕, 谢小玉
(西南大学农学与生物科技学院三峡库区生态环境教育部重点实验室南方山地农业教育部工程研究中心,重庆 400716)
干旱胁迫下甘蓝型油菜相关抗旱基因的表达分析
何巧丽, 张 喆, 冉春燕, 谢小玉
(西南大学农学与生物科技学院三峡库区生态环境教育部重点实验室南方山地农业教育部工程研究中心,重庆 400716)
以抗旱性较强的甘蓝型油菜Holiday为材料,在开花初期对油菜进行干旱胁迫处理,采用RT-qPCR技术分析ABA2、BnSOS2、BnCS、CAM、CBF4、PIP1这6个油菜抗旱相关基因在干旱胁迫第1天、3天、5天、7天在根、茎、叶、花和青荚中的表达量.结果表明,干旱胁迫下,6个抗旱相关基因在油菜的不同器官中均出现了上调表达;在不同干旱胁迫下,各基因表达量呈现不同的变化趋势;在相同的器官中,各基因的表达量存在明显的不同,累积表达量表现为根中ABA2最大、CBF4最小,茎中CAM最大、CBF4最小,叶中PIP1最大、ABA2最小,花中CBF4最大、BnSOS2最小,青荚中BnCS最大,CBF4最小.说明植物在受到干旱胁迫时,不同的抗旱途径对干旱胁迫的响应程度是不同的;不同器官中各抗旱相关基因与胁迫时间的相关性分析表明,CAM基因在茎中的表达量、CBF4基因在花中的表达量与胁迫时间呈显著正相关.
甘蓝型油菜; 干旱胁迫; 抗旱基因; 基因表达; 实时定量PCR
0 引 言
油菜是当今世界主要的油料作物之一,长江流域是我国主要的油菜产区,但该地季节性干旱频发,尤其是春季易出现干旱少雨,对处于水分敏感期(抽薹开花期)的油菜产生很大的影响,不仅影响油菜正常的生长,还使油菜的开花结实受阻,授粉受精不能完成,导致油菜籽粒产量降低,含油量降低.据报道,春旱使我国长江中下游地区的油菜平均减产20%以上[1],因此,探讨油菜的抗旱机制具有重要意义.
抗旱性是由多基因控制的性状,在棉花[2]、小麦[3]、水稻[4]、玉米[5]、大豆[6]等植物中已经分离到大量干旱胁迫诱导的基因.Yu等[7]在甘蓝型油菜(B.napus L.)中获得了原生质膜水通道蛋白Bn PIP1基因片段全长,转化烟草后发现,过量表达Bn PIP1基因烟草植株在生长的各个时期抗干旱胁迫能力明显增强.童晋[8]等人克隆了甘蓝型油菜中柠檬酸合酶基因(CS),并检测了在不同含油量的油菜品种中,叶片内柠檬酸合酶的表达情况,发现在含油量高的品种内,该基因的表达量高,在油菜的不同器官中,该基因的表达量也存在着明显差异.Haake[9]等在对拟南芥的研究中发现,超表达的CBF4基因增强了植株的耐冻性和耐旱性.Ca2+是信号转导网络中普遍存在的第二信使,CAM(钙调蛋白)是Ca2+的受体,它可以与Ca2+结合,结合后CAM基因就具有了催化活性,可以激活许多下游靶细胞,调节靶蛋白的活性,最终引起细胞产生一系列的生理生化反应,响应干旱胁迫[10];ABA2基因编码叶黄素环氧化酶,催化叶黄素向紫黄质的转变,调节植物适应环境的胁迫[11];BnSOS2基因编码丝氨酸/苏氨酸类蛋白激酶,正常条件下该基因在植物体内的含量很低,当植物在受到渗透胁迫时,依赖SOS的蛋白激酶可能会发出关于渗透胁迫的信号,调节植物参与抗干旱及抗其他胁迫反应[12].
本试验采用实时荧光定量PCR(RT-qPCR)技术分析了甘蓝型油菜初花期在干旱胁迫下6个相关抗旱基因的表达情况,明确在干旱过程中抗旱相关基因的变化趋势,探明这6个重要抗旱基因在同一品种不同干旱胁迫下在不同器官的表达规律,为甘蓝型油菜抗旱分子育种及抗旱鉴定奠定基础.
1 材料与方法
试验于2011—2013年在重庆西南大学的网室内进行.以甘蓝型油菜(Brassica napusL.)Holiday为材料,种子用15%的次氯酸钠消毒20 min,无菌水清洗4~6次,播种于花盆中培养.花盆口径大小为27 cm,每盆放入10 kg的沙壤土,出苗后每盆留苗3株,常规管理.待油菜长到开花初期(整个植株4%~5%的花开放),对油菜分别进行1 d、3 d、5 d、7 d的干旱处理(土壤含水量分别为60%、42%、30%、20%),分别剪取对照(未经干旱处理)和各干旱处理根尖、茎尖、叶(顶部完全展开的第三叶)、花和青荚.液氮速冻后-80℃保存,用于提取总RNA.
液氮研磨后,采用Invitrogen公司生产的Trizol试剂盒提取总RNA.用1.0%琼脂糖凝胶电泳检测总RNA和mRNA质量,紫外分光光度计(DU800,BAKEMAN)测定其纯度和浓度.
RT-qPCR的引物用primer premiers 5.0软件设计,经过blast分析,验证各个基因引物的特异性.以ACT7和UBC21为候选内参基因[13],通过RT-qPCR技术,用ge Norm程序分析基因的表达稳定性,由此选择最合适的内参基因,并通过RT-qPCR反应的溶解曲线验证内参基因的重复性.采用2%的琼脂糖凝胶电泳检测目的基因的PCR扩增片段.目的基因和内参基因如表1.反应条件为:95℃预变性3 min;95℃变性10 s,60℃复性30 s,72℃延伸30 s,45个循环;72℃延伸10 min.使用BIO-RAD公司的iTaqTMUniversal SYBR Green Supermix试剂盒.20μL反应体系中,iTaqTMUniversal SYBR Green Supermix 5 μL,Forward Primer 1μL,Reverse Primer 1μL,DNA Template 1.5μL,H2O 11.5μL.目的基因相对表达量的计算公式为[14]:相对表达量F=(待测组目的基因Ct值—待测组内参基因Ct值)—(对照组目的基因Ct值—对照组内参基因Ct值).

表1 目的基因和候选内参基因的定量PCR引物Tab.1 The Primers of candidate reference genes and target gene
采用Microsoft Excel 2007和SAS统计软件分析数据并作图,其中相关性分析采用SAS软件的Corr过程进行分析.
2 结果与分析
2.1 总RNA质量检测
对样品的总RNA及m RNA质量检测结果显示抽取的RNA品质和纯度符合反转录和RT-qPCR的要求,对两个候选内参基因的稳定性分析选择ACT 7作为RT-qPCR分析中的内参基因[15].
2.2 各器官中相关抗旱基因的表达量
在相同的器官中,6个抗旱相关基因的累积表达量存在明显的不同,见表2.各基因累积表达量在根中为P5CS6>ABA2>PIP1>CAM>BnCS>BnSOS2>CBF4>OAT,在茎中为P5CS6>CAM>PIP1>ABA2>BnSOS2>BnCS>CBF4>OAT,在叶中为PIP1>BnCS>CAM>BnSOS2>P5CS6>CBF4>OAT>ABA2,在花中为CBF4>OAT>PIP1>P5CS6>ABA2>CAM>BnCS>BnSOS2,在青荚中为BnCS>OAT>BnSOS2>ABA2>CAM>PIP1>P5CS6>CBF4.
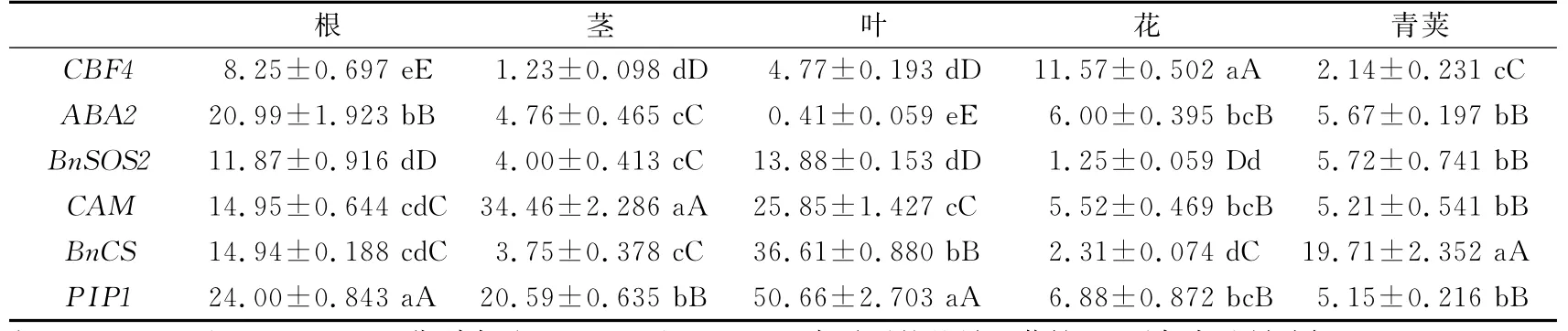
表2 基因在各器官中的累积表达量Tab.2 The accumulated expression of the genes in different organs
在不同的器官中,基因的累积表达量存在明显的差异.ABA2基因在根中表达量最高,花和青荚其次,叶中最低;BnSOS2基因在根和叶中的表达量最高,茎和青荚中其次,花中最低;CAM基因在茎和叶中的表达量最高,在花和青荚中的表达量较低;CBF4基因在花中表达量最高,在茎中表达量最低;BnCS基因在叶中表达量最高,根和青荚中其次,花中最低; PIP1基因的表达量在叶中最高,根和茎中其次,花和青荚中最低.
2.3 各相关抗旱基因在不同胁迫下的表达模式
ABA2基因(见图1)在根中表达量最高,青荚其次,叶中最低.在根和青荚中,表达量呈现先增加后降低的趋势;在青荚中,该基因在干旱胁迫第3天时表达量达到了最大值,是干旱胁迫第1天时表达量的13.35倍,和其他器官相比,该增幅最为明显.
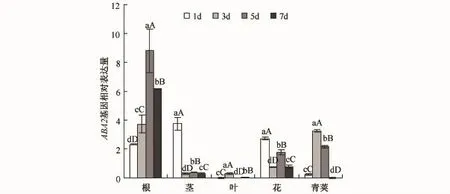
图1 干旱胁迫下ABA2基因在不同器官中的表达Fig.1 Expression patterns of ABA2 gene in various organs under drought stress
BnSOS2基因(见图2)在根和叶中的表达量基本相同,且比在其他器官中的表达量高.在根中,随着胁迫强度的增加,其表达量也呈现递增趋势,干旱胁迫第7天时达到最大值;在叶中,该基因的表达量随着干旱胁迫强度的增加,呈现出先增加后降低的趋势,在干旱胁迫第5天时表达量达到最大,在第7天时下降;在其他器官中,规律比较不明显.
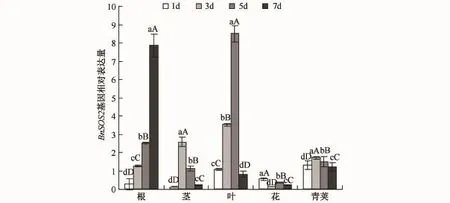
图2 干旱胁迫下BnSOS2基因在不同器官中的表达Fig.2 Expression patterns of BnSOS2 gene in various organs under drought stress
CAM基因(见图3)在茎和叶中的表达量较大,并且各自呈现出不同的趋势.在茎中,该基因的表达量在胁迫初期较低,在干旱胁迫第3天时表达量上升,并在第7天时达到了最大值;在叶中,该基因表达量的趋势较为简单,整体走向为先增加后降低,干旱胁迫初期表达量较低,上升较为缓慢,当干旱胁迫达到第5天时达到最大值,干旱第7天时下降.
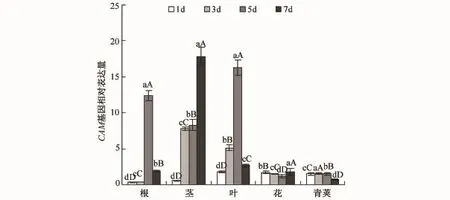
图3 干旱胁迫下CAM基因在不同器官中的表达Fig.3 Expression patterns of CAM gene in various organs under drought stress
CBF4基因(见图4)在根和叶中表达量的变化幅度最为明显,整体呈现出先稳定再显著增加后降低的趋势,在胁迫初期(胁迫1 d和3 d)表达量很低,基本稳定不变,到干旱胁迫第5天时显著上升,第7天时又显著下降;在花中该基因随胁迫强度的增加而增加.
BnCS基因(见图5)表达量在叶中变化最大,在干旱胁迫的初期(第1—3天)表现为一定程度的上调,到干旱胁迫第5天时其表达量猛增,而到干旱胁迫第7天时又大幅减少,所以,在整个胁迫阶段,该基因的表达量呈现出先稳定不变,再显著增大,再减小的趋势.
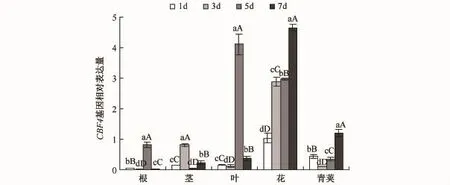
图4 干旱胁迫下CBF4基因在不同器官中的表达Fig.4 Expression patterns of CBF4 gene in various organs under drought stress
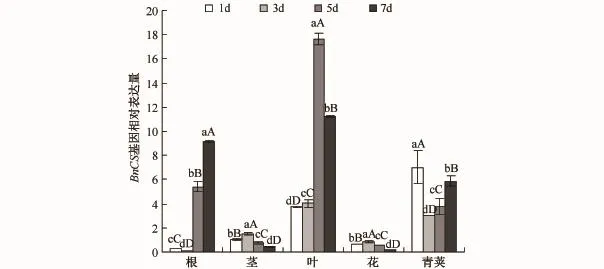
图5 干旱胁迫下BnCS基因在不同器官中的表达情况Fig.5 Expression patterns of BnCS gene in various organs under drought stress
PIP1基因(见图6)在叶中的表达量最高,变化最为明显,在干旱胁迫第1天时明显上调,第3天时出现一定程度的下降,第5天时又大幅度上升,第7天却出现了一个大范围的下降,此时该基因的表达量是干旱胁迫第5天时的1/25,该基因在叶中的表达趋势是先升高再降低.
2.3 不同器官中各基因表达量与胁迫时间的相关性分析
对不同器官中6个抗旱相关基因的表达量与胁迫时间进行相关性分析,结果如表3所示:在茎中,CAM基因的表达量与胁迫时间显著正相关;在花中,CBF4基因的表达量与胁迫时间呈显著正相关;其余基因在不同器官中的表达量与胁迫时间相关关系不显著.
3 讨 论
当植物受到干旱胁迫时,逆境会诱发植物许多抗旱基因的表达,进而引起植物在分子水平和生理生化水平上做出适应性调节,从而增强植物对胁迫的耐受性.干旱胁迫对植物的影响表现在多个方面,采用不同干旱胁迫天数对油菜抗旱基因的表达进行研究,结果表明了油菜不同器官各相关抗旱基因表达量的变化,并得出它们之间的规律.
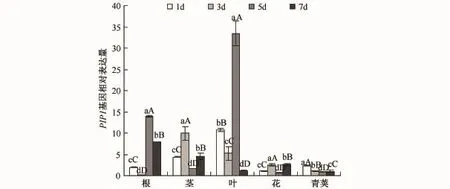
图6 干旱胁迫下PIP1基因在不同器官中的表达情况Fig.6 Expression patterns of PIP1 gene in various organs under drought stress
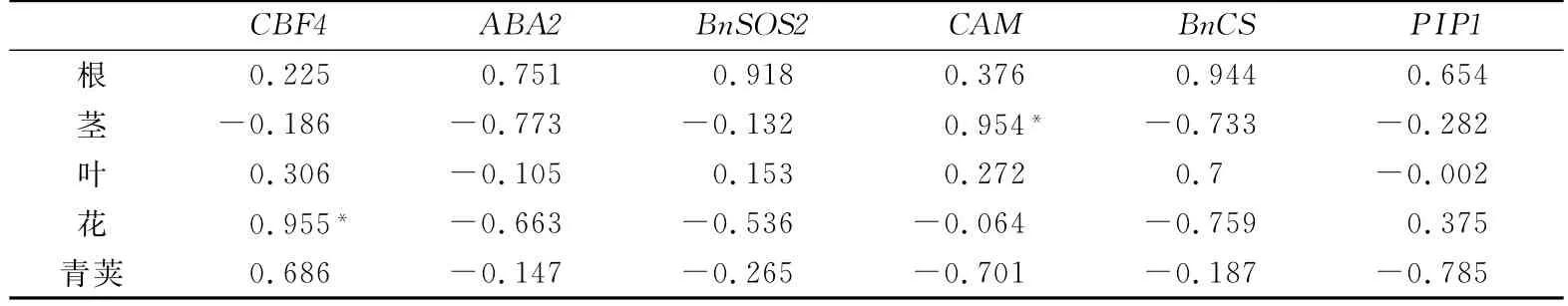
表3 抗旱相关基因表达量与胁迫时间的相关系数Tab.3 The correlation between expression values of drought-related genes and stress time
3.1 各抗旱基因对干旱胁迫的响应
干旱胁迫下,ABA能够调控植物一系列基因的应答反应,提高植物对干旱胁迫的耐受性.桂月晶[16]以20个油菜品种为材料,对油菜幼苗分别施以不同浓度的PEG-6000进行模拟干旱胁迫处理,研究结果发现,在水分胁迫下,ABA2基因的表达量有所上升.本实验的RT-qPCR结果显示,ABA2基因受干旱诱导,除叶子以外其他器官均出现了上调表达,说明该基因是干旱诱导基因,这与前人的研究结论相一致,但是上调表达并不明显.BnSOS2基因编码丝氨酸/苏氨酸类蛋白激酶,正常条件下该基因在植物体内的含量很低,它在拟南芥植株的根和茎中都能表达,当植株受到逆境胁迫(如盐害)时它的表达在根中明显受到促进. BnSOS2作为抗盐相关基因研究的较多[17],但是也有越来越多的研究显示出该基因也参与植物的抗干旱反应.本研究发现BnSOS2基因在受到干旱胁迫时,在除了花以外的其他器官中,该基因的表达量均出现了增加,说明BnSOS2参与了干旱胁迫的信号转导.
CBF4作为CBF家族的一员,该基因所编码的蛋白质与CBF1、CBF2、CBF3所编码的蛋白质有很高的相似性,但是它在冷害条件下并不表达,而在干旱胁迫条件下可诱导表达[18].本文研究显示该基因在根、茎、叶中的表达量是基本相同的,不存在特异性,但是在花中和青荚中该基因的表达量同在其他器官中的有所不同,所以该基因的表达存在器官特异性.在根部,CBF4受到诱导后第5天表达量出现剧烈增加,之后则呈下降趋势,表明该基因对干旱胁迫具有极其显著的响应,且根中的响应比叶中的更加快速剧烈.与叶相比,根中CBF4的上调迅速而剧烈,这可能是由于根比叶先感受到胁迫信号.柠檬酸合酶广泛参与了植物的代谢调控和环境应答[9],在干旱条件下其转录水平的变化可以为多种高等植物的代谢起参考作用.本实验中,BnCS基因在植物受到干旱胁迫时均出现了上调表达,这表明柠檬酸合酶是多数器官和组织中不可缺少的重要代谢酶,其代表的三羧酸循环维持着组织正常生理功能的实现.
越来越多的实验表明,CAM基因在植物的不同发育时期和不同的干旱处理下,在不同的器官中均表现出表达特异性[18-19].本文研究结果显示,不同器官中的CAM基因在受到干旱胁迫时均出现了上调表达,说明该基因是干旱诱导表达基因,参与了植物响应干旱的应答途径;同时该基因在不同器官中的表达量存在明显不同,说明该基因的表达存在着器官特异性,这与前人的研究相一致[20].CAM基因在根、茎、叶中的表达量普遍高于该基因在花和青荚中的表达量,这表明,该基因在营养器官中的表达要高于生殖器官.孙丰宾[21]针对白桦各发育时期的组织器官中的CAM基因的表达进行研究发现,该基因在白桦的维管组织如叶和茎中的表达量较高,他的研究结果与本次实验的结果相同.
3.2 各抗旱基因的表达量比较分析
在甘蓝型油菜根、茎、叶、花和青荚这5个器官中,各个抗旱相关基因的表达量有很大的差别.PIP1基因在根、茎和叶中的表达量都很高.PIP1基因所控制的是质膜内在蛋白的合成,而植物的根、茎和叶是进行水分运输的主要器官,当植物遭遇水分不足时,这3个器官最先感受到,所以控制该部位的水孔蛋白基因PIP1表达量升高来适应缺水环境.BnCS基因在叶和青荚中的表达量较高,在茎和花中表达量较低,因为BnCS基因所控制的产物是三羧酸循环过程中的关键酶,在叶和青荚中,由于叶片进行光合作用要固定CO2形成糖类,青荚中的糖类和脂类相对含量较高,茎和花中糖类和脂类相对含量较低,所以BnCS基因在叶和青荚中表达量较高,在茎和花中的表达量相对较低.在拟南芥中的研究表明CBF4的转录物在根、茎、叶等器官中的积累相差不多[22],而本试验中该基因在根、茎、叶中的表达量是基本相同的,但是在花中和青荚中该基因的表达量同在其他器官中有所不同.根中的CBF4在受到诱导后的第5天表达量激增,且根中的响应比叶中的更加快速剧烈,这可能是由于根比叶先感受到胁迫信号.水分胁迫下,ABA能够调控植物一系列基因的应答反应,提高植物对干旱胁迫的耐受性;同时,气孔的运动也受到ABA的调控,Audran[11]等研究发现,干旱胁迫可诱导ABA2基因在根中的表达,且该基因控制合成的玉米黄质环氧化酶只在根中有所增加,而在本试验中根部该基因的表达量也明显高于在其他器官中的表达量.和根相比,叶中ABA2的表达可能受多种水平或多种因素的影响,因为在叶子中该基因所控制的酶类同时也参与叶黄素的循环,因此叶中ABA2基因的转录水平可能也会受到光合基因的影响.沙琴[23]以玉米为材料,研究了在干旱胁迫下CAM基因的表达情况,研究结果发现该基因在叶片和根中受到干旱胁迫诱导出现上调表达,且CAM基因在玉米不同组织中的表达模式也存着不同,CAM基因在根和叶中的表达高峰出现的时间不同,而且在叶中的表达量要高于在根中的,这一现象与本实验得到的结论也相同.同时Takezawa[18]的研究发现,在不同器官中的CAM基因表达存在差异,这样的差异也出现在Lee[19]对大豆的研究结果中.
4 结 论
本研究表明同一抗旱基因在不同器官中,不同程度的干旱胁迫下表达量存在较大的差异,在同一种器官中各个抗旱基因的表达量也差异明显.说明高等植物对不良环境的抵御往往是多基因作用的结果,因此探明相关功能基因对逆境的响应,分离、鉴定、利用有利于提高作物抗逆性的基因,对作物优质高产有重要作用.
[1] 杨春杰,程勇,邹崇顺,等.模拟干旱胁迫下不同甘蓝型油菜品种发芽能力的配合力与遗传效应分析[J].作物学报, 2008,34(10):1744-1749.
[2] SELVAM J N,KUMARAVADIVEL N,GOPIKRISHNAN A,et al.Identification of a novel drought tolerance gene in Gossypium hirsutum L.cv KC3[J].Commun Biometry Crop Sci,2009,4(1):9-13
[3] YAN A H,ZHANG L F,ZHANG Y W,et al.Early stage SSH library construction of wheat near isogenic line Tc Lr19 under the stress of Puccinia recondita f.sp.Tritici[J].Front Agric China,2009,3(2):146-151
[4] ISLAM M A,DU H,NING J,et al.Characterization of Glossy 1-homologous genes in rice involved in leaf wax accumulation and drought resistance[J].Plant Mol Biol,2009,70(4):443-456
[5] YUE G D,ZHANG Y L,LI Z X,et al.Differential gene expression analysis of maize leaf at heading stage in response to water-deficit stress[J].Bioscie Rep,2008,28(3):125-134
[6] ZHANG G Y,CHEN M,LI L C,et al.Over-expression of the soybean GmERF3 gene,and AP2/ERF type transcription factor for increased tolerances to salt,drought,and diseases in transgenic tobacco[J].J Exp Bot,2009, 60(13):3781-3796
[7] YU Q,HU Y,LI J,et al.Sense and antisense expression of plasma membrane aquaporin BnPIP1 from Brassia napus L.in tobacco and its effects on plant drought resistance[J].Plant Sci,2005,169:647-656
[8] 童晋,詹高淼,王新发,等.油菜柠檬酸合酶基因的克隆及在逆境下的表达[J].作物学报,2009,35(1):33-40.
[9] HAAKE VCOOK D,RIECHMANN J L.Transcription factor CBF4 is a regulator of drought adaptation in Arabidopsis[J].Plant Physiol,2002,130(2):639-648.
[10] BOUCHE N,YELLIN A,SNEDDEN W A,et al.Plant-speeific calmodulin-binding proteins[J].Annual Review of Plant Biology,2005,56:435-466.
[11] AUDRAN C,BOREL C,FREY A,et al.Expression studies of the zeaxanthin epoxidase gene in Nicotiana plum-6aginifolia[J].Plant Physiol,1998,118:1021-1028.
[12] ZHU J K.Plant salt tolerance[J].Trends Plant Sci,2001,6(2):66-71.
[13] CHEN X,TRUKSA M,SHAH S,et al.A survey of quantitative real-time polymerase chain reaction internal reference genes for expression studies in Brassica napus L.[J].Analytical Biochemistry,2010,405(1):138-140.
[14] PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29(9):45
[15] 张喆,白鹏,肖通,等.甘蓝型油菜P5CS6和OAT基因在干旱胁迫下的表达分析[J].西北农业学报,2013,22(9): 65-73.
[16] 桂月晶.油菜抗旱指标筛选及抗旱相关基因的表达分析[D].河南开封:河南大学,2011.
[17] LIU J,ISHITANI M,HALFTER U,et al.The Ara6idopsis thaliana SOS2 gene encodes a protein kinase that is required for salt tolerance[J].Proc Natl Acad Sci USA,2000,97(7):3730-3734.
[18] TAKEZAWA D,LIU Z H,AN G,et al.Calmodulin gene family in potato:developmental and touch-induced expression of mRNA encoding a novel isoform[J].Plant Mol Biol,1995,27(4):693-703.
[19] LEE S H,KIM J C,LEE M S,et al.Identification of a novel divergent calmodulin isoform from soybean which has differential ability to activate calmodulin-dependent enzymes[J].J Biol Chem,1995,270(37):21806-21812.
[20] YANG T,SEGAL G,ABBO S,et al.Characterization of the calmodulin gene family in wheat:structure,chromo-somal location,and evolutionary aspects[J].Mol Gen Genet,1996,252(6):684-694.
[21] 孙丰宾,魏继承,刘瀛,等.白桦钙调蛋白基因Ca M的分离及其转录表达[J].经济林研究,2011,29(4):6-12.
[22] 李丽娟,赵奂,李艳军,等.植物中的DREB类转录因子[J].首都师范大学学报:自然科学版,2006,27(5):61-67.
[23] 沙琴.干旱胁迫和盐胁迫诱导玉米Ca M基因表达基因与ABA、H2O2的关系[D].南京:南京农业大学,2008.
(责任编辑 张 晶)
Expression analysis of Brassica napus L.drought-related genes under drought stress
HE Qiao-li, ZHANG Zhe, RAN Chun-yan, XIE Xiao-yu
(Key La6oratory of Eco-environments in Three Gorges Reservoir Region,Ministry of Education, Engineering Research Center of South Upland Agriculture,Ministry of Education, College of Agronomy and Biotechnology,Southwest University,Chongqing 400716,China)
The high drought-tolerant variety Holiday was treated as the experimental material under drought stress in the early flower stage.The expression level of 6 drought-related genes (ABA2、BnSOS2、BnCS、CAM、CBF4、PIP1)which were selected from different organs(root, stem,leaf,flower and green pod)at different stress times(1,3,5,7 days)were analyzed by q RT-PCR technology.The result showed that the expression of six drought-resistant genes in different organs all increased under drought stress,and they presented different trends respec-tively under different drought stress.In the same organs,the expression of the six drought-resistant genes had obvious different.In root,the maximum cumulative expression value gene was ABA2,and the minimum cumulative expression value gene was CBF4;in stem,the maximum was CAM,the minimum was CBF4;in leaf,the maximum was PIP1,the minimum was ABA2;in flower,the maximum was CBF4,the minimum was BnSOS2;in green pod,the maximum was BnCS,the minimum was CBF4.It suggested that different drought resistance pathway played different role under drought stress.The correlation analysis between expression values of drought-related genes and stress time showed that the expression quantity of CAM gene in the stem volume,CBF4 gene in the flowers was significantly positively related to the stress time.
Brassica napus L.(rapeseed); drought stress; drought-related genes; gene expression; quantitative real-time PCR
S565.4
A
10.3969/j.issn.1000-5641.2016.01.015
1000-5641(2016)01-0113-10
2014-12
国家自然科学基金(31271673);公益性行业(农业)科研专项201503127;重庆市自然科学基金(CSTC2010BB1012)
何巧丽,女,硕士研究生,研究方向为植物生理与分子生物学.E-mail:hql1211@126.com.
谢小玉,女,副教授,研究方向为植物生理与分子生物学.E-mail:xiexy8009@163.com.

