多药耐药基因多态性与利培酮及其代谢物血药浓度的相关性
楼 江,严 伟,王 刚,徐 萍,李焕德#,王 飞(.杭州市第一人民医院药学部,杭州 30006;.中南大学湘雅二医院临床药学研究室,长沙 400)
·精准医疗·
多药耐药基因多态性与利培酮及其代谢物血药浓度的相关性
楼 江1*,严 伟1,王 刚1,徐 萍2,李焕德2#,王 飞1(1.杭州市第一人民医院药学部,杭州 310006;2.中南大学湘雅二医院临床药学研究室,长沙 410011)
目的:探讨我国汉族精神分裂症患者多药耐药基因(MDR1)多态性与利培酮、9-羟基利培酮及总活性物血药浓度的相关性。方法:选择2011年10月-2013年1月中南大学湘雅二医院精神卫生研究所的汉族精神分裂症住院患者78例,采用高效液相色谱-串联质谱法测定其利培酮、9-羟基利培酮和总活性物的血药浓度,采用聚合酶链-连接酶检测反应法检测患者MDR1 C1236T、G2677T和C3435T的基因分型,采用单因素方差分析考察MDR1基因多态性与利培酮、9-羟基利培酮及总活性物血药浓度/剂量校正比(C/D)值的相关性。结果:78例患者体内利培酮、9-羟基利培酮及总活性物的平均血药浓度分别为(13.58±8.31)、(25.62±15.52)、(39.24±25.76)ng/ml;C1236T、G2677T和C3435T各基因型分布频率均符合Hardy-Weinberg平衡(P>0.05);C1236T CT和TT型患者利培酮的C/D值高于CC型患者,G2677T TT型患者利培酮与总活性物的C/D值均高于GG型患者,差异均有统计学意义(P<0.05);而其他基因型患者体内各待测物C/D值间的差异均无统计学意义(P>0.05)。结论:汉族精神分裂症患者MDR1 C1236T和G2677T多态性与利培酮及总活性物的血药浓度相关。
多药耐药;基因多态性;利培酮;9-羟基利培酮;总活性物;血药浓度/剂量校正比;相关性
非典型抗精神病药物利培酮(Risperidone,结构见图1A)为苯并异噁唑衍生物,对多巴胺D2和5-羟色胺2受体具有双重阻滞作用,常用于精神分裂症、躁狂症及其他精神病症状的临床治疗。利培酮主要经细胞色素P450(CYP)酶代谢,9-羟基利培酮(结构见图1B)是其主要的代谢产物,与利培酮具有相似的药理活性,因此,临床上将利培酮与9-羟基利培酮统称为总活性物。相关研究表明,采用相同剂量的利培酮予以治疗,部分患者可能出现催乳素升高、QT间期延长综合征(QT Prolongation syndrome,QTs)等不良反应,这可能与其药动学个体差异大、总活性物血药浓度治疗窗(20~60 ng/ml)窄等有关[1-3],故探究利培酮血药浓度个体化差异是实现其精准治疗的关键。
利培酮和9-羟基利培酮是P-糖蛋白(P-glycoprotein,P-gp)
转运体的底物。P-gp广泛分布于小肠、肾脏和血脑屏障等部位,影响着底物药物的吸收、代谢和排泄,而人类P-gp的活性主要由多药耐药基因(Multidrug resistant 1,MDR1)编码,故其基因多态性可能是导致利培酮个体差异的原因。因此,本研究以我国汉族精神分裂症患者为研究对象,考察其MDR1 C1236T、G2677T及C3435T各基因型的分布频率,分析其基因多态性与利培酮、9-羟基利培酮及总活性物血药浓度/剂量校正比(Dose-corrected plasma concentration,C/D)值的相关性,初步探讨利培酮个体差异的原因,为临床实现利培酮个体化治疗提供参考。

图1 利培酮、9-羟基利培酮及内标的结构A.利培酮;B.9-羟基利培酮;C.内标Fig 1 Structure of risperidone,9-hydroxyrisperidone and internal standardA.risperidone;B.9-hydroxyrisperidone;C.internal standard
1 材料
1.1 仪器
Perkin Elmer 9600型聚合酶链反应(PCR)扩增仪、MJ PTC-200型梯度仪(美国爱普拜斯应用生物系统上海有限公司);FR-200A型生物电泳图像分析系统(上海复日科技有限公司);Acquity HPLCTM/Quattro Premier XE micromass Technologies系统(美国Waters公司);AG285 MS105DU型电子分析天平(瑞士Metter-Toledo公司);TDZ5-WS型低速离心机(长沙市平凡仪器仪表有限公司)。
1.2 药品与试剂
利培酮片(商品名:维思通,西安杨森制药有限公司,批准文号:国药准字H20010309,规格:1 mg/片)、利培酮对照品(批号:107K47006,纯度≥98%)、9-羟基利培酮对照品(批号:038K47152,纯度≥98%)均购自美国Sigma公司;AF2672[内标(结构见图1C),意大利Angelini公司,批号:RS01107,纯度:99.9%];全血基因组DNA提取试剂盒(离心柱型,北京天根生化科技有限公司,批号:SG012);PCR引物、NEB Taq DNA ligase酶体系由翼和生物工程有限公司设计和合成;Qiagen hotstar Taq酶体系由快而精德国生物技术有限公司提供;醋酸铵、甲醇、乙腈为色谱纯,水为去离子水。
2 方法
2.1 研究对象
选择2011年10月-2013年1月中南大学湘雅二医院精神卫生研究所的汉族精神分裂症住院患者78例。纳入标准:①确诊为精神分裂症,其诊断符合美国《精神障碍诊断与统计》第四版(DSM-Ⅳ)精神分裂症诊断标准;②首发或复发,并在1个月内未服用任何抗精神病药物,治疗期间单独使用利培酮或联用苯海索同一剂量至少1周;③无器官疾病史和药物耐药史;④肝/肾功能正常;⑤无药物滥用;⑥无烟酒嗜好,且无过往吸毒史患者。排除标准:①躯体残疾者;②妊娠期妇女或可能妊娠的妇女;③长期服用P-gp诱导药或抑制剂的患者;④研究者认为不能入组的其他情况。受试者招募及试验方案均经医院医学伦理委员会批准,受试者及其监护人均在受试前签署知情同意书。
2.2 给药方案及血样采集
参考Law S等[4]的研究方案,将给药方案确定为:患者每日口服利培酮片1~3片,早晚各1次,连续服用同一剂量至少7 d,使利培酮及9-羟基利培酮的血药浓度达到稳态。在末次给药后12 h采集血样(稳态谷浓度),将收集到的全血保存于-20℃冰箱中,备用。
2.3 血药浓度的测定
血浆样品经液-液萃取后,采用高效液相色谱-串联质谱(LC-MS/MS)法测定血清中利培酮及9-羟基利培酮的稳态谷浓度。色谱柱:XtimateTMC18(150 mm×2.1 mm,3 μm);流动相:乙腈-0.01 mmol/L醋酸铵溶液(pH=3.2)(37∶63,V/V);流速:0.25 ml/min;柱温:40℃;进样量:6 μl。采用电喷雾电离源(ESI),以多反应监测(MRM)模式扫描,正离子方式检测;碰撞气为氩气;毛细管电压、锥孔气体流速和干燥气体流速分别为300 V、50 L/h和600 L/h;用于定量分析的离子对分别为m/z 411.21→191.06(利培酮)、m/z 427.21→206.91(9-羟基利培酮)和m/z 418.03→175.95(内标)。根据2010年版《中国药典》中生物样品分析方法的基本要求对该方法的专属性、标准曲线与线性范围、精密度与准确度、基质效应和稳定性等进行考察[5]。
2.4 MDR1C1236T、G2677T和C3435T的基因分型检测
所有患者抽取肘静脉血5 ml,采用全血基因组DNA提取试剂盒提取总DNA,产物于-20℃保存,备用。采用聚合酶链-链接酶检测反应(Polymerase chain reaction-ligase detection reaction,PCR-LDR)法检测患者MDR1 C1236T、G2677T和C3435T的基因分型,引物序列见表1。PCR反应条件:95℃预变性15 min,94℃变性30 s,56℃退火1 min,72℃延伸1 min,最后72℃再延伸7 min,共进行35个循环。产物于4℃下保存。PCR产物检验:取产物2 μl置于3.0%琼脂糖胶中,于120 V下,在0.5×Tris-硼酸电解缓冲液中电泳20~30 min,检测反应是否成功。

表1 MDR1的引物序列Tab 1 The primers of MDR1
采用LDR检测C1236T、G2677T和C3435T的基因分型。取PCR扩增产物至等体积ddH2O中,作为连接反应的模板。取Probe Mix 100 μl、10×buffer 100 μl、连接酶5 μl和去离子水695 μl至1.5 ml离心管中,离心后取上清液9 μl至200 μl PCR反应管中,再加上述模板1 μl,在PCR仪上进行连接反应。取ABI GS-500 ROX荧光标记分子量标准液1 μl、LDR连接产物
1 μl和去离子甲酰胺上样液1 μl充分混合,95℃变性2 min后,放入冰中骤冷,于3 kV下,在5 mol/L尿素和5%聚丙烯酰胺中电泳2.5 h。采用GENESCANTM 672软件收集数据、校正泳道线、测量迁移片段大小和校正内在分子质量标准;采用Genemapper V4.0软件进行数据分析和基因分型。
2.5 统计学方法
3 结果
3.1 一般资料
78例精神分裂症患者中,男、女性患者各39例,平均年龄(35.29±15.76)岁,平均体质量(59.29±9.21)kg,平均服药剂量(4.62±1.09)mg。
3.2 血药浓度测定结果
该LC-MS/MS法符合生物样品分析方法的基本要求[5]。受试患者体内利培酮的平均血药浓度为(13.58±8.31)ng/ml,9-羟基利培酮的平均血药浓度为(25.62±15.52)ng/ml,总活性物的平均血药浓度为(39.24±25.76)ng/ml。
3.3 MDR1C1236T、G2677T和C3435T基因型分布
MDR1 C1236T、G2677T和C3435T基因型分布见表2。MDR1 C1236T、G2677T和C3435T基因型分布频率的观察值和理论值吻合度较好,其分布频率均符合Hardy-Weinberg平衡(P分别为0.766、0.639和0.965)。
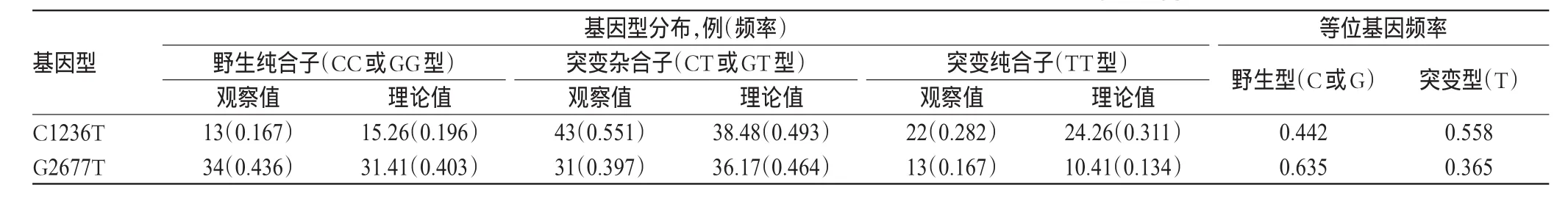
表2 MDR1C1236T、G2677T和C3435T基因型分布Tab 2 Distribution of MDR1C1236T,G2677T and C3435T genotypes
3.4 基因多态性与C/D值的相关性
采用单因素方差分析法考察患者MDR1 C1236T、G2677T和C3435T基因多态性与利培酮、9-羟基利培酮及总活性物C/D值的相关性。结果显示,C1236T CT和TT型患者利培酮的C/D值高于CC型患者,差异均有统计学意义(P<0.05);G2677T TT型患者利培酮与总活性物的C/D值均高于GG型患者,差异均有统计学意义(P<0.05);而其他基因型患者体内各待测物C/D值间的差异均无统计学意义(P>0.05)。提示MDR1 C1236T、G2677T基因多态性可能与利培酮的C/D值相关,G2677T基因多态性可能与总活性物的C/D值相关,详见表3。
表3 利培酮、9-羟基利培酮及总活性产物的C/D值与MDR1基因多态性的相关性(s)Tab 3 Correlation of C/D values of risperidone,9-hydroxyrisperidone,total active substance and MDR1 gene polymorphisms(s)
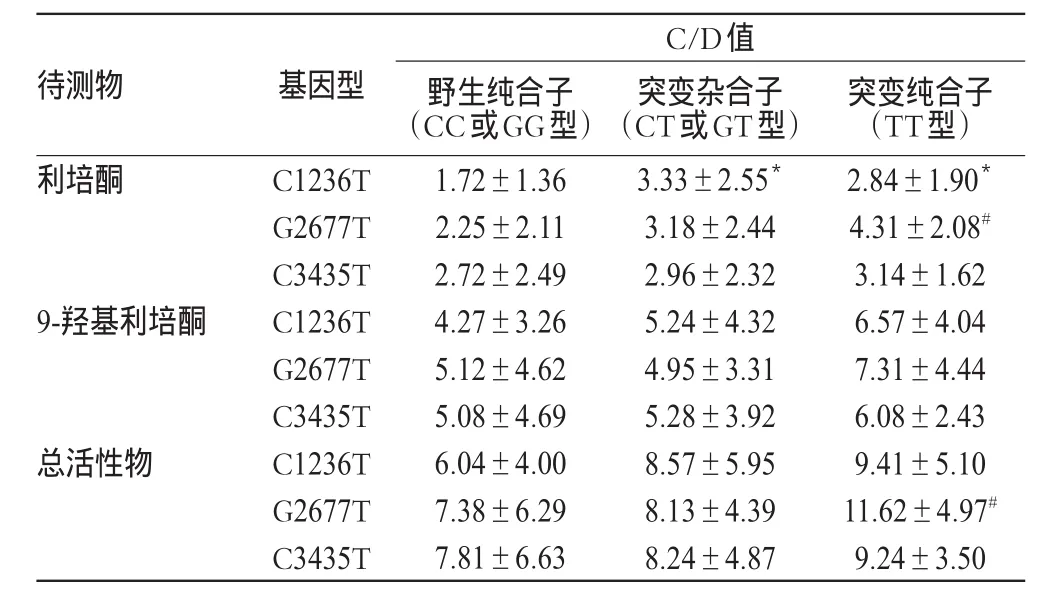
表3 利培酮、9-羟基利培酮及总活性产物的C/D值与MDR1基因多态性的相关性(s)Tab 3 Correlation of C/D values of risperidone,9-hydroxyrisperidone,total active substance and MDR1 gene polymorphisms(s)
注:与CC型患者比较,*P<0.05;与GG型患者比较,#P<0.05Note:vs.patients with CC genotype,*P<0.05;vs.patients with GG genotype,#P<0.05
C/D值突变纯合子(TT型)2.84±1.90*4.31±2.08#3.14±1.62 6.57±4.04 7.31±4.44 6.08±2.43 9.41±5.10 11.62±4.97#9.24±3.50待测物 基因型利培酮9-羟基利培酮总活性物C1236T G2677T C3435T C1236T G2677T C3435T C1236T G2677T C3435T野生纯合子(CC或GG型)1.72±1.36 2.25±2.11 2.72±2.49 4.27±3.26 5.12±4.62 5.08±4.69 6.04±4.00 7.38±6.29 7.81±6.63突变杂合子(CT或GT型)3.33±2.55*3.18±2.44 2.96±2.32 5.24±4.32 4.95±3.31 5.28±3.92 8.57±5.95 8.13±4.39 8.24±4.87
4 讨论
P-gp是三磷酸腺苷(ATP)结合盒转运蛋白超家族成员之一,分布于胃肠上皮细胞、肝细胞、肾小管上皮细胞及血脑屏障中,可将包括药物在内的外源性物质排至细胞外,间接促进药物的肠道代谢,增加首关效应,从而影响药物的血药浓度。肠道上皮细胞中的P-gp可将已吸收的物质外排至肠腔,减少其吸收;血脑屏障中的P-gp可阻止底物药物进入脑内,降低脑内药物浓度[6]。利培酮及9-羟基利培酮均为P-gp的底物,Nakagami T等[7]报道了12例日本健康受试者服用利培酮与维拉帕米(P-gp的抑制剂)的双周期自身对照试验,结果发现,联用维拉帕米组患者利培酮及9-羟基利培酮的药-时曲线下面积(AUC0-24h)和生物利用度均高于单用利培酮组,提示P-gp的活性可能会影响利培酮及9-羟基利培酮的药动学特征。而P-gp的活性由位于人体第7条染色体上的MDR1基因编码,研究报道MDR1的单核苷酸基因多态性可影响P-gp的活性,从而对底物药物的吸收、分布及代谢产生影响[8]。目前已发现48种MDR1的功能性等位基因存在突变,其中第12号外显子(C1236T)、第21号外显子(G2677T)和第26号外显子(C3435T)的突变可能会影响P-gp的表达和活性[9-11]。因此,MDR1基因多态性可能是引起利培酮及9-羟基利培酮血药浓度个体差异的重要因素。
目前尚未见我国精神分裂症患MDR1基因多态性与利培酮及其代谢物血药浓度相关性研究的报道,而MDR1基因多态性在不同种族中的分布频率有所差异,因此本研究希望通过相关性分析,初步探讨利培酮及其代谢物血药浓度个体差异的原因,为实现利培酮在我国汉族精神分裂症患者中的个体化治疗提供参考依据。本研究以单独使用利培酮或联用苯海索(非P-gp的诱导药或抑制剂,不会对利培酮血药浓度产生影响)的78例精神分裂症患者为研究对象,采用LC-MS/MS法检测其体内利培酮及其代谢物的稳态血药浓度,采用PCR-
LDR法检测各患者的基因型。结果显示,MDR1 C1236T、G2677T和C3435T的等位基因突变频率分别为0.442(C1236T的C等位基因)、0.635(G2677T的G等位基因)和0.635(C3435T的C等位基因),各基因型分布频率均符合Hardy-Weinberg平衡(P>0.05)。相关性分析结果显示,C1236T、G2677T基因多态性可能与利培酮的C/D值相关,G2677T基因多态性可能与总活性物的C/D值相关。Yasui-Furukori N等[12]研究了85例日本精神分裂症患者的MDR1基因多态性,结果显示,患者C3435T和G2677T/A基因多态性不影响利培酮和9-羟基利培酮的稳态血药浓度;但Gunes A等[13]在对意大利精神分裂症患者的研究中发现,C1236T TT、C2677T TT及C3435T TT基因型患者与其他基因型患者相比,9-羟基利培酮及总活性物的血药浓度更低。造成与现有文献研究结果差异的原因可能为:(1)受试患者属不同种族,MDR1等位基因位点的突变频率有所差异。(2)MDR1基因多态性可影响小肠中P-gp的活性,进而可能影响利培酮及其代谢物的血药浓度和生物利用度;但有研究发现,利培酮主要经肝脏CYP2D6酶代谢,而CYP2D6基因多态性也有可能造成利培酮及其代谢物血药浓度的个体差异;(3)9-羟基利培酮主要经肾脏排泄,肾小管近端P-gp的活性可能影响9-羟基利培酮的重吸收,但本研究未发现C1236T、G2677T和C3435T基因多态性与9-羟基利培酮血药浓度间的相关性,可能是由于在肾脏排泄和重吸收过程中,还有其他转运体参与[12-15]。
本研究虽发现MDR1 C1236T和G2677T基因多态性对利培酮和总活性物的血药浓度有一定影响,但本研究存在样本量较小、考察指标较为局限等不足。因此,在后续研究中,应进一步扩大样本量,全面考察MDR1基因多态性与血药浓度、临床疗效、不良反应之间的相关性,以促进利培酮在我国汉族精神分裂症人群中的精准化治疗。
[1] Suzuki Y,Tsuneyama N,Fukui N,et al.Effect of risperidone metabolism and P-glycoprotein gene polymorphism on QT interval in patients with schizophrenia[J].Pharmacogenomics J,2014,14(5):452.
[2] 姚鹏,张德伦,沈宁平,等.利培酮致不良反应142例分析[J].中国药房,2014,25(4):358.
[3] Maayan L,Correll CU.Weight gain and metabolic risks associated with antipsychotic medications in children and adolescents[J].J Child Adolesc Psychopharmacol,2011,21(6):517.
[4] Law S,Gudbrandsen M,Magill N,et al.Olanzapine and risperidone plasma concentration therapeutic drug monitoring:a feasibility study[J].J Psychopharmacol,2015,29(8):933.
[5] 国家药典委员会.中华人民共和国药典:二部[S]2010年版.北京:中国医药科技出版社,2010:附录:196.
[6] Lin JH,Yamazaki M.Role of P-glycoprotein in pharmacokinetics:clinical implications[J].Clin Pharmacokinet,2003,42(1):59.
[7] Nakagami T,Yasui-Furukori N,Saito M,et al.Effect of verapamil on pharmacokinetics and pharmacodynamics of risperidone:in vivo evidence of involvement of P-glycoprotein in risperidone disposition[J].Clin Pharmacol Ther,2005,78(1):43.
[8]Brambila-Tapia AJ.MDR1(ABCB1)polymorphisms:functional effects and clinical implications[J].Rev Invest Clin,2013,65(5):445.
[9] Suzuki Y,Tsuneyama N,Fukui N,et al.Impact of the ABCB1 gene polymorphism on plasma 9-hydroxyrisperidone and active moiety levels in Japanese patients with schizophrenia[J].J Clin Psychopharmacol,2013,33(3):411.
[10] Xiang Q,Zhao X,Zhou Y,et al.Effect of CYP2D6,CYP3A5,and MDR1 genetic polymorphisms on the pharmacokinetics of risperidone and its active moiety[J].J Clin Pharmacol,2010,50(6):659.
[11] 汝继玲,何晓静,邱枫,等.ABCB1基因多态性对卡马西平血药浓度的影响[J].中国医院药学杂志,2012,32(11):820.
[12] Yasui-Furukori N,Mihara K,Takahata T,et al.Effects of various factors on steady-state plasma concentrations of risperidone and 9-hydroxyrisperidone:lack of impact of MDR-1 genotypes[J].Br J Clin Pharmacol,2004,57(5):569.
[13] Gunes A,Spina E,Dahl ML,et al.ABCB1 polymorphisms influence steady-state plasma levels of 9-hydroxyrisperidone and risperidone active moiety[J].Ther Drug Monit,2008,30(5):628.
[14] Yoo HD,Cho HY,Lee SN,et al.Population pharmacokinetic analysis of risperidone and 9-hydroxyrisperidone with genetic polymorphisms of CYP2D6 and ABCB1[J]. J Pharmacokinet Pharmacodyn,2012,39(4):329.
[15] Jovanovic N,Bozina N,Lovric M,et al.The role of CYP2D6 and ABCB1 pharmacogenetics in drug-naive patients with first-episode schizophrenia treated with risperidone[J].Eur J Clin Pharmacol,2010,66(11):1 109.
(编辑:张元媛)
The Correlation between Multidrug Resistance Gene Polymorphism and Plasma Concentration of Risperidone and Its Metabolite
LOU Jiang1,YAN Wei1,WANG Gang1,XU Ping2,LI Huande2,WANG Fei1(1.Dept.of Pharmacy,the First People's Hospital of Hangzhou,Hangzhou 310006,China;2.The Clinical Pharmacy Research Laboratory,Second Xiangya Hospital of Central South University,Changsha 410011,China)
OBJECTIVE:To discuss the correlation between multidrug resistance gene(MDR1)polymorphisms and plasma concentration of risperidone,9-hydroxyrisperidone and total active substance in Han patients with schizophrenia.METHODS:78 Han inpatients with schizophrenia in Mental Health Institute of Second Xiangya Hospital of Central South University from Dec. 2011 to Jan.2013 were selected,LC-MS/MS was conducted to determine the plasma concentration of risperidone,9-hydroxyrisperidone and total active substance,PCR-LDR was adopted to determine the genotyping of C1236T,G2677T and C3435T of patients,and one-way ANOVA was used to detect the correlation between C1236T,G2677T and C3435T polymorphisms and plasma concentration/dose calibration ratio(C/D)value of risperidone,9-hydroxyrisperidone and total active substance.RESULTS:The average plasma concentrations of risperidone,9-hydroxyrisperidone and total active substance for 78 patients were(13.58±8.31),(25.62± 15.52)and(39.24±25.76)ng/ml,respectively;the distribution frequencies of C1236T,G2677T and C3435T met the Hardy-Weinberg equilibrium(P>0.05);the risperidone C/D value of patients with C12367T CT and TT genotype were higher than those with CC genotype,risperidone and total active substance C/D values of patients with G2677T TT genotype were higher than those with GG genotype,the differences were statistically significant(P<0.05);while there were no significant differences in analyte C/D values in other patients(P>0.05).CONCLUSIONS:The MDR1 C1236T and G2677T polymorphisms are associated with plasma concentration of risperidone and total active substance in Han patients with schizophrenia.
Multidrug resistance;Gene polymorphism;Risperidone;9-hydroxyrisperidone;Total active substance;Plasma concentration/dose calibration ratio;Correlation
R749
A
1001-0408(2016)26-3601-04
2016-01-05
2016-03-11)
*药师,硕士。研究方向:临床药学及药动学。电话:0571-56007191。E-mail:jianglou5855@163.com
#通信作者:主任药师,博士生导师。研究方向:临床药学及药动学。电话:0731-84436720。E-mail:lihuande1953@126.com
DOI 10.6039/j.issn.1001-0408.2016.26.01

