外源亚精胺对PEG胁迫下燕麦幼苗生长及部分生理特性的影响
吴旭红,冯晶旻
(1.齐齐哈尔大学生命科学与农林学院,黑龙江齐齐哈尔 161006; 2.齐齐哈尔市卫生监督所,黑龙江齐齐哈尔 161005)
外源亚精胺对PEG胁迫下燕麦幼苗生长及部分生理特性的影响
吴旭红1,冯晶旻2
(1.齐齐哈尔大学生命科学与农林学院,黑龙江齐齐哈尔 161006; 2.齐齐哈尔市卫生监督所,黑龙江齐齐哈尔 161005)

燕麦幼苗;亚精胺;渗透胁迫;渗透调节物质;抗氧化特性
干旱是全球性影响农业生产和生态环境的焦点问题。据统计,全球耕地中约有43%受到干旱胁迫[1]。我国是全球13个最贫水的国家之一,干旱、半干旱的土地面积约占国土总面积的52.5%[2],尤其是我国北方处于亚洲季风气候区,旱灾的普遍性和持续性都较严峻。干旱条件下,由土壤溶液水势下降导致的渗透胁迫会使活性氧(ROS)过量积累而对植物产生过氧化损伤,进而破坏生物大分子的结构,使其丧失生理功能,严重影响植株发育,甚至造成死亡[3]。植物在进化过程中,除对生态逆境在形态上作出加强导管组织发育、加大根冠比等适应性改变外,通过上调抗氧化系统活性和抗氧化剂含量、增加胞内溶质、降低细胞水势、维持细胞膨压而进行渗透调节等抵御干旱等逆境胁迫。近年来,有关多胺对植物在逆境下的生理调控作用日益受到关注。
亚精胺(spermidine,Spd)作为多胺(polyamine,PA)中的一种具有强烈生理活性的小分子脂肪族含氮碱,对植物生长发育具有多方面的调节作用。喷施外源Spd可在一定程度上缓解黄瓜[4]、番茄[5]、白三叶[6]等植物的非生物逆境伤害。在逆境下,植物细胞内常会积累大量多胺,能够对多种生物和非生物逆境作出应答。研究表明,亚精胺合成酶基因转入后,拟南芥(Arabidopsisthaliana)受体内亚精胺含量显著增加,耐旱、耐冷、耐盐等特性显著增强[7];高盐胁迫下,外源Spd和精胺(spermine,Spm)通过上调铁超氧化物歧化酶(Fe-SOD)基因的表达,提高了粗齿冷水花(Ulvafasciata)的抗氧化能力,缓解了盐胁迫所导致的氧化损伤[8]。Spd和Spm在DNA复制中能与拓补异构酶之间发生交互作用,稳定酶-模板复合物,且在转录后修饰、蛋白质合成的后加工过程中参与磷酸化等代谢,从而影响DNA的复制、RNA的转录和蛋白质的生物合成[9],在植物的生长发育中介导了胞内离子平衡、酶活调控、细胞分化等多种生理过程。尤其是Spd,除参与植物的性别分化、果实成熟与衰老等过程外,还作为逆境下的直接胁迫保护物质,以其独特的分子结构,在胁迫信号转导中直接参与胁迫抗性机制的构建,被认为是植物对逆境响应中的信号调节枢纽。外源多胺已成功被应用于提高植物的抗逆性。外源Spd可通过提高脯氨酸合成代谢关键酶活性,促进脯氨酸和可溶性糖的积累,从而提高小麦幼苗的保水性和抗旱能力[10];外源Spd通过抑制NADPH氧化酶活性提高抗氧化酶活力,降低玉米叶片内ROS,提高幼苗的抗旱性[11];外源Spd能促进干旱条件下番茄幼苗的糖类转换和利用,通过参与番茄生育早期碳水化合物的代谢,促进植株生长发育[5]。
燕麦(AvenanudaL.)是我国种植历史悠久的粮饲兼用作物,广泛分布于三北地区和青藏高原等16省(区)。近年来,因其含多种活性营养成分及在控制血脂、降低血糖等方面独特的食疗功效,在种植业结构中的地位和价值日益凸显。东北、西北及内蒙农牧交错带大面积种植的燕麦经常遭受频发的春旱甚至春夏连旱的威胁,因此通过探索外源调节物对燕麦抵御干旱胁迫的生理机制,提高其避旱和耐旱能力具有重要意义。而目前有关外源Spd对燕麦在干旱胁迫下的生理调控作用及其生化响应研究鲜见报道。本研究通过叶面喷施不同浓度的Spd,研究其对燕麦幼苗生长、ROS的产生和清除、抗氧化体系的生理响应及渗透调节物质含量的影响,以期为Spd在燕麦抗旱栽培中的应用提供理论依据。
1 材料与方法
1.1 材 料
供试燕麦品种为坝莜1号,由齐齐哈尔市畜牧局提供。亚精胺(spermidine,Spd)为Sigma公司产品,先用去离子水配成100 mmol·L-1母液,4 ℃保存,稀释成相应浓度待用。
1.2 试验设计
试验于2015年3-7月在齐齐哈尔大学生化实验室进行,室内温度20~25 ℃,自然采光,通风良好。将精选的燕麦种子,先经2% NaClO浸泡消毒15 min,去离子水反复冲洗干净后催芽。将露白整齐的种子播于细砂经清水浸泡1 h、高温灭菌(130 ℃,3 h)、定量称重的花盆中,每盆120粒,播深1.5 cm。每3 d用1/4 Hoagland营养液等量浇灌。待幼苗2叶1心时,每盆定苗约90株。
当幼苗长至3叶1心时,将其随机分为三组:第一组为CK1组,进行1/2 Hoagland营养液+叶喷蒸馏水处理;第二组为CK2组,进行1/2 Hoagland 营养液+ PEG-6000 200 g·L-1+叶喷蒸馏水处理;第三组为Spd喷施组,进行1/2 Hoagland 营养液+ PEG-6000 200 g·L-1+叶喷不同浓度Spd处理,Spd设0.3、0.6、0.9和1.2 mmol·L-14个浓度水平(分别用T1~T4表示),Spd每天8:30和16:30叶面喷施2次,每次喷施量为每盆10 mL。共形成6个处理,随机排列,每处理3盆,处理15 d后收获植株进行相关生理指标测定。
1.3 测定项目和方法
1.3.1幼苗株高、根长、干重、根系活力及相对干物质增长率的测定
每处理轻取20株幼苗,去除根部培养基质,用直尺量取株高和最大根长。之后迅速用蒸馏水洗净,110 ℃烘箱杀青10 min后转至75 ℃烘干至衡重,称干重。根系活力用TTC法测定[12]。耐旱性强弱以抗旱系数表示,抗旱系数=处理生物量/对照生物量[13]。以“处理后20株干重/处理前20株干重”计算幼苗干物质相对增长率[10]。
1.3.2 渗透调节物质含量的测定
脯氨酸、可溶性糖、可溶性蛋白和游离氨基酸含量分别用茚三酮比色法、蒽酮比色法、考马斯亮蓝法和茚三酮显色法测定[14]。
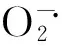
1.3.4 抗氧化剂含量及抗氧化酶活性的测定
采用张志良等[12]的方法测定超氧物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性;抗坏血酸(ASA)含量采用红菲咯啉(BP)用显色法测定[15];抗坏血酸过氧化物酶(APX)活性采用抗坏血酸氧化法测定[15];谷胱甘肽(GSH)含量测定采用DTNB显色法[16];谷胱甘肽还原酶(GR)活性按照NADPH氧化法测定[17]。各生化指标均取顶端全展的功能叶进行测定,3次重复,取平均值。
1.4 统计分析
所有实验数据用平均值±标准误表示,用SPSS统计软件方差分析和Duncan法进行多重比较(P<0.05)。
2 结果与分析
2.1 外源Spd对PEG胁迫下燕麦幼苗生长的影响
PEG胁迫显著降低了燕麦幼苗株高、根长及干物质积累量(表1)。在PEG胁迫下,各浓度外源Spd处理均不同程度地提高了燕麦幼苗的相对干物质增长率和根系活力,促进了幼苗生长。T1(0.3 mmol·L-1Spd)处理增加了幼苗株高和根干重,但对根的伸长和地上部干物质的积累并无明显作用。随着Spd浓度的升高,幼苗生长先增进后减弱,根系活力、抗旱系数及干物质相对增长率也呈相同的变化趋势。在4个Spd处理中以T3处理的幼苗株高、根长及干物质积累量、根系活力、抗旱系数及干物质相对增长率最高,说明小麦苗期叶面喷施适宜浓度的Spd对干旱胁迫的不利影响有缓解作用。
2.2 外源Spd对PEG胁迫下燕麦幼苗叶片渗透调节物质含量的影响
PEG胁迫造成燕麦叶片脯氨酸(Pro)大量积累,其含量比CK1高2.01倍,同时显著提高了可溶性糖和游离氨基酸的含量,降低了可溶性蛋白含量(表2)。在PEG胁迫下,Spd低浓度处理(T1)对Pro和可溶性蛋白的积累影响不大,但使可溶性糖和游离氨基酸含量分别提高了26.67%和降低了16.47%。随Spd浓度的加大,其对Pro和可溶性糖的累积产生明显促进效应,并进一步降低游离氨基酸含量,尤其以0.9 mmol·L-1Spd处理效果最明显。
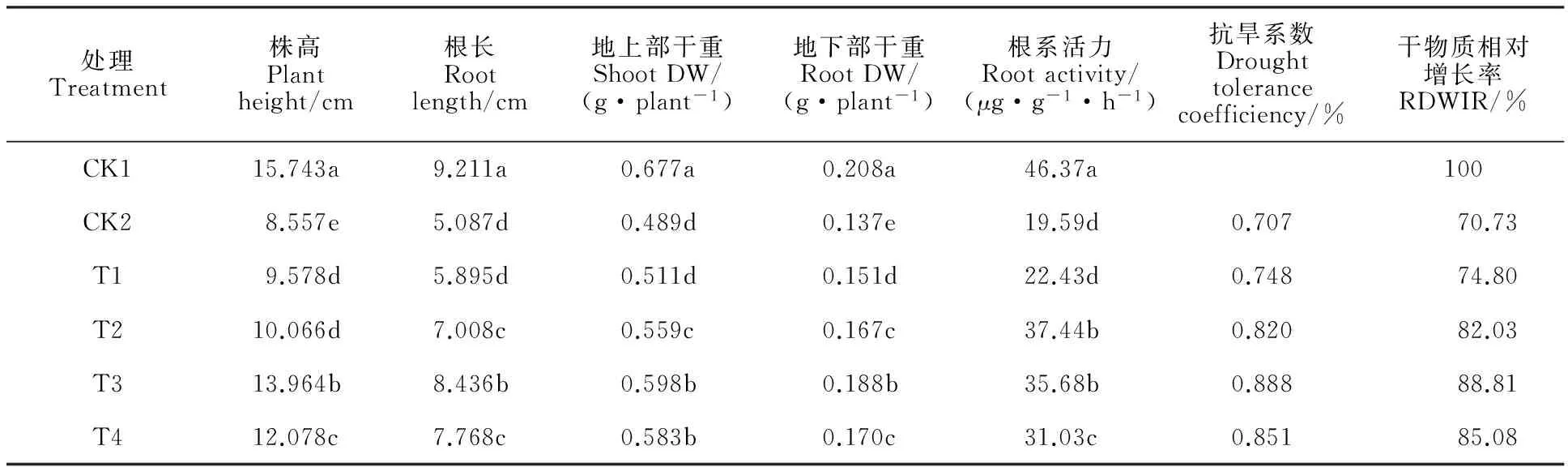
表1 外源亚精胺对PEG胁迫下燕麦幼苗生长的影响Table 1 Effects of exogenous spermidine on the growth of oat seedlings under PEG stress
同一列数据后不同小写字母表示处理间差异显著(P<0.05)。下表同。
DW:Dry weight; RDWIR: Relatively increasing rate of DW; Values with different small letters within the same column are significantly different among the treatments at 0.05 level. The same in other tables.

表2 外源Spd对PEG胁迫下燕麦叶片渗透调节物质含量的影响Table 2 Effects of PEG and exogenous Spd on osmoregulation substance contents in leaves of oat seedlings


处理TreatmentO-·2产生速率O-·2productiverate/(μmol·min-1·g-1FW)H2O2含量H2O2content/(μmol·g-1FW)MDA含量MDAcontent/(μg·g-1FW)CK117.08±0.12d4.39±0.08d3.76±0.11dCK213.29±0.30a12.36±0.38a5.89±0.25aT112.87±0.27a11.65±0.19a5.42±0.48aT29.43±0.44b8.71±0.20b4.89±0.57bT38.66±0.17c6.33±0.08c4.28±0.21cT49.28±0.51b6.97±0.63c4.73±0.61b
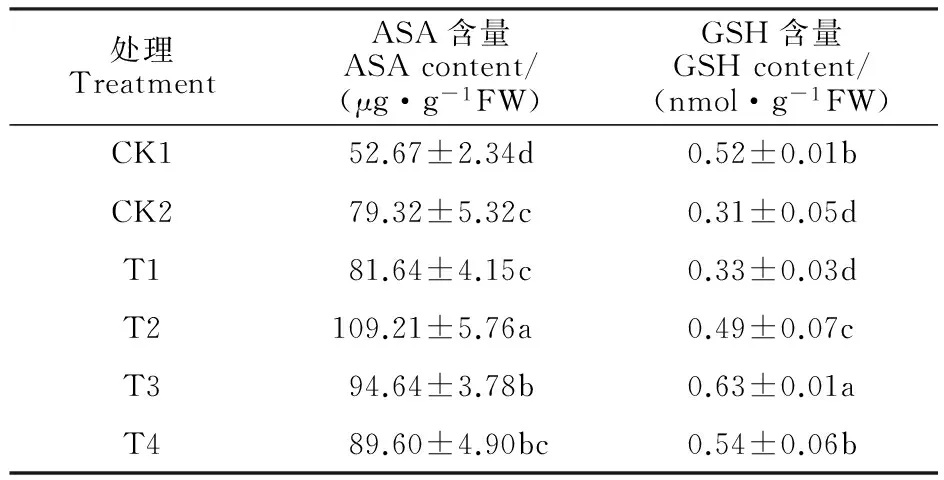
表4 外源Spd对PEG胁迫下燕麦叶片ASA和GSH含量的影响Table 4 Effects of exogenous Spd on contents of ASA and GSH in leaves of oat seedlings under PEG stress
2.4 外源Spd对PEG胁迫下燕麦幼苗叶片ASA和GSH含量的影响
PEG胁迫使燕麦叶片ASA含量激增,导致GSH含量显著下降。在PEG胁迫下,喷施较低浓度(0.3 mmol·L-1)的Spd后,燕麦叶片ASA和GSH含量未发生明显变化;进一步增加Spd浓度后,叶片ASA和GSH含量不同程度提高,且分别以0.6和0.9 mmol·L-1Spd处理的效果最佳,较CK2分别增加37.68%和103%,说明适宜浓度的Spd处理可促进燕麦叶片中的ASA-GSH循环(表4)。
2.5 外源Spd对PEG胁迫下燕麦幼苗叶片抗氧化酶活性的影响
PEG胁迫后,燕麦叶片SOD、POD和APX活性均显著升高,但GR和CAT活性明显下降(表5)。在PEG胁迫下,与CK2相比,0.3 mmol·L-1Spd处理(T1)的4种酶活性均上升,但只有CAT活性变化显著;0.6~1.2 mmol·L-1Spd处理(T2~T4)均显著上调了4种酶活性,其中SOD、CAT和GR活性均以T3处理最高,POD和APX活性分别以T4和T2处理最高。说明适宜浓度的Spd处理可上调燕麦叶片的抗氧化酶活性,有助于增强抗氧化能力。

表5 外源Spd对PEG胁迫下燕麦叶片保护酶活性的影响Table 5 Effects of exogenous Spd on anti-oxidative enzyme activities in oat seedlings under PEG stress
3 讨 论
3.1 Spd对PEG胁迫下燕麦幼苗生长的影响
植物的生长源于根系从环境中吸收养分和水分,同时依靠光合碳氮代谢完成器官发育和形态建成。生物积累量是植物对逆境响应的直接体现,也是遭受生理伤害的综合反映。PEG胁迫下,燕麦幼苗干物重降低,这是因为植株体内ROS过量累积,导致膜结构受损,对光合作用产生抑制,使碳同化产物减少。渗透胁迫会引起生理干旱,导致植株形态建成过程中C/N代谢受阻,尤其是碳架不足,以及渗透调节能耗损失较大,从而抑制了燕麦生长。在本研究中,0.6、0.9 mmol·L-1外源Spd处理明显缓解了PEG胁迫对燕麦幼苗根系活力的不利影响,有利于根系对营养物质的吸收、转运、积累和利用;对ROS产生和积累有显著抑制作用,有助于在PEG胁迫条件下类囊体膜结构的稳定和修复,使叶绿体对光能的吸收和利用能力增强,这可从光合碳同化产物可溶性糖的积累得以印证;由于光合碳代谢为氨基酸的合成提供了碳架和同化力,因此光合能力的改善有利于燕麦叶片氨基酸和可溶性蛋白的积累。非酶抗氧化剂ASA在Spd作用下大量生成,不仅可促进根系的细胞分裂,而且可在ASA氧化酶作用下氧化形成MDHA,进而MDHA通过质膜上的细胞色素b还原和跨膜转运,促进细胞生长[18]。总体来看,PEG胁迫下0.9 mmol·L-1外源Spd处理对燕麦幼苗生长促进效果最佳。
3.2 Spd对PEG胁迫下燕麦幼苗渗透调节作用的影响
渗透调节是植物为适应胁迫逆境而产生的生理应答。可溶性糖是重要的渗透调节物质;Pro既是渗透调节物质,又是抗氧化剂,因其具有极高的水溶性,因而可以调节细胞的渗透势并增加蛋白质的水合度,从而维持细胞的正常功能,因此通过外源物质诱导和调控Pro积累可以有效缓解逆境伤害。杜红阳等[10]报道,渗透胁迫导致小麦叶片Pro合成途径中的关键酶Δ1-吡咯啉-5-羧酸合成酶(P5CS)和Δ1-吡咯啉-5-羧酸还原酶(P5CR)的活性增强,外源Spd处理进一步提高了P5CS和 P5CR活性,由此促进了Pro和可溶性糖的积累,提高了小麦幼苗的保水和抗旱能力。本研究发现,PEG胁迫使燕麦叶片Pro和可溶性糖含量增加,有助于提高原生质的粘度和弹性,增强植株对缺水环境的适应性。0.9、1.2 mmol·L-1Spd叶面处理显著促进了燕麦叶片可溶性糖的累积,这可能与Spd增强了燕麦在干旱条件下碳水化合物代谢,上调了葡萄糖、果糖及蔗糖合成酶的活性有关[5];Spd诱导下Pro含量的加大会进一步增加了细胞液的浓度和原生质胶体束缚水的含量,最大限度地保持细胞与环境的渗透平衡,维持细胞内环境的稳定,提高细胞的保水能力。推测其可能机制:一方面,外源Spd激活了燕麦在渗透胁迫条件下Pro合成途径的关键酶P5CS和P5CR的活性,促进Pro合成;另一方面,在线粒体中催化Pro降解的脯氨酸脱氢酶(ProDH)和吡咯啉-5-羧酸脱氢酶(P5CDH)的氧化降解过程受到抑制,也导致Pro积累增加,这从杜红阳等[10]的研究结果中得到了进一步的印证。
植物在发育过程中,不断需要氨基酸来合成自身组织蛋白和功能性含氮有机物。本试验中,在PEG胁迫下,可能由于较低的ATP水平诱导了蛋白水解酶活性的提高,蛋白质的水解加剧,使可溶性蛋白含量下降,从而导致游离氨基酸含量升高。这与陈立松等[19 ]对荔枝的研究得出水分胁迫下可溶性蛋白含量的下降是由蛋白水解酶活性的提高而使蛋白质降解所致的结论一致。Spd处理后,燕麦叶片游离氨基酸含量随处理浓度加大而下降,可溶性蛋白含量则随Spd处理浓度的加大而升高,并且峰值都出现在0.9 mmol·L-1Spd处理,表明外源Spd通过对过氧化水平的调控,使类囊体膜结构和功能得以修复和稳定,使光合作用同时向碳代谢和氮代谢提供能量和电子,促进了碳素的流动,使可溶性蛋白大幅度增加。其可能的调控机制:首先Spd作为信息分子,在信号转导过程中,先激活腺苷酸环化酶→cAMP升高→蛋白激酶→磷酸化酶激酶→使非组蛋白磷酸化,与组蛋白相互作用,导致组蛋白与DNA解聚、DNA解旋,从而诱导了逆境蛋白相关基因的高水平表达,增加了蛋白质的合成;其次在蛋白质翻译后,以多聚阳离子状态存在的多胺,与胞内某些蛋白质之间因电荷效应发生共价交联,稳定了蛋白质的结构,减缓了蛋白质的降解,起到了维持细胞内环境稳定的作用[9]。
3.3 Spd对PEG胁迫下燕麦幼苗ROS产生及抗氧化体系的影响
植物体内的抗氧化体系除抗氧化酶外,ASA-GSH循环也是植物体内重要的抗氧化系统。ASA 除可清除(OH-)羟基自由基、淬灭单线态氧外,还可转化为维生素E。APX是ASA-GSH氧化还原途径中重要的组分,ASA在APX作用下与H2O2反应,H2O2接受GSH脱氢产生的NADPH的电子还原成H2O,ASA则被氧化为单脱氢抗坏血酸(MDHA)和脱氢抗坏血酸(DHA)。有毒的H2O2通过Halliwell-Asada途径清除过程中,对还原型GSH的再生具重要意义,其活性高低与ASA含量密切相关[22 ]。APX活性的提高是在干旱逆境下对ROS过量生成的应激反应,标志着ROS清除能力的进一步增强。GR是一种黄素蛋白酶,在NADPH作用下催化氧化型谷胱甘肽(GSSG)还原为GSH,因此其在氧化还原体系中使胞内谷胱甘肽库保持在还原状态,从而缓解氧化损伤。试验结果显示,渗透胁迫下,可能是脱氢抗坏血酸(DHA)在脱氢抗坏血酸还原酶(DHAR)和单脱氢抗坏血酸还原酶(MDHAR)的作用下,进行逆境应答,大量还原生成ASA而消耗了还原力,因此不能将GSSG还原为GSH,从而使GR活性降低。0.9 mmol·L-1Spd处理,通过降低DHAR活性,提高了GR活性和GSH含量,使ASA-GSH循环的进行有助于抗氧化物质的积累。本研究表明,渗透胁迫降低了叶片GSH含量,说明可能由于逆境胁迫,H2O2等ROS持续积累并被GSH还原,结果导致GSH不断被氧化为GSSG,从而使之含量下降;PEG胁迫处理燕麦叶片ASA含量的升高是对逆境的一种保护性应答。作为抗氧化剂,ASA和GSH既可通过酶促和非酶促反应清除ROS,还可以通过ASA-GSH循环途径清除ROS。0.9 mmol·L-1Spd处理显著提高了渗透胁迫下ASA和GSH水平,且APX活性的上调与ASA含量的增加呈现了高度的同步性。ASA含量的增加又导致GSH含量的升高。
综上所述,0.9 mmol·L-1外源Spd叶喷处理,可有效降低ROS和MDA生成量,使膜的氧化损伤得以修复,有助于膜结构的稳定,提高了可溶性糖、脯氨酸、游离氨基酸和可溶性蛋白等渗透调节物质的含量,显著提高了渗透胁迫下燕麦叶片SOD、POD、CAT、APX和GR活性和ASA和GSH等抗氧化剂含量。这说明外源Spd可高效修复燕麦幼苗因渗透胁迫引起的伤害,恢复和维持生理代谢和生化反应的恒稳状态,从而增强了渗透胁迫下燕麦幼苗的抗氧化胁迫能力,使燕麦幼苗在生理缺水逆境下的生长抑制得以缓解,提高了燕麦幼苗的抗旱性。
[1] 刘建新,王金成,王瑞娟,等.旱盐交叉胁迫对燕麦幼苗叶片生理特性的影响[J].干旱地区农业研究,2014,32(3):24.
LIU J X,WANG J C,WANG R J,etal.Effects of drought and salinity combined stress on activities of physiol`ical characteristics inAvenanudaseedling leaves [J].AgriculturalResearchintheAridAreas,2014,32(3):24.
[2] 李雪芹,金松恒.干旱胁迫对假俭草气体交换和叶绿素荧光特性的影响[J].中国农学通报,2010,26(8):170.
LI X Q,JIN S H.Effects of drought stress on gas exchange and chlorophyll fluorescence characteristics inEremochloaophiuroides[J].ChineseAgriculturalScienceBulletin,2010,26(8):170
[3] 单长卷,赵新亮,汤菊香.水杨酸对干旱胁迫下小麦幼苗抗氧化特性的影响[J].麦类作物学报,2014,34(1):91.
SHAN C J,ZHAO X L,TANG J X.Effects of exogenous salicylic acid on antioxidant properties of wheat seedling under drought stress [J].JournalofTriticeaeCrops,2014,34(1):91.
[4] 李 娜,陈 红,裴孝伯.外源亚精胺对盐胁迫下黄瓜幼苗耐盐性的影响[J].热带作物学报,2013, 34(7):1359.
LI N,CHEN H,PEI X B.Effects of extraneous spermidine on the salt tolerance in cucumber seedlings under salt stress [J].ChineseJournalofTropicalCrops,2013, 34(7): 1359.
[5] 闫 刚,张春梅,邹志荣.外源亚精胺对干旱胁迫下番茄幼苗碳水化合物代谢及相关酶活性的影响[J].干旱地区农业研究,2012,30(1):143.
YAN G,ZHANG C M,ZOU Z R.Effects of exogenous spermidine on metabolism of nonstructural carbonhydrate and involved activity of enzymes of tomato seedlings under drought stress [J].AgriculturalresearchintheAridAreas,2012,30(1):143.
[6] 李 州,彭 燕.亚精胺对水分胁迫下白三叶脯氨酸代谢、抗氧化酶活性及其基因表达的影响[J].草业学报,2015,24(4):148.
LI Z,PENG Y.Effects of spermidine on proline metabolism,antioxidant enzyme activity and gene expression in white clover leaves under water stress [J].ActaPrataculturaeSinica,2015,24(4):148.
[7] KASUKABE Y,HE L,NADA K,etal.Over expression of spermidine synthase enhances tolerance to multiple environmental stress and up-regulates the expression of various stress-regulated genes in transgenicArabidopsisthaliana[J].Plant&CellPhysiology,2004,45:712.
[8] SUNG M S,CHOW T J,LEE T M.Polyamine acclimation alleviates hypersalinity-induced oxidative stress in a marine green macroalga,Ulvafasciata,by modulation of antioxidative enzyme gene [J].JournalofPhycology,2011,47(3):538.
[9] 杜红阳,常云霞,刘怀攀.多胺的作用机理研究进展[J].周口师范学院学报,2010,27(5):88.
DU H Y,CHANG Y X,LIU H P.Study advance of function mechanism of polyamines [J].JournalofZhoukouNormalUniversity,2010,27(5):88.
[10] 杜红阳,李青芝,杨青华,等.亚精胺对渗透胁迫下小麦幼苗渗透调节物质含量和脯氨酸代谢酶活性的影响[J].麦类作物学报,2014,34(8):1092.
DU H Y,LI Q Z,YANG Q H,etal.Effects of spermidine on the content of osmoregulation substance and activity of proline metabolic enzyme in wheat seedling under osmotic stress [J].JournalofTriticeaeCrops,2014,34(8):1092.
[11] 刘怀攀,胡炳义,刘天学,等.亚精胺对渗透胁迫的玉米幼苗叶片NADPH氧化酶和抗氧化酶活性的影响[J].河南农业大学学报,2007,41(4):363.
LIU H P,HU B Y,LIU T X,etal.Effects of spermidine on the activities of NADPH oxidase and antioxidation enzymes in leaves of maize seedlings under osmotic stress [J].JournalofHenanAgriculturalUniversity,2007,41(4):363.
[12] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].第四版.北京:高等教育出版社,2009:32,227.
ZHANG Z L,QU W Q,LI X F.Laboratory Guide of Plant Physiology(4rd Ed.) [M].Beijing:Higher Education Press,2009:32,218.
[13] 李国瑞,马宏亮,胡雯媚,等.西南麦区小麦品种萌发期抗旱性的综合鉴定及评价[J].麦类作物学报, 2015,35(4):479.
LI G R, MA H L,HU W M,etal.Identification and evaluation of wheat cultivars for drought resistance during germination in southwest area [J].JournalofTriticeaeCrops,2015,35(4):479.
[14] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:184-195.
LI H S.Physiology and Biochemistry of Plant Experimental Principle and Technology [M].Beijing:Higher Education Press,2000:184-195.
[15] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000:172.
ZOU Q.Laboratory Guide of Plant Physiology [M].China Agriculture Press,2000:172.
[16] 黄爱缨,吴珍龄.水稻谷胱甘肽过氧化物酶的测定法[J].西南农业大学学报,1999,21(4):324.
HUANG A Y,WU Z L.Determination of glutathione peroxidase in rice seedlings [J].JournalofSouthwestAgriculturalUniversity,1999,21(4):324.
[17] SCHAEDLE M,BASHAM J A.Chloroplast glutathione reductace [J].PlantPhysiol,1977,59:1011.
[18] 安华明,陈力耕,樊卫国,等.高等植物中维生素C的功能、合成及代谢研究进展[J].植物学通报,2004,21(5):608.
AN H M,CHEN L G,FAN W G,etal.Advances in research on function,biosynthesis and metabolism of ascorbic acid in higher plant [J].ChineseBulletinofBotany,2004,21(5):608.
[19] 陈立松,刘星辉.水分胁迫对荔枝叶片氮和核酸代谢的影响与其抗旱性的关系[J].植物生理学报,1999,25(1):49.
CHEN L S,LIU X H.Effects of water stress on nitrogen and nucleic acid metabolisms in litchi(LitchichinensisSonn.)leaves and their relations to drought-resistance [J].ActaPhytophysiologicaSinica,1999,25(1):49.
[20] WEN X P,BAN Y,INOUE H,etal.Aluminum tolerance in a spermidine synthase-overexpressing transgenic European pear is correlated with the enhanced level of spermidine via alleviating oxidative status [J].EnvironmentalandExperimentalBotany,2009,66:471.
[21] HE L X,BAN Y,INOUE H,etal.Enhancement of spermidine content and antioxidant capacity in transgentic pear shoots overexpressing apple spermidine synthase in response to salinity and hyperosmosis [J].Phytochemistry,2008,69:2133.
[22] 朱为民,丁海东,齐乃敏,等.Cd2+胁迫对番茄幼苗抗坏血酸-谷胱甘肽代谢的影响[J].华北农学报,2005,20(3):50.
ZHU W M,DING H D,QI N M,etal.Effects of Cd2+stress on ascorbate-glutathion cycle metabolism in tomato seedlings [J].ActaAgriculturaeBoreali-sinica,2005,20(3):50.
Effect of Extraneous Spermidine on Growth and some Physiological Characteristics in Oat Seedlings under PEG Stress
WU Xuhong1,FENG Jingmin2
(1.College of Life Sciences,Agriculture and Forestry,Qiqihar University,Qiqihar,Heilongjiang 161006,China;2.Qiqihaer Sanitary Supervision Institute,Qiqihaer,Heilongjiang 161006,China)

Oat seedlings;Spermidine;Osmotic stress;Osmoregulation substance;Antioxidant characteristics
时间:2017-01-03
2016-04-07
2016-05-26
E-mail:wvg25583681129@sina.com
S512.1;S311
A
1009-1041(2017)01-0122-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20170103.1629.034.html

