嗜酸性肉芽肿性多血管炎并发肾脏受累的临床特征
张上珠杨宏仙费允云张 文赵 岩张奉春曾小峰
(中国医学科学院北京协和医学院北京协和医院风湿免疫科风湿免疫病学教育部重点实验室,北京100730)
嗜酸性肉芽肿性多血管炎 (eosinophilic granulomatouswith polyangiitis,EGPA),是一种少见的血管炎性疾病,其特征为过敏性鼻炎、哮喘、血嗜酸性粒细胞增多和系统性血管炎,以前被称为Churg-Strauss综合征 (Churg-Strauss syndrome,CSS)。绝大多数患者血嗜酸性粒细胞增多 (>1.5×109/L或>10%)。
大约50%的患者抗中性粒细胞胞浆抗体 (antinertrophil cytoplasmic antibody,ANCA)阳性,大多数为核周型 (perinuclear-ANCA,p-ANCA),特异性抗原为髓过氧化物酶 (myeloperoxidase-ANCA,MPOANCA),也有胞浆型 (cytoplastic-ANCA,c-ANCA)[1]。EGPA是ANCA相关性血管炎 (ANCA associated vasculitis,AAV)的一种。据国外报道,EGPA患者肾脏受累的患病率差异很大,从20%到88%不等[2]。肾脏病理常较轻,表现为局灶性和节段性坏死性肾小球肾炎[3]。肾脏受累临床表现可为血尿、蛋白尿,但也可出现急进性肾小球肾炎,影响患者肾功能。国内对EGPA的肾脏受累鲜有报道,本文通过回顾性病例分析,以期为EGPA肾脏病变早期诊断和早期治疗提供借鉴。
对象与方法
研究对象
纳入北京协和医院2000至2017年EGPA并发肾脏受累住院患者。EGPA诊断满足1990年美国风湿病学会 (American College of Rheumatology,ACR)推荐的EGPA分类标准[4]。肾脏受累定义为:肾功能不全[血清肌酐>1.4 mg/d(124μmol/L)]和 (或)尿检异常 (24 h尿蛋白>0.3 g和每高倍镜视野下≥10个红细胞,除外感染因素所致血尿)[2]。部分患者因病情需要进行肾脏活检。
方法
资料收集:回顾性分析2000年1月至2017年1月北京协和医院收治的确诊EGPA的73例患者的临床资料,其中临床资料齐全者66例。临床资料包括一般信息、病史、体征、实验室检查 [血常规,尿常规及沉渣,24 h尿蛋白,血生化,红细胞沉降率 (erythrocyte sedimentation rate,ESR),超敏 C反应蛋白 (hypersensitive C-reactive protein,hsCRP),免疫球蛋白,ANCA等自身抗体],肾脏超声,胸部CT,心脏超声,肾脏穿刺活检病理,治疗和预后等。
根据五因子预后评分 (five factor score,FFS)标准获得每例患者预后评分: (1)尿蛋白量>1 g/d;(2)消化道严重受累;(3)血肌酐>140μmol/L;(4)心肌病;(5)中枢神经系统受累[5]。
统计学分析
统计学分析采用SPSS 17.0软件。定量资料采用标准偏差的平均数或中位数表示,定性资料用百分比表示。符合正态分布的定量资料,采用t检验或方差分析;不符合正态性分布的定量资料,采用非参数检验分析。两组定性资料比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一般情况
73例EGPA患者中17例 (23.3%)存在肾脏受累。17例肾脏受累患者中12例为男性,5例为女性;发病年龄为20~69岁 [平均年龄 (43.5±14.1)岁]。2例患者以肾脏病变为EGPA的首发表现。肾脏受累的EGPA患者平均病程 (51.5±92.9)个月 (表1)。
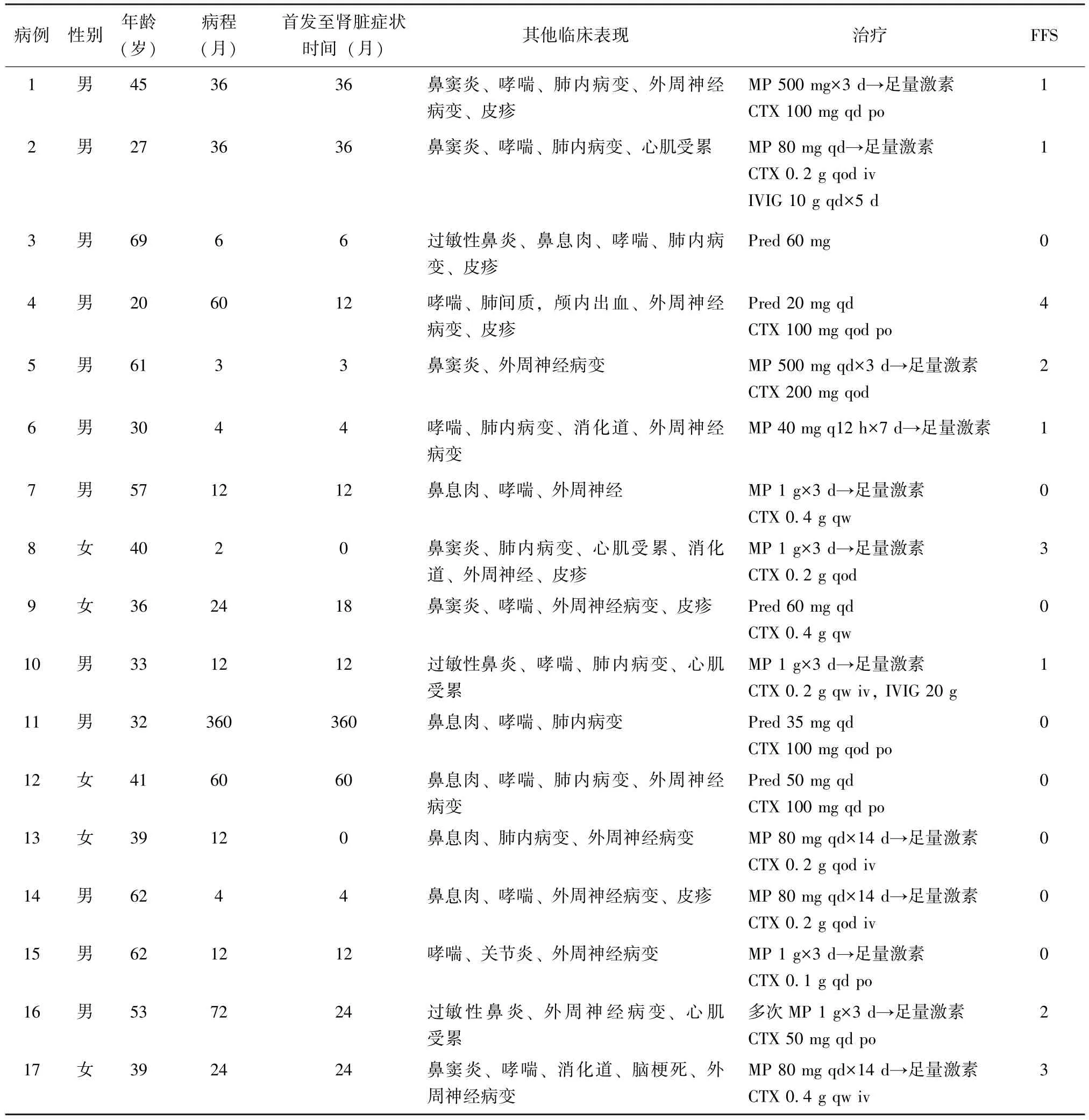
表1 17例EGPA并发肾脏受累患者的临床资料Table 1 Clinical information of 17 eosinophilic granulomatous with polyangiitis patients combined with renal involvement
与49例无肾脏受累的患者相比,肾脏受累的患者在性别、年龄和病程上并无统计学差异 (表2)。
临床表现
15例患者出现血尿,14例出现蛋白尿,7例患者肌酐升高,3例患者出现少尿或无尿。其他伴随临床表现包括鼻窦炎 (6例),鼻息肉 (6例),过敏性鼻炎 (3例),皮肤损害 (7例),哮喘 (13例),肺内病变 (12例),心肌受累 (4例),消化系统受累(3例),中枢神经系统受累 (2例),外周神经病变(13例)(表1)。
17例肾脏受累患者与49例无肾脏受累的患者相比,在伴随临床症状上并无显著差别 (表2)。
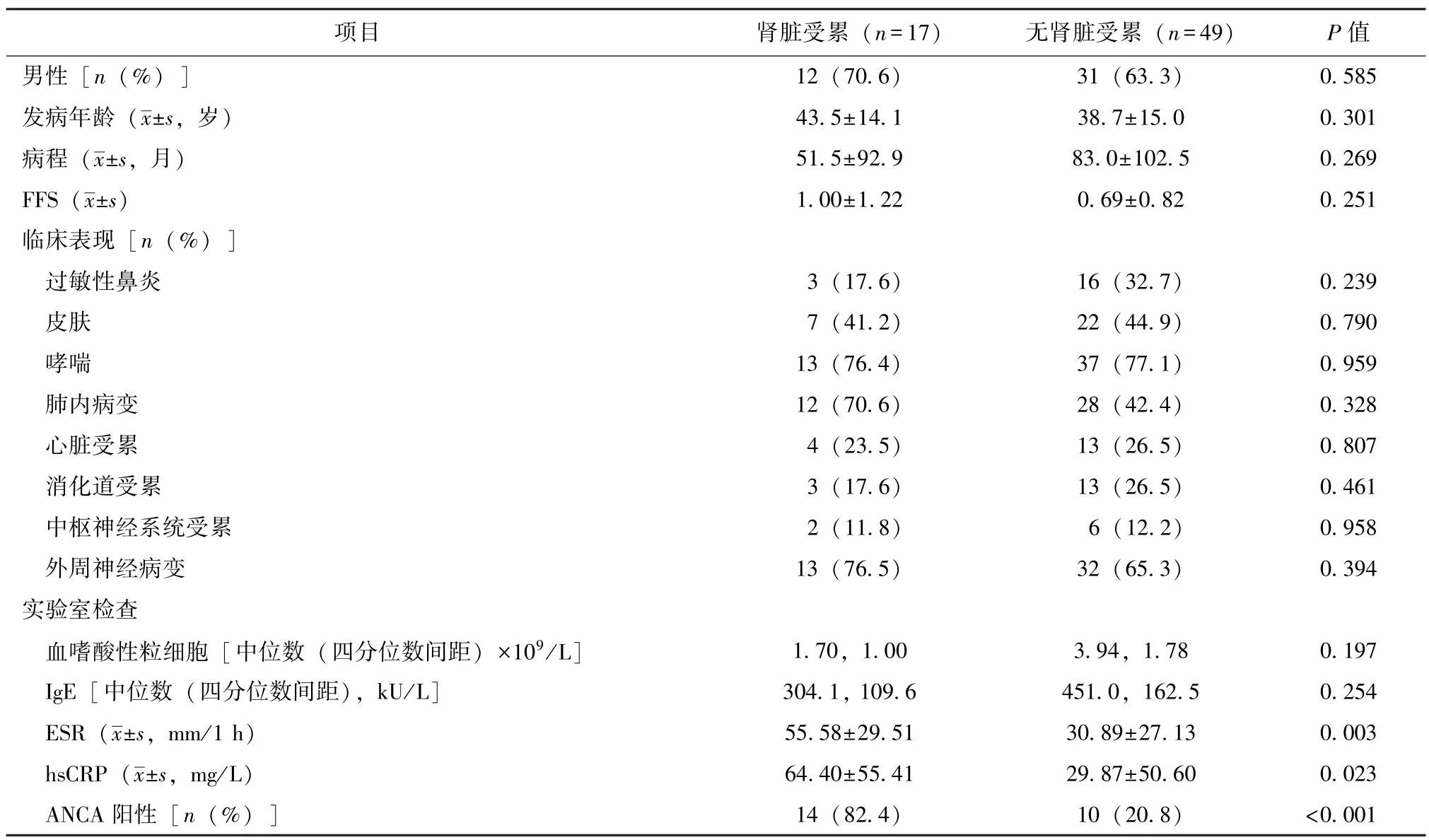
表2 EGPA肾脏受累患者与无肾脏受累患者临床表现与实验室检查比较Table 2 Comparison for clinical features and laboratory tests of EGPA-renal involvement and non-renal involvement patients
实验室检查
17例患者血嗜酸性粒细胞均增高 [(4.10±4.09)×109/L]。15例患者有肾小球来源的镜下血尿,14例有蛋白尿 [24 h尿蛋白 (1.04±0.94)g]。其中8例患者出现急性肾损伤 [血肌酐 (中位数122.5μmol/L,四分位数 105.0μmol/L)]。16例患者 ESR增快[(55.58±29.51)mm/1 h],14例患者 hsCRP升高[(64.40±55.41)mg/L]。14例患者ANCA阳性,其中6例p-ANCA和MPO均阳性,5例仅p-ANCA阳性,1例仅c-ANCA阳性,2例c-ANCA和MPO阳性。2例患者抗核抗体阳性。13例患者肌电图提示神经源性损害。2例患者进行了肾脏穿刺活检,病理表现均为局灶节段性肾小球坏死,伴新月体形成。
17例肾脏受累患者与49例无肾脏受累的患者相比,ANCA阳性比例显著升高 (82.4%vs.20.8%,P<0.001),ESR显著升高 [(55.58±29.51)mm/1 hvs.(30.89±27.13)mm/1 h,P=0.003],hsCRP显著升高 [(64.40±55.41)mg/Lvs.(29.87±50.60)mg/L,P=0.023],其余化验检查无统计学差异 (表2)。
治疗与结局
17例肾脏受累患者中,2例应用中等剂量糖皮质激素治疗,15例患者应用大剂量糖皮质激素 [泼尼松1~2mg/(kg·d)]治疗,其中8例患者接受激素冲击治疗。15例同时应用环磷酰胺 (cyclophos-phamide,CTX)治疗。1例应用静脉注射人免疫球蛋白治疗 (intravenous immunoglobulin,IVIG) 治疗 (表1)。(表1)。大多数患者对激素和免疫抑制剂反应好。与治疗前相比,治疗后患者的血嗜酸性粒细胞 [(4.10±4.09) ×109/Lvs.(0.96±1.61) ×109/L,P=0.012],ESR[(55.58±29.51)mm/1 hvs.(24.24±18.93)mm/1 h,P=0.001]和hsCRP[(64.4±55.41)mg/Lvs.(23.04±26.86)mg/L,P=0.013]均显著下降。24 h尿蛋白 [(1.04±0.94)gvs.(0.93±1.06)g,P=0.787]和血肌酐 [(150.71±156.21)μmol/Lvs.(110.07±89.03) μmol/L,P=0.382]无显著下降。
讨 论
EGPA是AAV的一种,它可以导致多脏器受累,最常见的是过敏性鼻炎和哮喘,其他受累脏器包括心脏、消化道、肾脏和神经系统等。国外报道发病率为每年每百万分之0.5~6.8[6-7]。Chen等[8]研究发现EGPA占AAV患者的5.0%,这与日本的报道[9]类似,但欧洲研究报道的比例更低。研究发现35%~50%的EGPA患者为ANCA阳性,且大多数是MPOANCA阳性[10-11]。据报道ANCA阳性的EGPA患者肾脏疾病的发病率高[8]。
本研究发现北京协和医院住院EGPA患者肾脏受累患者占23.3%,患者肾脏受累主要表现为血尿、蛋白尿,少数表现为血肌酐升高,甚至急进性肾小球肾炎。国外研究报道EGPA肾脏受累比例在20%~88%[2]。Sinico等[2]研究发现25%的患者存在肾脏症状,表现为单纯尿检异常到急进性肾小球肾炎,也有患者因肾功能衰竭而进行长期透析。以往研究报道EGPA患者的肾脏受累概率较其他AAV低,肾脏受累通常是轻度的,具有良性的进程,这是EGPA和其他AAV的不同之处[6]。但本研究和以往研究均发现EGPA患者可出现急进性肾小球肾炎,甚至导致不可逆的肾功能不全,需要肾脏替代治疗,严重影响患者生活质量。因此临床医师应重视EGPA患者的肾脏受累情况,对急进性肾小球肾炎要抓紧治疗时机,积极治疗。
以往研究发现ANCA阳性的EGPA患者比阴性的患者显著多见小血管炎相关症状,比如肾脏受累,单神经炎和紫癜[10-11];ANCA阴性患者显著多见心脏受累和肺部受累,并推测ANCA阴性患者的临床表现多由嗜酸性粒细胞浸润所致,而ANCA阳性患者的临床表现则主要由坏死性血管炎所致[12-13]。EGPA肾脏受累的典型病理表现为局灶节段坏死性肾小球肾炎[1],严重者可出现新月体肾炎[14-15],偶尔发现嗜酸性小管间质肾炎[16]。研究表明肾脏受累的患者,特别是坏死性新月体性肾小球肾炎患者通常为ANCA阳性,多对MPO具有特异性,这表明ANCA阳性可能与EGPA坏死性毛细血管炎相关,而导致EGPA患者的肾损伤更严重[17]。因此,对于ANCA阳性患者,更要警惕肾脏病变的发生,积极监测尿常规和肾功能,早期发现肾脏受累,尽早治疗。
以往研究发现糖皮质激素联合环磷酰胺对并发肾脏受累的EGPA患者治疗有效[18]。本研究17例患者中15例应用了大剂量激素联合环磷酰胺的治疗,治疗效果好,与以往研究类似。此外,利妥昔单抗(rituximab,RTX)已被证实在多种自身免疫性疾病的治疗中有效,包括AAV[19-20]。有个案研究发现RTX对于难治性 (糖皮质激素联合环磷酰胺疗效欠佳)EGPA患者治疗有效[21-22]。Cartin-Ceba等[23]分析3例并发肾脏受累的EGPA患者应用RTX治疗,结果表明RTX可以安全和成功地治疗EGPA,因此值得进一步研究其在EGPA治疗中的作用。
Sinico等[2]研究发现仅1例患者达到终末期肾衰竭,在随访5年后没有患者血肌酐水平加倍。这与Keogh等[13]的研究结果相似,即肾脏复发情况较少。表明经治疗后EGPA患者肾脏本身复发较为少见,且肾脏本身的长期预后较好。也有研究发现肾脏受累的EGPA患者5年死亡率较高[2],提示肾脏受累为预后差的因素。本研究对住院期间肾脏受累和无肾脏受累患者的FFS进行了比较分析,并无显著差异。另有研究发现24 h尿蛋白大于1 g是EGPA患者死亡率增加的强危险因素[24]。因此,应密切随访肾脏受累的EGPA患者,及时发现患者病情变化,尽早处理,以期对预后有所改善。
本研究尚存在局限性,有待于进一步完善。一是扩大样本量,纳入门诊患者资料,从而更准确分析EGPA患者肾脏受累特点;二是可对患者进行长期随访,以研究肾脏受累与EGPA患者预后的关系。
综上,本研究发现EGPA患者可出现肾脏受累,肾脏受累常表现为镜下血尿和蛋白尿,少数出现急进性肾小球肾炎。ANCA阳性EGPA患者多见肾脏受累和外周神经受累,少见过敏性鼻炎。应用激素和环磷酰胺治疗效果好。
[1]Eustace JA,Nadasdy T,Choi M.The Churg Strauss Syndrome[J].J Am Soc Nephrol,1999,10:2048-2055.
[2]Sinico RA,Toma L Di,Maggiore U,et al.Renal involvement in Churg-Strauss syndrome[J].Am JKidney Dis,2006,47:770-779.
[3]Noth I,Strek ME,Leff AR.Churg-Strauss syndrome[J].Lancet,2003,361:587-594.
[4]Masi AT,Hunder GG,Lie JT,et al.The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome(allergic granulomatosis and angiitis) [J].Arthritis Rheum,1990,33:1094-1100.
[5]Patil SB,Vanikar AV,Gumber MR,et al.Churg-Strauss syndrome presenting with acute kidney injury in a case of primary focal segmental glomerulosclerosis[J].Int Urol Nephrol,2014,46:211-215.
[6]Lanham JG,Elkon KB,Pusey CD,et al.Systemic vasculitis with asthma and eosinophilia:a clinical approach to the Churg-Strauss syndrome[J].Medicine,1984,63:65-81.
[7]Mahr A,Guillevin L,Poissonnet M,et al.Prevalences of polyarteritis nodosa,microscopic polyangiitis,Wegener’ s granulomatosis,and Churg-Strauss syndrome in a French urban multiethnic population in 2000:a capture-recapture estimate[J].Arthritis Rheum,2004,51:92-99.
[8]Chen Y,Ding Y,Liu Z,et al.Long-term outcomes in antineutrophil cytoplasmic autoantibody-positive eosinophilic granulomatosiswith polyangiitis patientswith renal involvement:a retrospective study of14 Chinese patients[J].BMC Nephrology,2016,17:101.
[9]Horai Y,Miyamura T,Hirata A,et al.Churg-Strauss syndrome:a retrospective study of 11 cases from a single center in Japan[J].Int J Rheum Dis,2010,13:e6-e10.
[10]Sinico RA,Di Toma L,Maggiore U,et al.Prevalence and clinical significance of antineutrophil cytoplasmic antibodies in Churg-Strauss syndrome[J].Arthritis Rheum,2005,52:2926-2935.
[11]Sable-Fourtassou R,Cohen P,Mahr A,et al.Antineutrophil cytoplasmic antibodies and the Churg-Strauss syndrome[J].Ann Intern Med,2005,143:632-638.
[12]Reida J,Harrison BD,Watts R,et al.Churg-Strauss syndrome in a district hospital[J].QJM,1998,91:219-229.
[13]Keogh KA,Specks U.Churg-Strauss syndrome:clinical presentation,antineutrophil cytoplasmic antibodies,and leukotriene receptor antagonists[J].Am JMed,2003,115:284-290.
[14]Clutterbuck EJ,Evans DJ,Pusey CD.Renal involvement in Churg-Strauss syndrome[J].Nephrol Dial Transpl,1990,5:161-167.
[15]Kikuchi Y,Ikehata N,Tajima O,et al.Glomerular lesions in patients with Churg-Strauss syndrome and the anti-myeloperoxidase antibody [J].Clin Nephrol,2001,55:429-435.
[16]Richer C,Mouthon L,Cohen P,et al.IgA glomerulonephritis associated with microscopic polyangiitis or Churg-Strauss syndrome[J].Clin Nephrol,1999,52:47-50.
[17]Sokołowska B,Szczeklik W,Włudarczyk A,et al.ANCA-positive and ANCA-negative phenotypes of eosinophilic granulomatosis with polyangiitis(EGPA):Outcome and long-term follow-up of 50 patients from a single polish centre[J].Clin Exp Rheumatol,2014,32:S41-47.
[18]Bosch X,Guilabert A,Espinosa G,etal.Treatmentofantineutrophil cytoplasmic antibody associated vasculitis:a systematic review[J].JAMA,2007,298:655-669.
[19]Stone JH,Merkel PA,Spiera R,et al.Rituximab versus cyclophosphamide for ANCA-associated vasculitis[J].N Engl JMed,2010,363:221-232.
[20]Jones RB,Furuta S,Tervaert JWC,et al.Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis:2-year results of a randomised trial[J].Ann Rheum Dis,2015,74:1178-1182.
[21]Thiel J,Hässler F,Salzer U,et al.Rituximab in the treatment of refractory or relapsing eosinophilic granulomatosis with polyangiitis(Churg-Strauss syndrome)[J].Arthritis Res Ther,2013,1(5):R133.
[22]Dønvik KK,Omdal R.Churg-Strauss syndrome successfully treated with rituximab[J].Rheumatol Int,2011,31:89-91.
[23]Cartin-Ceba R,Keogh KA,Specks U,et al.Rituximab for the treatment of Churg-Strauss syndrome with renal involvement[J].Nephrol Dial Transplant,2011,26:2865-2871.
[24]Hauer H,Bajema IM,Hagen EC,et al.Long-term renal injury in ANCA-associated vasculitis:an analysis of 31 patientswith follow-up biopsies[J].Nephrol Dial Transplant,2002,17:587-596.

